

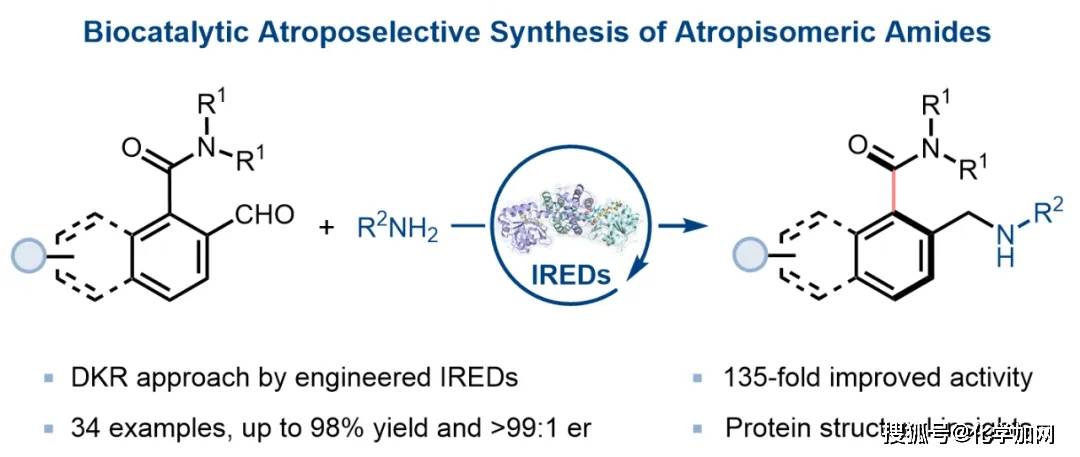
轴手性分子作为一类优势骨架,在天然产物、药物化学、不对称催化及材料科学等多个研究领域展现出广阔的应用前景。除最为常见的联芳基轴手性结构外,非联芳基类阻转异构体,如酰胺、苯乙烯、苯胺及酰亚胺等化合物,因其独特的轴向手性以及多样化的功能,近年来受到广泛关注(图1A)。其中,芳基酰胺类化合物因Caryl–Camide键的旋转受限而表现出稳定的轴手性,在生物活性分子的构建及不对称催化等领域具有重要应用价值。然而,该类轴手性芳基酰胺的不对称催化合成策略仍不够成熟,其主要挑战在于Caryl–Camide键的旋转能垒相对较低,使得该手性轴的立体化学控制与构型保持变得尤为困难。
近年来,生物催化在构建轴手性分子领域取得显著进展,多种酶催化剂—从传统脂肪酶、酮还原酶到亚胺还原酶、烯烃还原酶、细胞色素P450乃至人工金属酶—已被成功应用于轴手性分子的不对称合成。然而,现有研究多集中于经典的联芳基骨架体系,针对轴手性酰胺的酶催化构建方法仍无报道(图1B)。
近日,中国医学科学院/北京协和医学院医药生物技术研究所付海根课题组与宋丹青课题组合作,利用亚胺还原酶(IREDs)催化的动态动力学拆分策略,首次实现了轴手性芳基酰胺类分子的酶催化不对称合成。该DKR过程包含两个关键步骤:首先,邻位含有醛基的芳香酰胺底物(rac-4a)可借助酰胺氮原子的孤对电子与醛基之间产生n→π相互作用,有效降低手性轴的旋转能垒,促使底物快速消旋;随后,IREDs通过高度立体选择性地还原其中一种亚胺对映体,最终高效生成光学纯的芳香酰胺类轴手性产物(图1C)。
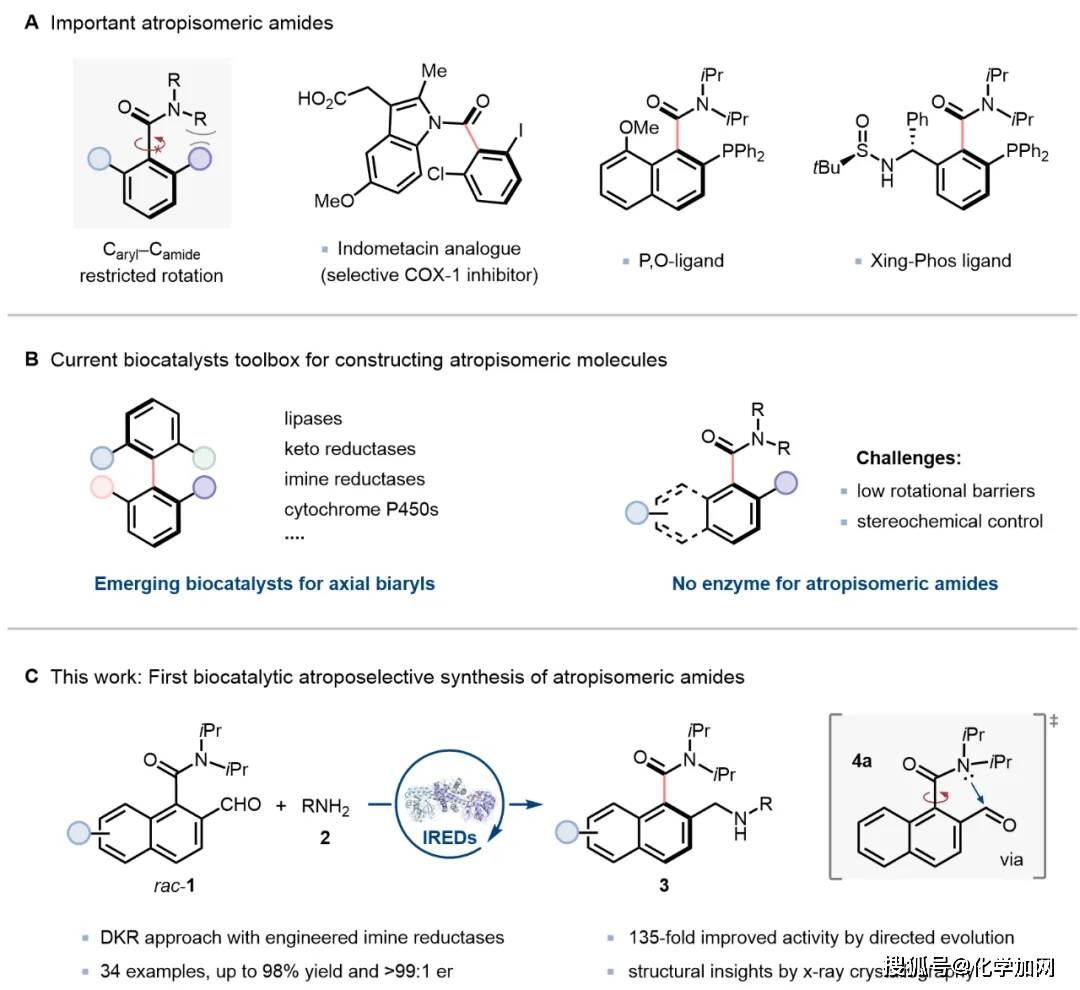
图1. 生物催化合成芳基酰胺类化合物。图片来源:J. Am. Chem. Soc.
作者首先以消旋萘甲酰胺醛4a与苄胺5a作为模板底物,对一系列野生型亚胺还原酶(IREDs)进行筛选,发现来源于Kutzneria albida的IRED-68虽在初步筛选中活性较低(产率10%),但对目标产物表现出优异的立体选择性(96:4 er)。为进一步提升催化效率,研究团队解析了IRED-68的蛋白晶体结构,并基于结构信息对其活性中心的13个关键残基进行了迭代饱和突变,最终获得四重突变体 IRED-68-M4(V123Q/S233G/V232H/A122T)。该突变体相较于野生型蛋白,比活性提高了135倍。在后续反应优化中,采用粗酶冻干粉(4 mg/mL)并添加表面活性剂TPGS-750-M(2 wt%),模型反应的产率可提高至94%,对映选择性达到99:1 er。
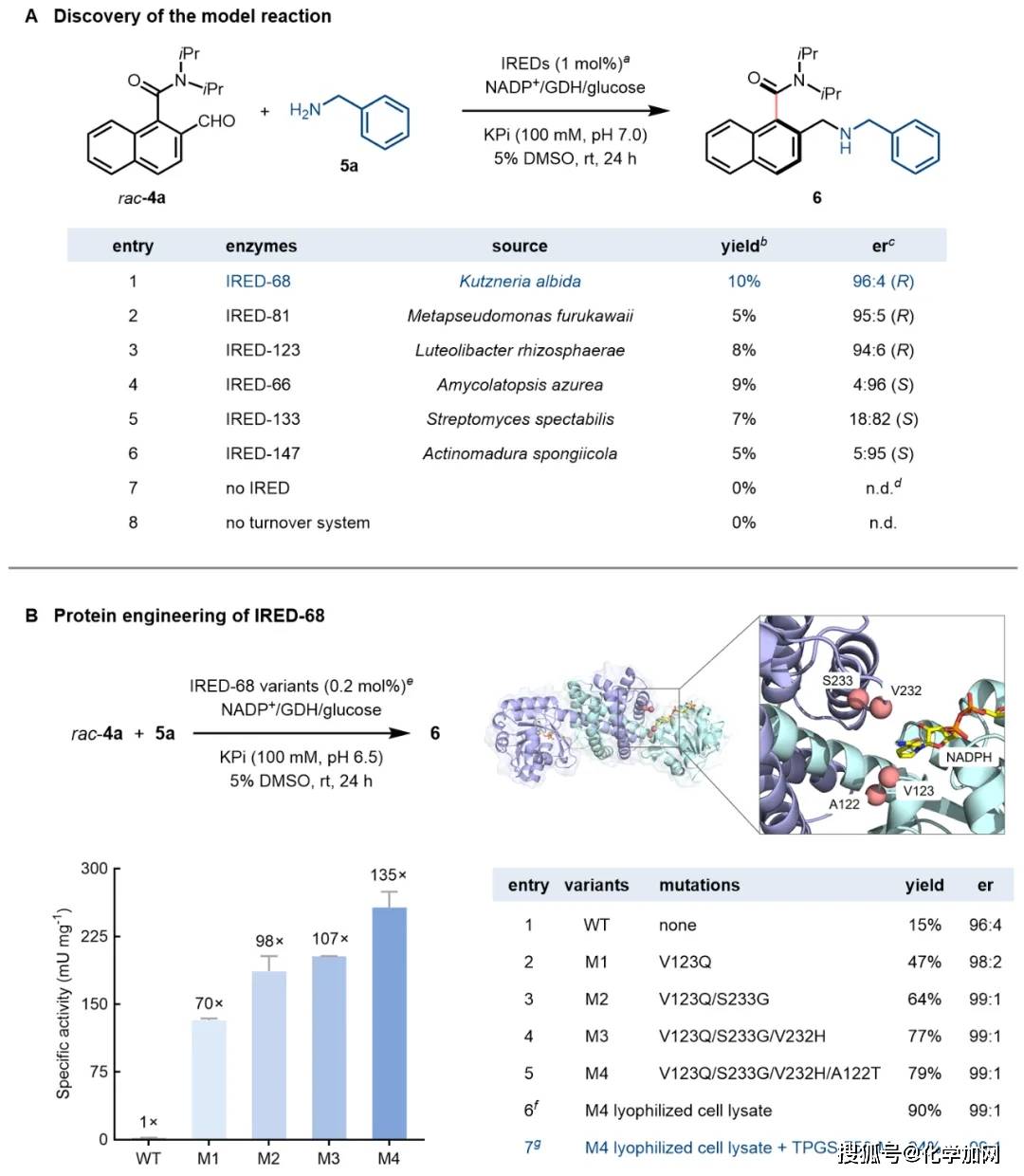
图2. 模板反应筛选与优化。图片来源:J. Am. Chem. Soc.
随后,作者对突变体IRED-68-M4的底物适用范围进行了系统评估(图3)。结果表明,该突变体具有良好的底物兼容性,可高效催化多种取代苄胺、杂环取代甲胺、苯乙胺及苯胺等胺类底物。除萘甲酰胺(6–36)结构外,该酶对苯甲酰胺衍生物(37–40)也表现出较高催化活性,多数底物可获得70%–98%的产率,并保持优异的对映选择性(最高er > 99:1)。此外,研究团队成功实现了化合物10的克级规模制备,以84%的产率获得1.28 g目标产物(98:2 er),进一步证明了该方法在合成应用中的潜力。
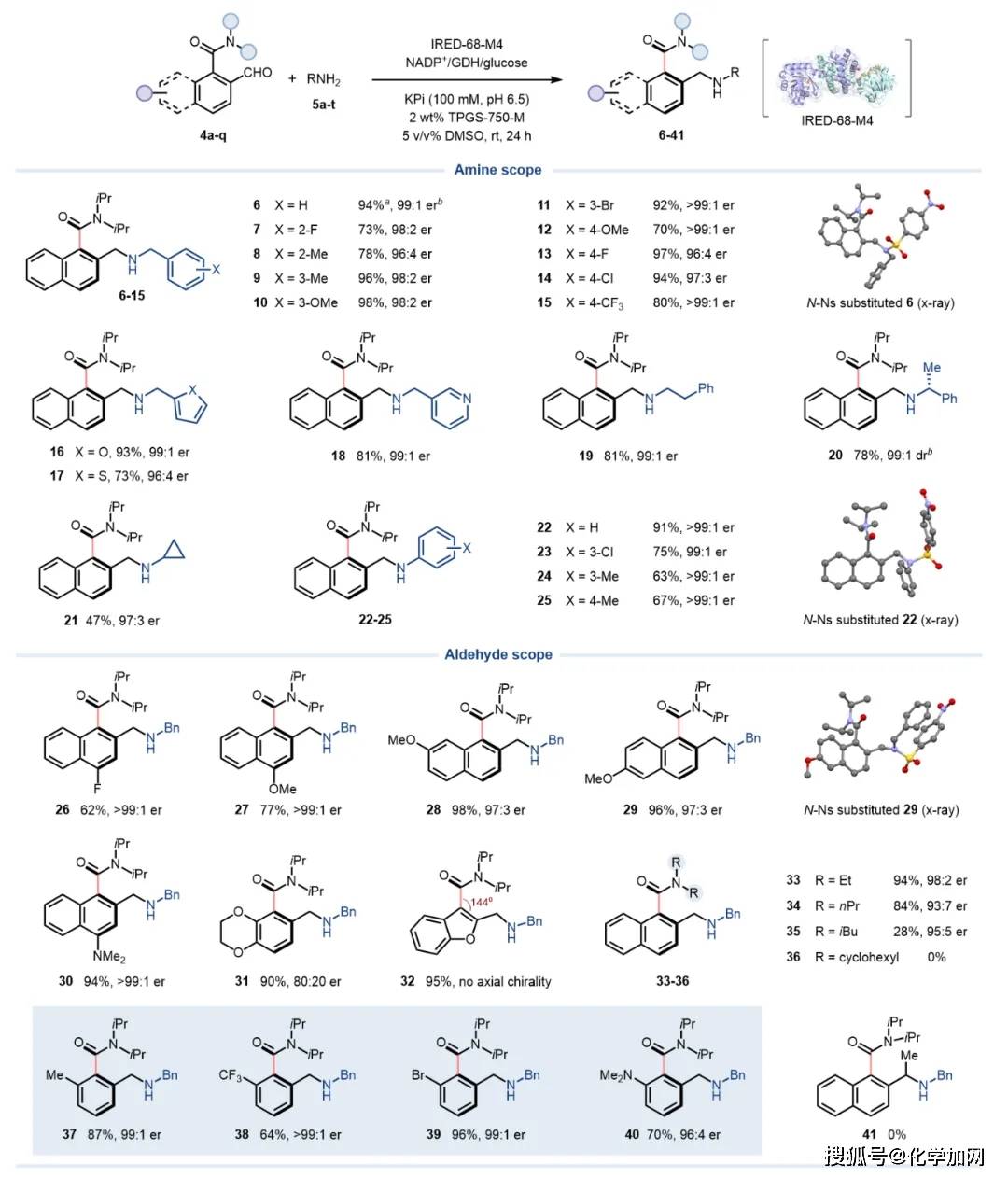
图3. 底物范围拓展。图片来源:J. Am. Chem. Soc.
最后,作者结合X射线晶体学与分子对接分析,揭示了IRED-68-M4突变体催化性能提升的机制。研究发现,突变位点V123Q可与还原型辅因子NADPH的烟酰胺环形成额外氢键,从而可能增强与辅因子的结合能力。ITC结合实验进一步证实,突变体IRED-68-M4对NADPH的结合能力显著高于野生型IRED-68-WT(KD = 4.1 μM vs. 27.4 μM)。分子对接结果表明,V232H位点可与亚胺底物42的苯环产生π–π相互作用,而S233G位点则扩大了活性中心空腔,有利于大体积底物的结合与进入。此外,通过单位点突变实验,作者鉴定出D170为潜在的质子给体(图4)。
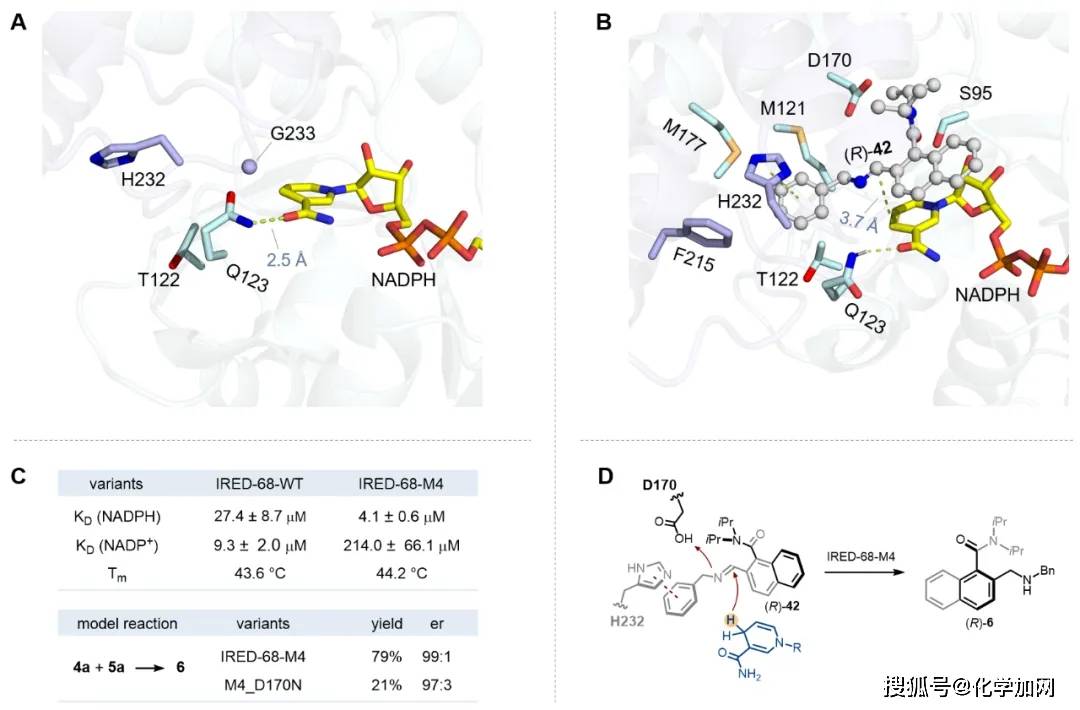
图4. 结构及机理解析。图片来源:J. Am. Chem. Soc.
总结
本研究基于动态动力学拆分策略,首次实现了轴手性芳基酰胺类分子的生物催化不对称合成。通过高效的蛋白质工程改造,成功获得了催化性能优异的IRED-68-M4突变体,该酶兼具高活性、高对映选择性及广泛的底物适用性,为构建非联芳基轴手性分子提供了新型酶催化工具。该研究成果发表于J. Am. Chem. Soc.,中国医学科学院/北京协和医学院医药生物技术研究所博士研究生姚周畅和孟润泽为本文共同第一作者;黄玲博士、宋丹青研究员、付海根研究员为共同通讯作者。研究过程中,杨兆勇课题组为本工作提供了重要支持。
原文链接
Zhouchang Yao, Runze Meng, Zitian Zhou, Luyao Yu, Zhiyun Wu, Longqing Tang, Tianzhang Qiao, Ke Li, Ling Huang,* Danqing Song,* Haigen Fu.*Engineering an Imine Reductase for Enantioselective Synthesis of Atropisomeric Amides. J. Am. Chem. Soc., 2025, https://pubs.acs.org/doi/10.1021/jacs.5c12724.
博后招聘、博士生招生信息
付海根,现任中国医学科学院/北京协和医学院医药生物技术研究所研究员,主要从事生物催化与药物化学研究。近年来以第一或通讯作者在Nature、Nature Catalysis、JACS、Angewandte Chemie等国际高水平期刊发表论文十余篇,并于2022年入选国家高层次青年人才计划。
课题组研究方向聚焦于生物催化及药物化学,经费充足,实验条件完善。现诚聘博士后1–2名,欢迎具有有机化学、生物催化、生物合成或药物化学等相关背景的优秀青年学者加入。课题组将全力支持入选者申请“协和青年学者”等人才项目。同时,欢迎对生物催化、药物设计等方向有浓厚兴趣的同学报考2026年入学博士研究生(拟招收1–2名)。期待有志于前沿科学探索的青年人才加入我们,共同成长。请发送相关材料到付老师邮箱fuhaigen@imb.pumc.edu.cn。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn