

P-手性有机膦氧化合物,含有一个或两个C-P键,是一类具有重要价值的结构,在药物化学和有机合成中具有广泛应用。这些手性P(V)化合物广泛存在于许多天然产物、药物和生物活性分子中。在含有一个C-P键的化合物中,替诺福韦艾拉酚胺是治疗慢性乙型肝炎的一线药物;含有两个C-P键的化合物也可由其单C-P键对应物衍生而来,展现出多样化的生物活性。例如,Phostine表现出有效的抗增殖特性(图1)。
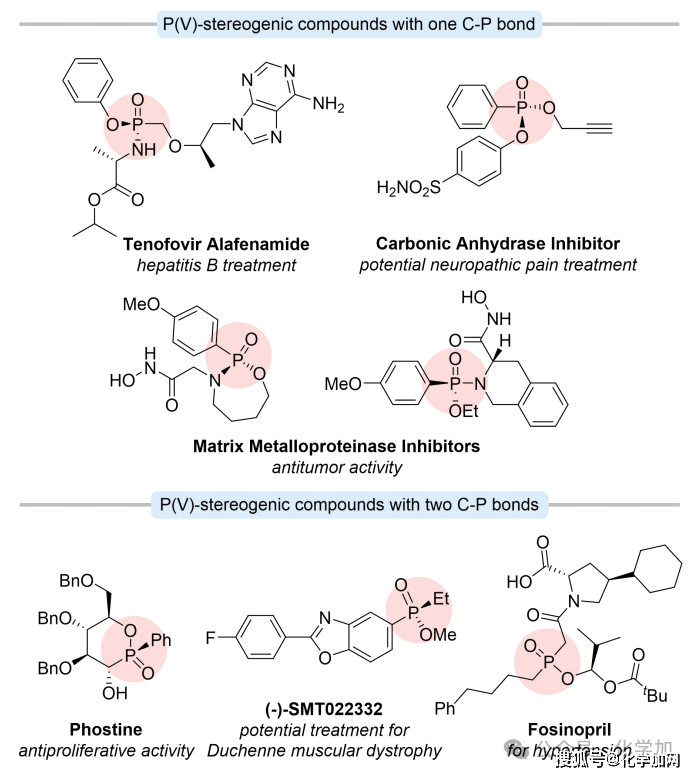
图1 含有C-P键的膦氧化物的重要性
由于其立体构型对活性具有重要影响,因此发展高效、高选择性合成P-手性中心的方法成为该领域的关键挑战。传统合成路径主要依赖外消旋体拆分与手性辅助基诱导策略,前者受限于50%的理论产率上限,后者则需引入并后续移除手性导向基团,步骤繁琐且原子经济性低。相比之下,不对称催化能够直接构筑P-手性中心,具有步骤简洁的优势,是当前该领域的研究重点。近年来,催化不对称去对称化策略在构建含C-P键的P(V)手性分子方面取得重要进展(图2A),Jacobsen团队(Science2022, 376, 1230−1236)、Dixon、Yamazaki(Nat. Chem.2023, 15, 714−721; Angew. Chem. Int. Ed. 2024, 63, e202400673)和Chi(Chem 2025, 11, 102586)等课题组先后开发了基于氢键给体、超强碱双功能氨基磷烷及N‑杂环卡宾等催化体系,为P‑手性化合物的合成开辟了新途径。这些工作与李光勋(J. Am. Chem. Soc. 2025, 147, 11010−11018)、何智涛(J. Am. Chem. Soc. 2025, 147, 13566−13576)、Dong (J. Am. Chem. Soc. 2025, 147, 21339−21346)及商明 (Angew. Chem. Int. Ed. 2025, 64, e202509807)等课题组的全杂原子取代的磷(V)手性中心的研究共同推动了该领域发展。另一方面,催化不对称磷酰化也是构建P-手性中心的重要策略(图2B)。然而,现有含C-P键手性膦氧化合物的不对称合成方法,在催化剂可获得性、反应普适性与对映选择性方面仍存在不足,亟需发展更为高效、通用且催化剂易于制备的新型催化体系。自2010年始,上海交通大学张万斌课题组基于“键角调控”策略开发了一系列具有双环咪唑结构的有机小分子催化剂。利用该类催化剂,他们报道了首例构建磷(V)手性的不对称磷酰化反应,并成功地实现了磷(V)手性抗新冠药物瑞德西韦的高效不对称合成(J. Am. Chem. Soc. 2010, 132, 15939-15941; Tetrahedron: Asymmetry 2012, 23, 329−332; Chem. Commun.2017, 53, 1381-1384; Angew. Chem. Int. Ed. 2020, 59, 20814-20819; Angew. Chem. Int. Ed. 2021, 60, 1641-1645; CCS Chem. 2023, 5, 361-371; ACS Catal. 2023, 13, 16300-16306)。基于此,最近该团队报道了一种手性双环咪唑双功能手性催化剂,能经由膦酰二氯去对称化及后续的立体专一性SN2亲核取代过程,从而一锅法地实现多种结构的手性膦氧化合物的合成(图2C)。该方法可以高效制备系列含有P-O/P-S/P-N键结构的P(V)-手性分子,且收率与对映选择性表现优异。此外,所得产物还可以进一步被醇解,生成的手性膦酸酯又可以多样化精准衍生,构筑新的P-S/P-C/P-C(Ar)键,为合成具有生物活性的高价值手性膦氧化合物提供了通用平台。
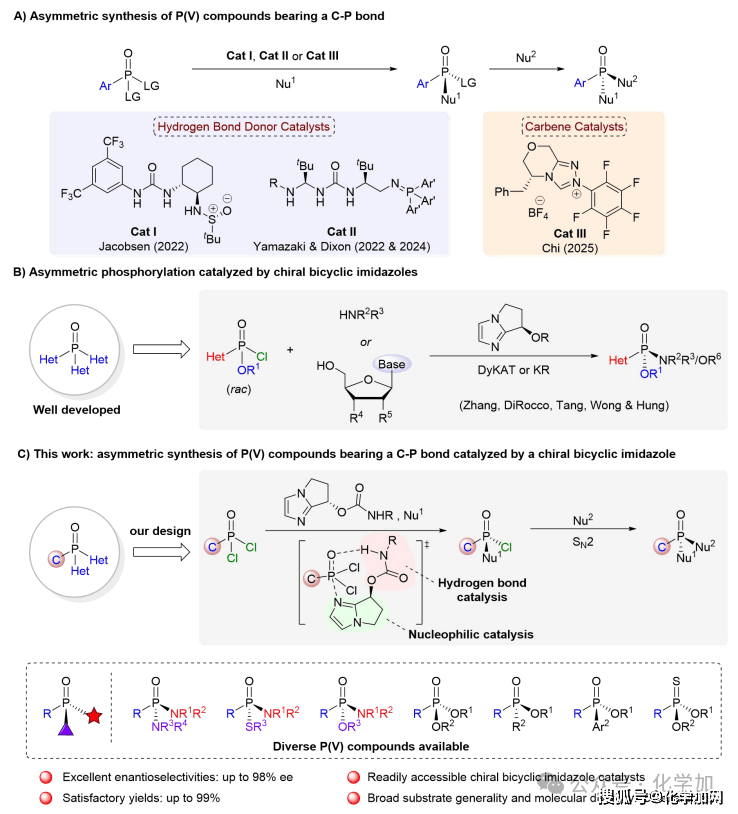
图2A通过去对称化策略构建含C–P键的P(V)立体中心.2B双环咪唑催化不对称磷酰化反应.2C本工作:双环咪唑催化一锅构建手性剂对手性磷(V)立体中心
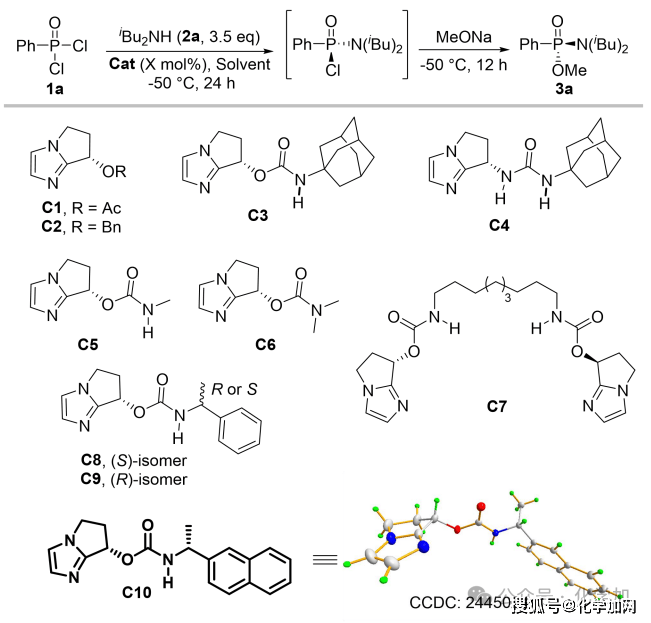
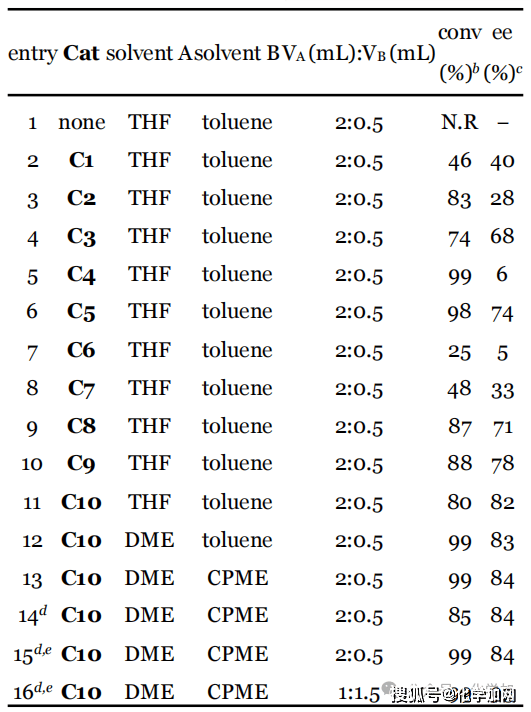
图 3 部分条件优化
作者首先以市售的苯基膦酰二氯为模板底物,二异丁胺作亲核试剂与缚酸剂,并以四氢呋喃和甲苯分别作反应溶剂与底物溶剂,在-50 °C的低温条件下对催化剂进行了筛选和优化。实验结果表明,不添加催化剂时,反应无法进行。C1和C2催化剂在不对称C-酰化反应中展露出较好的效果,但在此条件下,该催化剂的立体控制效果有限(entry 2-3)。基于C3在瑞德西韦的不对称合成中的优异表现,研究团队尝试其催化该反应,获得74%转化率和68% ee(entry 4)。进一步结构修饰发现:将C3的氨基甲酸酯结构片段换为脲基(C4)可提高反应活性但损害对映选择性(entry 5);N–H键对高催化性能至关重要(C5/C6,entry 6-7)。随后筛选多种NH-取代催化剂,确定了最优催化剂C10表现出最高立体选择性(82% ee,entry 11)。随后进行溶剂以及反应时间等条件的优化,最终确定以1 mL DME为反应溶剂,1.5 mL CPME溶解底物,催化剂负载降至15 mol%,第一步反应36小时,随后使用甲醇钠淬灭可在高转化率下保持高对映选择性(entry 16)。
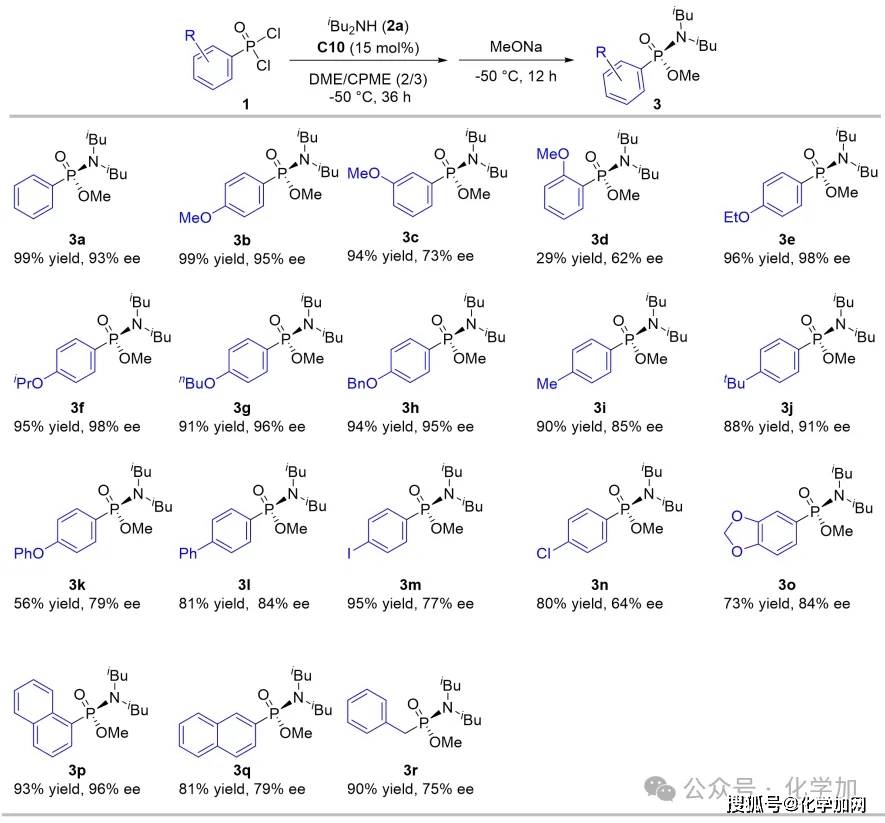
图4 底物膦酰二氯筛选
此后,作者系统考察了该催化体系对各类膦酰二氯底物的兼容性。研究发现苯环为对位带烷氧基的底物普遍能以高收率和高对映选择性获得目标产物(3b, 3e-3h);间位甲氧基取代底物延长反应时间至48小时后,产率为94%但选择性降低至73%(3c);而邻位取代底物则因空间位阻大、溶解性差,导致反应性明显下降(3d)。然而,当引入吸电子基团,反应的对映选择性会出现显著降低,延长第一步的反应时间至48小时,可以提高反应产率。该反应对二取代苯环底物(3o-3q)同样适用,并能兼容烷基膦酰二氯,例如苄基底物能以90%的产率和75%的ee值得到产物(3r)。这些结果一致表明,芳环上对位给电子取代基有助于提升磷中心的电子云密度,从而稳定催化中间体,实现更好的催化效果。作者还分离纯化了产物(3b)的前体化合物氯代膦酰胺,该化合物的对映选择性为96%。
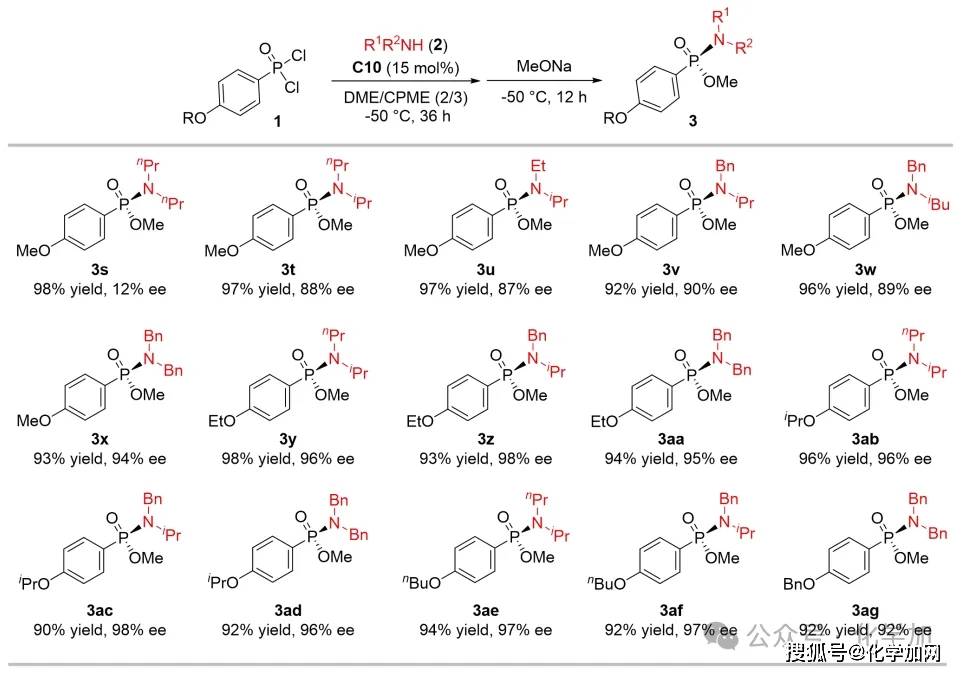
图5 二级胺筛选
作者选用对甲氧基苯基膦酰二氯作为模型底物(1b),系统考察了不同结构二级胺的反应性能。鉴于二级胺在该转化中兼具亲核试剂和缚酸剂的双重功能,研究人员特别关注了胺类试剂的亲核性与碱性的平衡关系。实验结果表明,筛选获得的优势二级胺与苯环对位为其它烷氧基取代的苯基膦酰二氯底物反应,催化产物仍能保持优良的收率与出色的对映选择性控制。
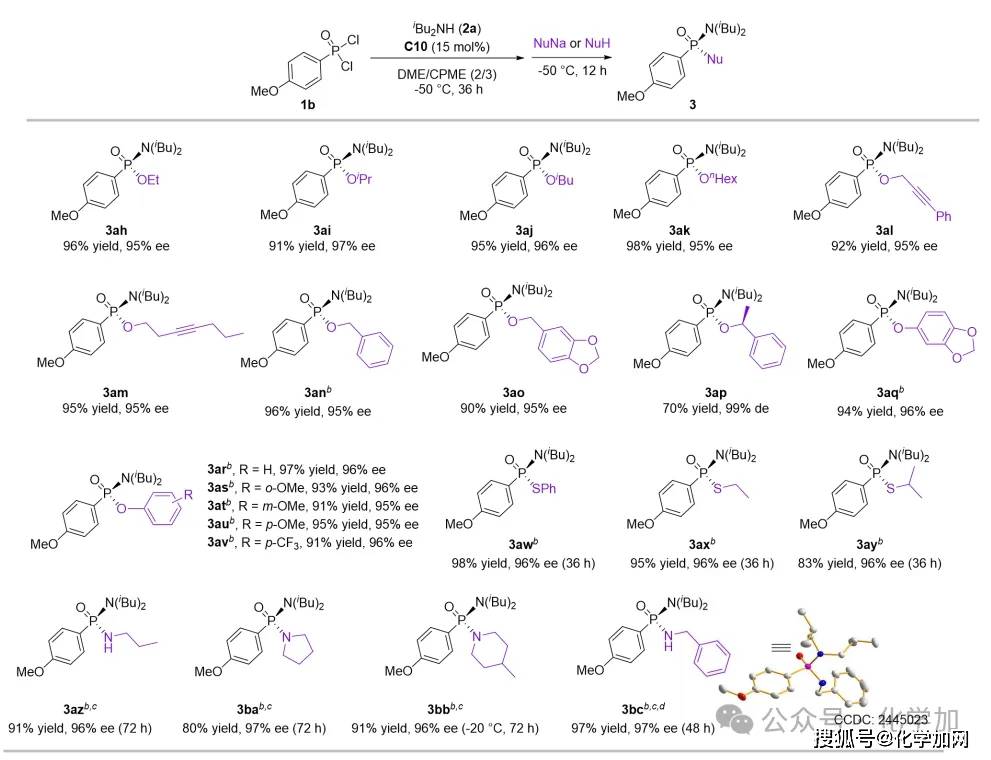
图6 立体专一性SN2反应亲核试剂拓展
接下来,作者以甲氧基苯基膦酰二氯作为底物(1b),二异丁胺为优势二级胺,所得的手性氯代膦酰胺酯中间体通过“一锅法”策略与多种亲核试剂反应,从而高效地构建P-O/P-S/P-N键,实现了手性膦酰胺酯、膦酸酯、硫代膦酸酯以及膦酰二胺等有价值的化合物的合成。值得注意的是,当引入某些亲核试剂(如部分醇钠、酚钠、硫醇钠及胺类)时,目标产物的对映选择性会出现显著下降。作者将此归因于:在第二步反应中,这些亲核试剂进攻手性氯代膦酰胺酯,形成了一个五配位P(V)中间体。该中间体可经由Berry假旋转途径发生消旋化,从而造成了立体选择性的损失。因此作者引入了添加剂碳酸银,通过沉淀Cl-缩短五配位中间体的寿命。这使得反应能够在其发生Berry假旋转之前,优先沿立体专一的SN2路径进行,从而维持了高对映选择性。
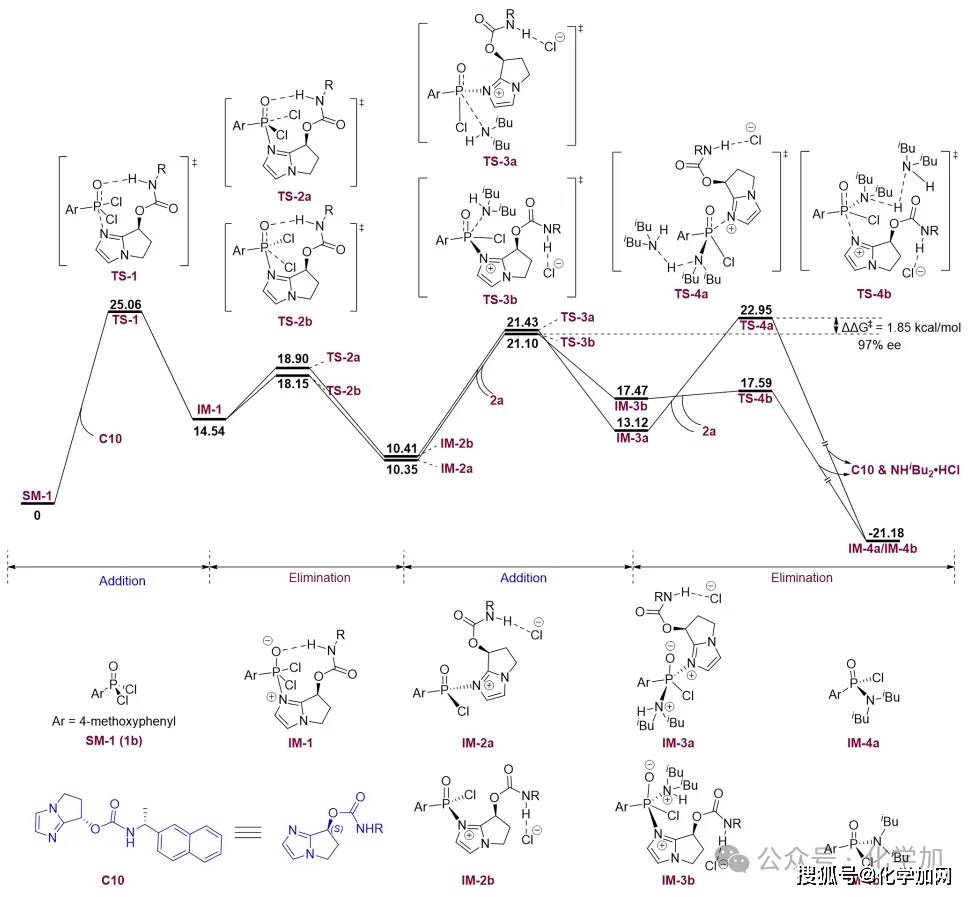
图7 DFT计算
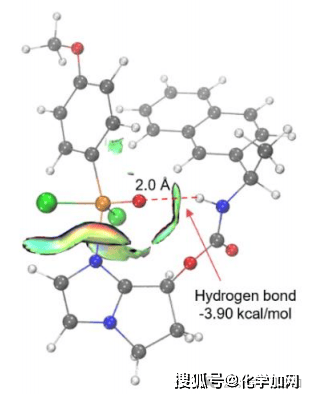
图8 IGMH analysis between catalyst and substrate in TS-1.图中原子颜色标示如下:碳原子为黑色,氢原子为白色,氮原子为蓝色,氯原子为绿色,氧原子为红色,磷原子为橙色。
研究团队借助密度泛函理论(DFT)计算的手段,对反应进行了较为深入的研究(图7)。根据能量分布图,对映选择性源于过渡态TS-3b和TS-4a之间的能量差,其值为 1.85 kcal/mol,计算出在-50 °C时的对映选择性值为97%,与实验数据(96% ee)基本吻合。此外,对TS-1的IGMH(图8)分析表明,在P(V)物种的氧原子与催化剂的酰胺NH基团之间存在一个较强的氢键。该氢键通过有效稳定氧原子上的负电荷,对于增强P(V)中心的亲电性起到了关键作用。
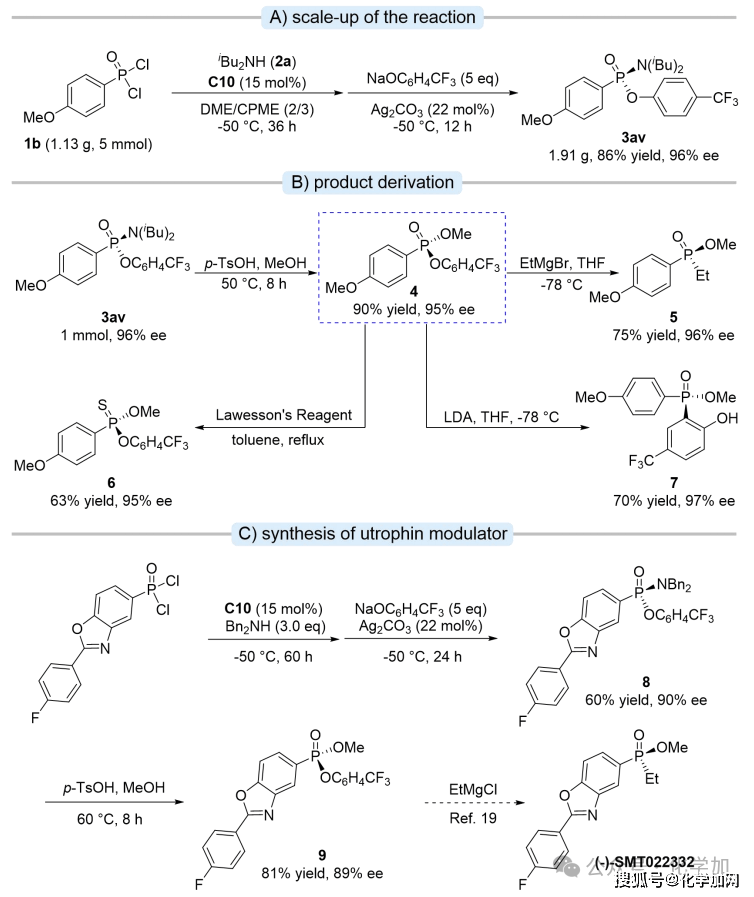
图9 克级放大及产物衍生多样性研究
接着,作者对该反应进行了克级规模放大,反应同样能够以高收率和优异的对映选择性获得手性产物(3av)(图9A)。值得注意的是,化合物3av可通过对甲苯磺酸催化的醇解反应,将P-N键转化为P-O键,高产率地得到手性膦酸酯,其对映选择性在整个转化过程中基本保持稳定。该手性膦酸酯化合物4又可以分别被格氏试剂、劳森试剂以及锂化试剂进攻,生成P-C/P-S/P-C(Ar)化学键(图9B)。为了进一步证明该方法的实用性,作者完成了对杜兴氏肌营养不良症候选药物(-)-SMT022332的关键前体不对称合成(图9C)。以前手性膦酰二氯为原料,经由该催化体系去对称化后,再进行醇解,便可获得关键前体化合物9(81% yield, 89% ee)。
总结
综上所述,上海交通大学张万斌团队使用课题组基于“键角调控”策略自主开发的手性双环咪唑催化剂,将前手性膦酰二氯的去对称化与立体专一的SN2亲核取代反应相结合,一锅法成功地构建了含C–P键的P(V)手性中心。该策略展现出优异的底物普适性与官能团兼容性,能以高产率和高对映选择性合成至少55种结构多样的手性膦氧化合物。机理研究证实,催化剂路易斯碱的亲核作用以及关键的N–H…O=P氢键作用的协同催化机制,是实现高对映选择性的核心。该方法的实用性在克级合成与药物分子(-)-SMT022332关键前体的制备中得到成功验证,为手性膦氧化合物的合成提供了一个强大平台。上述研究成果近期发表在J. Am. Chem. Soc.上,上海交通大学药学院博士生张露为论文的第一作者,化学化工学院张万斌教授和药学院张振锋研究员为论文的通讯作者。
文献详情:
Asymmetric Synthesis of Diverse P(V) Compounds Bearing a C–P Bond via Desymmetrization of Phosphonic Dichlorides Catalyzed by a Chiral Bicyclic Imidazole
Lu Zhang, Mo Wang, Yicong Luo, Zhenfeng Zhang*, Delong Liu, Wanbin Zhang*
J. Am. Chem. Soc. 2025
https://doi.org/10.1021/jacs.5c17437
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn