

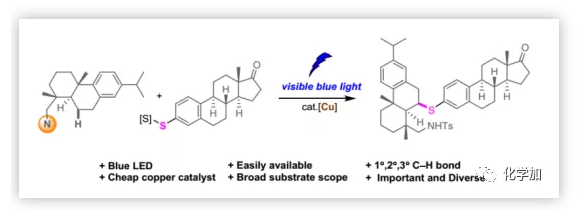
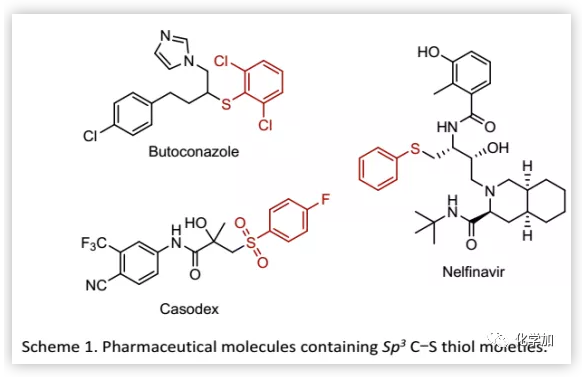
Sp3 C-S键在现代有机合成、天然产物和药物中发挥着重要作用。例如,抗真菌药Butoconazole和抗逆转录病毒药物Nelfinavir(Scheme 1)。临床实验表明, Sp3 C-S键的引入可以改善药物分子的生物学活性。除此之外,Sp3 C-S键还存在于半胱氨酸等天然氨基酸中。考虑到含Sp3 C-S键化合物的重要性,迫切需要开发能够通过C-H键的直接官能团化高效选择性地构建Sp3 C-S键的方法。此外,这些方法还可以促进复杂分子的后期官能团化,有利于分子多样化和化合物库构建。
(图片来源:Chem. Sci.)
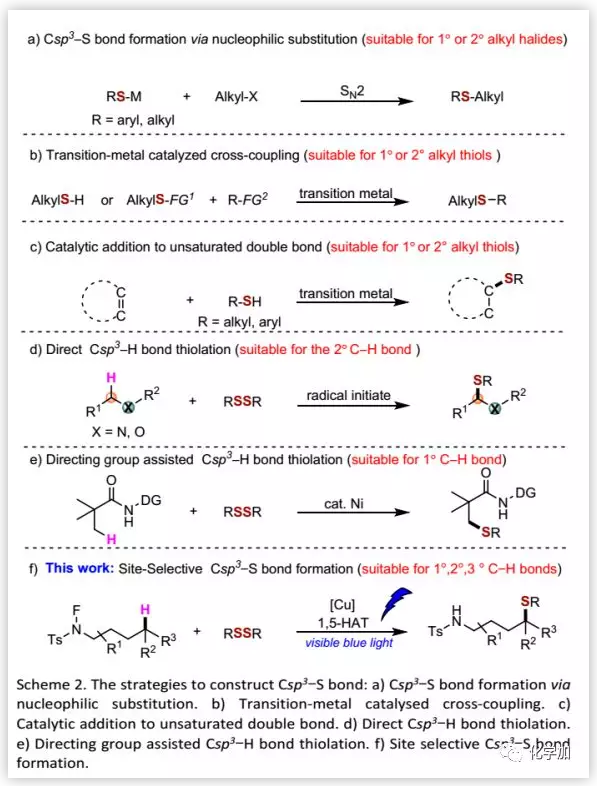
传统的构建Sp3 C-S键的方法是通过金属硫醇盐与烷基卤化物间的亲核取代来实现的(Scheme 2a),但其对空间位阻敏感。随着过渡金属催化剂的发展,过渡金属催化的有机卤化物/烯烃和硫醇/硫醚的交叉偶联可以更有效地引入Sp3 C-S键(Scheme 2b)。同时,烯烃的氢硫醇化提供了一种构建Csp3-S键的方法,但该方法需要将底物预官能团化,并且其区域选择性主要取决于底物的结构(Scheme 2c)。此外,杂原子邻位Sp3 C-H 键(Scheme 2d)以及导向基辅助(Scheme 2e)的Sp3 C-H 键的直接硫醇化反应提供了一种构建Csp3-S键的方法。Sp3 C-H键的直接硫醇化仍然充满着挑战。
受Hofmann-Löffler-Freytag(HLF)反应的启发,通过自由基途径的C-H官能团化为构建目标分子提供了新途径。尽管基于该路径来实现碳氢键官能团的反应已经取得了丰硕的成果,但对于碳硫键及碳硒键的转化尚未报道。基于碳硫键在药物分子及天然产物中的重要性,陕西师范大学杨明瑜课题组在前期1,5-HAT的分子內胺化反应(Chem.Commun., 2017, 53, 5744)及分子间氧化反应(Chem. Sci., 2018, 9, 6374)研究的基础上,开发了一种通过光驱动/铜催化的1,5-HAT策略的脂肪胺类化合物的选择性硫醇化(Scheme 2f),该成果发表于近期Chem. Sci.(DOI: 10.1039/C9SC04169A)。
(图片来源:Chem. Sci.)
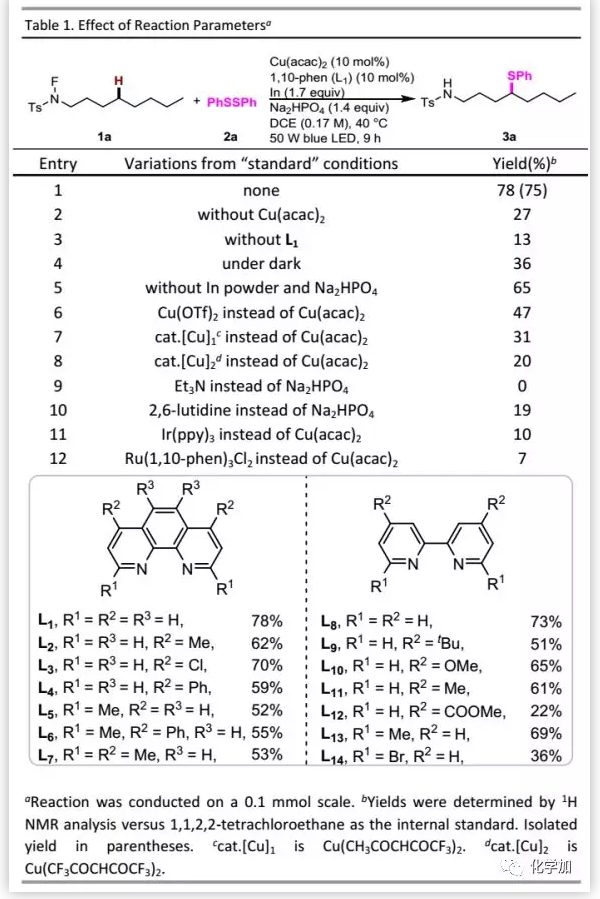
首先,作者以N-氟甲苯磺酰胺1a和二苯二硫醚2a作为模型底物进行研究(Table 1)。经过条件优化后,发现在蓝色LED存在下,以10 mol% Cu(acac)2、10 mol% 1,10-phenanthroline(L1)、1.4 eq. Na2HPO4和1.7 eq.铟粉的混合物作为添加剂时可以75%的分离收率得到预期的δ-硫醇化产物3a。对照实验表明:在没有铜催化剂或配体存在下,收率显著下降;在无光照情况下仅以36%的收率得到预期产物,表明光在该转化中起关键作用;在没有铟粉和碱存在下,收率较低。此外,利用其他铜络合物,均导致收率降低。在光氧化还原反应中,脂肪胺通常是良好的还原剂,但加入三乙胺会抑制该反应。为了确定铜络合物在该转化中的作用,作者分别用Ir和Ru代替Cu,但结果均不理想,表明铜在该反应中不仅是光氧化还原催化剂,还有其他作用。
(图片来源:Chem. Sci.)
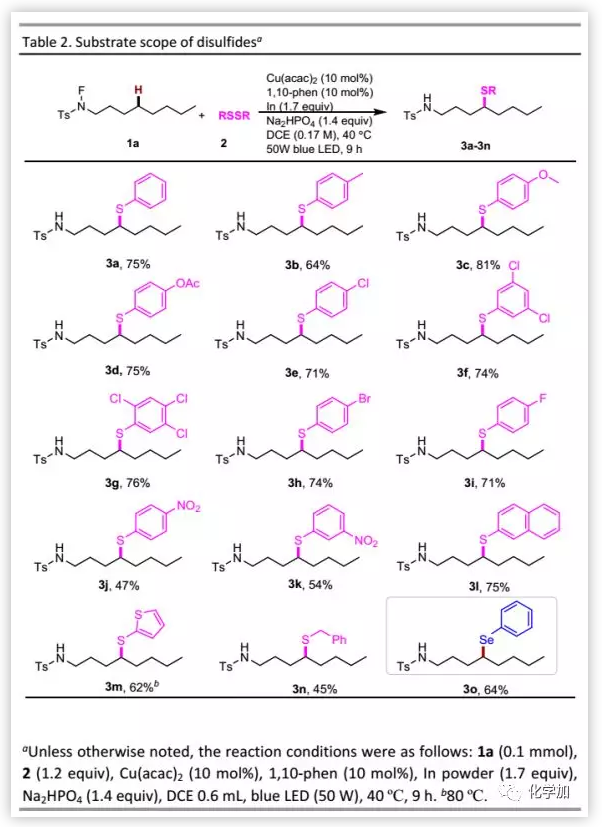
确定最佳反应条件后,作者考察了二硫化物的适用范围(Table 2)。含有给电子基团如甲基、甲氧基和乙酰氧基的二硫化物均具有良好的耐受性;含有卤素甚至多卤或氟取代的芳基二硫化物也可以参与硫醇化反应;然而,含硝基的二硫化物导致反应性降低。苯硫基在光电材料中通常具有特殊的性质,能以可接受的收率得到预期产物。此外,二硫化苄可以较低的收率(45%)得到δ-苄硫醚。当用二硒化物代替二硫化物时,也可以实现δ-硒化。
(图片来源:Chem. Sci.)
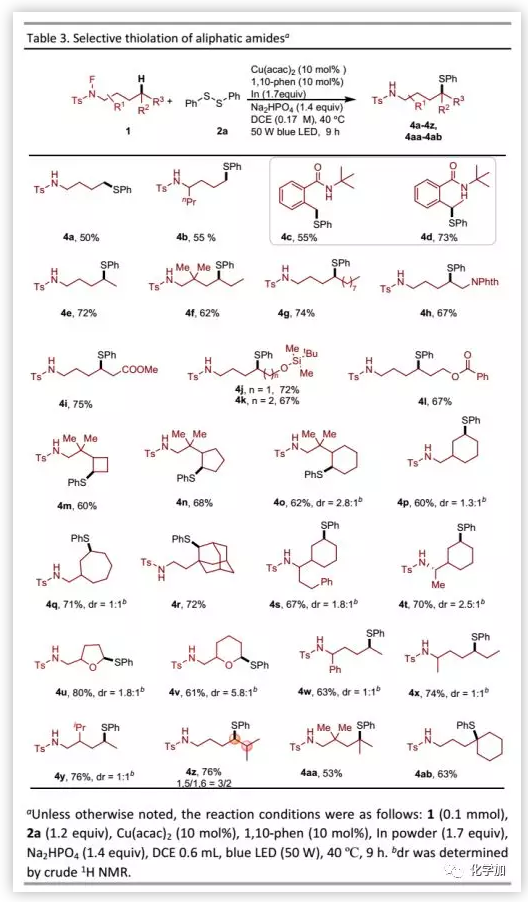
作者开发的C-H硫醇化方法也可以用于各种电性和空间因素的伯、仲和叔脂肪族C-H键的官能团化(Table 3)。对于α-位含有取代基的N-氟甲苯磺酰胺底物,伯C-H键的硫醇化收率略有提高。此外,N-氟甲酰胺也是该转化的良好底物。仲C-H键的官能团化可以选择性得到一系列硫醚衍生物。即使底物中含有较长碳链,该反应也仅发生在δ-位。然而,在线性N-氟酰胺底物β-位的gem-二烷基未能提高收率。与生物学相关的官能团如Nphth、羧酸酯和OTBDMS以及OBz等均具有良好的耐受性。对于在反应中心附近含杂原子的4h和4j,只观察到δ-选择性。四元-七元的环烷烃可以良好的收率进行硫醇化。相比于叔丁基,金刚烷基可以在仲C-H键选择性官能团化。在杂环中,六元环α-位官能化得到产物的非对映选择性优于五元环。然而,N-氟酰胺的α-或β-位取代基的空间位阻导致较差的非对映选择性。1,5-HAT和1,6-HAT过程均发生在底物ε-位的叔C-H键。最后,该转化还可以用于构建含巯基的季碳中心,从而突出其合成实用价值。
(图片来源:Chem. Sci.)
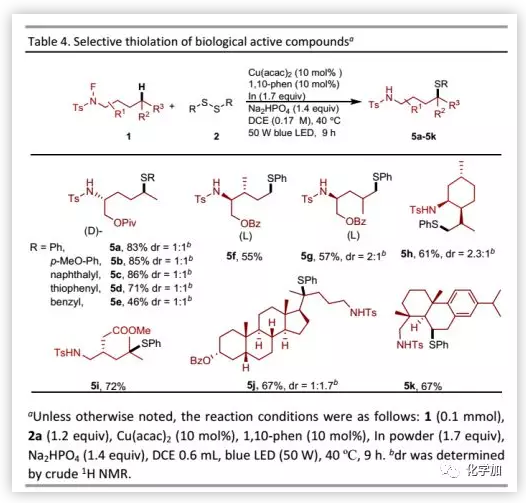
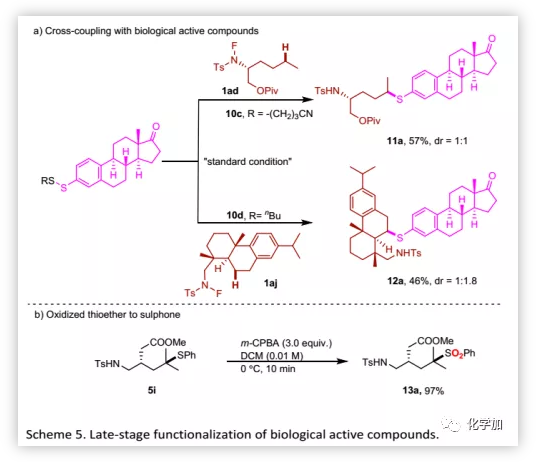
接下来,作者将该方法用于生物活性分子的后期官能团化(Table 4)。氨基醇衍生物可以与多种二硫化物偶联,其产物一般是活性化合物的重要中间体,证明了该方法的广泛实用性。甲基的不对称硫醇化发生在薄荷醇衍生的N-氟酰胺底物上。此外,药物分子和复杂天然产物均可以优异的区域选择性进行结构修饰。
(图片来源:Chem. Sci.)
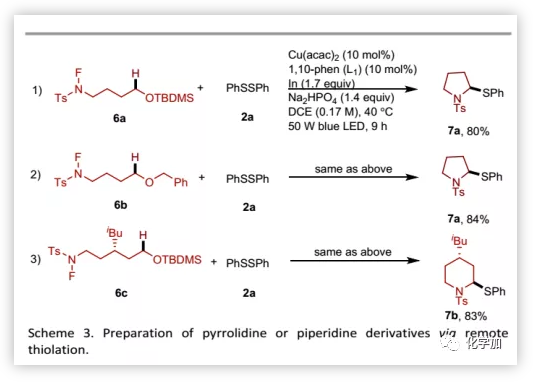
随后,为了说明该反应对构建药物骨架的实用性,作者考察了一种可以通过1,5-HAT、环化和硫醇化组成的串联反应合成巯基取代的吡咯烷或哌啶衍生物的底物(Scheme 3)。
(图片来源:Chem. Sci.)
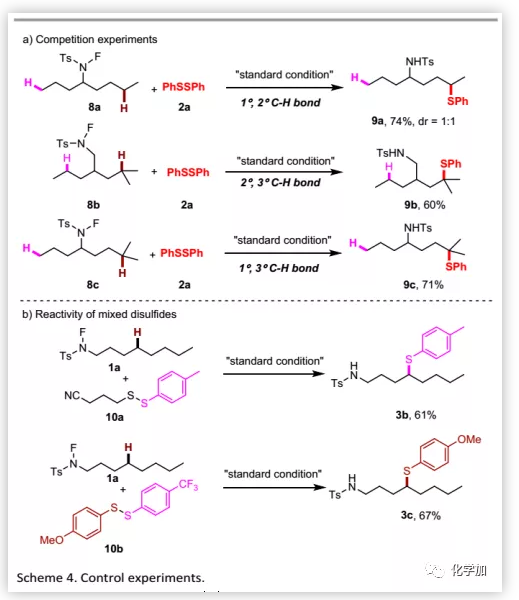
为了深入了解反应机理,作者分别进行了1°/2°C-H键、2°/3°C-H键和1°/ 3°C-H键之间的竞争性实验(Scheme 4a),发现氢原子的反应性顺序为叔>仲>伯。此外,为了测试硫醇化试剂的选择性,作者用混合的二硫化物进行该转化(Scheme 4b):对于烷基苯基二硫化物,只得到苯硫醚产物;对于既含给电子基OMe又含吸电子基CF3的芳基二硫化物,硫醇化只发生在含给电子基OMe取代的硫醇上,这可能是由不同硫上的电子云密度所导致。基于这种选择性,作者开发了两个生物活性分子之间的直接交叉偶联得到相应的共轭化合物(Scheme 5a)。随后,硫醚可以直接被氧化为广泛存在于药物中的砜(Scheme 5b)。
(图片来源:Chem. Sci.)
(图片来源:Chem. Sci.)
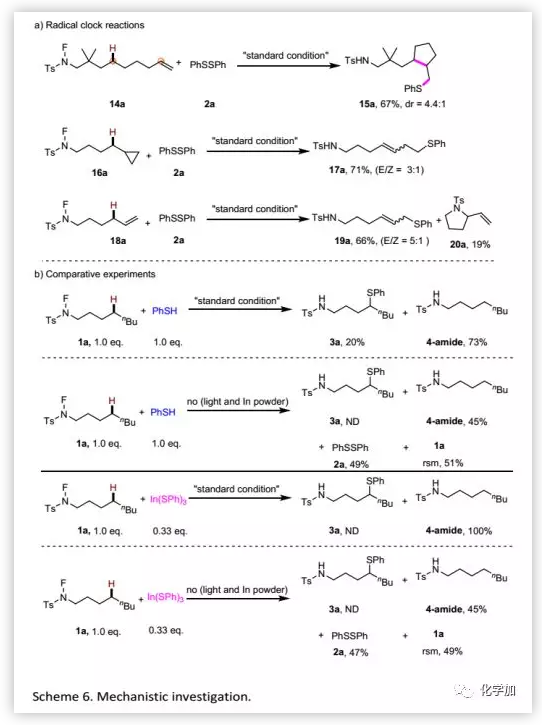
此外,作者还进行了自由基对照实验以揭示存在自由基中间体的证据(Scheme 6a)。Radical-clock实验观察到产物15a、17a和19a表明在转化过程中形成了碳自由基。特别是对于19a,观察到的线性选择性显示该过程可能涉及η1-或η3-金属烯丙基中间体。随后,在TEMPO和BHT存在下进行的实验结果进一步证明了自由基过程。此外,作者分别用PhSH和In(SPh)3进行实验以考察硫醇化反应涉及的可能活性物质。结果表明,用PhSH作为硫醇化试剂时,以20%的收率得到预期产物;而用In(SPh)3作为硫醇化试剂时,未得到预期产物(Scheme 6b)。最后,通过空白实验确认了各种添加剂在反应中的作用。
(图片来源:Chem. Sci.)
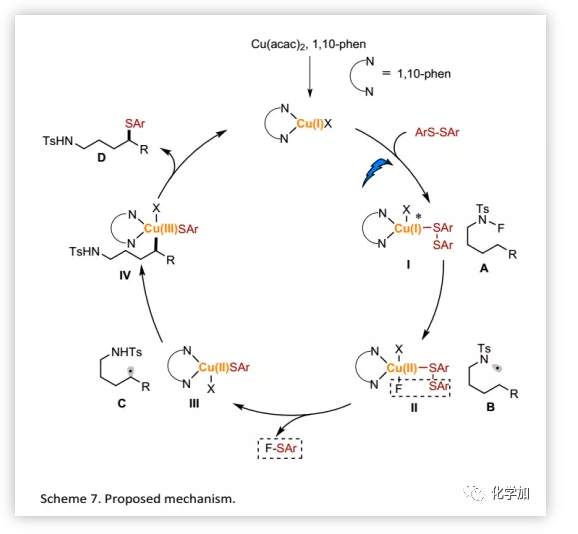
基于上述结果,作者认为该转化倾向于光驱动/铜引发的1,5-HAT过程(Scheme 7)。首先,原位生成的Cu(I)催化剂与二硫化物发生配体交换生成Cu(I)-I,被可见光激发后,还原N-F酰胺A得到氮自由基B和Cu(II)-II中间体。Cu(II)-II通过复分解过程释放一个分子F-SAr得到Cu(II)-III。生成的氮自由基B通过1,5-HAT移位形成碳自由基C,然后δ-C-自由基被Cu(II)-III捕获形成Cu(III)-IV中间体。最后,还原消除,得到预期产物D并再生活性Cu(I)催化剂。
(图片来源:Chem. Sci.)
总结:陕西师范大学杨明瑜副教授课题组开发了一种光驱动/铜催化的脂肪胺Csp3-H键的区域选择性硫醇化反应,可以将伯、仲和叔C-H键成功转化为C-S键。该方法具有广泛的底物适用范围、良好的官能团相容性以及生物活性中间体的后期修饰能力,突出了其独特的合成潜力。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn