

芳香化合物的直接C(sp2)-H官能团化已经成为合成药物、天然产物、农药、精细化学品以及功能材料等功能分子最高效的策略之一,其中芳香化合物立体选择性的C(sp2)-H官能团化反应的开发还十分有限,主要有两种策略。一种是芳香化合物的亲电取代反应(Friedel-Crafts反应),可以实现芳烃的邻位或者对位的不对称碳氢键官能团化反应,但该策略的底物范围仅限于苯酚、苯胺衍生物等具有强给电子基的芳烃(图1a)。另一种是导向基辅助策略,可以实现苯环邻位或间位对映选择性C(sp2)-H官能团化,但导向基很难触及芳烃对位的C(sp2)-H键(图1b)。由此可见,非活化芳烃高对映选择性的对位C(sp2)-H键官能团化仍然是一个巨大的挑战。
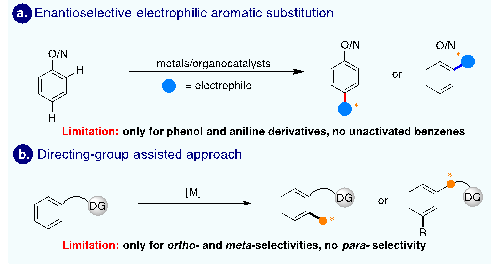
图1. 芳烃对映选择性的C(sp2)-H键官能团化反应
华东师范大学刘路教授课题组一直从事芳环的选择性C(sp2)-H键官能团化新方法的开发(图2),在前期和张俊良教授合作,已经先后开发了苯酚、萘酚、甲苯等的高化学选择性和位点选择性碳氢键官能团化反应(J. Am. Chem. Soc. 2014, 136, 6904; Angew. Chem. Int. Ed. 2016, 55, 14807; Chem. Sci., 2016, 7, 1988; Angew. Chem. Int. Ed. 2017, 56, 2749; Chem. Soc. Rev. 2016, 45, 506; Asian J. Org. Chem. 2018, 7, 2015; Chem. Commun, 2017, 53, 10164; Chem. Sci., 2019, 10, 6553; Chem. Commun., 2020, 56, 9485; Adv. Synth. Catal. 2021, 363, 2740; Org. Chem. Front. 2021, 8, 3770; Org. Biomol. Chem., 2021, 19, 5777)以及串联的环化及去芳构化反应(Chem. Commun. 2016, 52, 2257; Chem. Commun., 2016, 52, 9351; Org. Lett. 2018, 20, 6444; Chem. Commun., 2020, 56, 8202)。
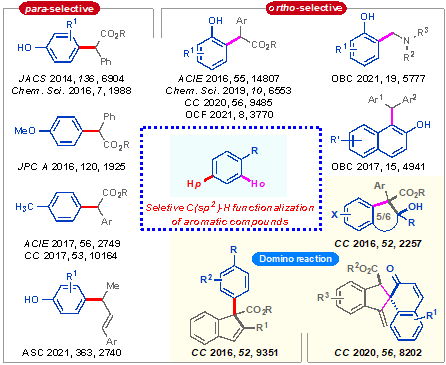
图2. 芳香化合物的选择性C(sp2)-H官能团化反应
在前期工作的基础上,作者对金催化C(sp2)-H键官能团化反应的机理进行分析,认为手性中心形成的关键步骤是由烯醇中间体A转化为中间体酯B,同时这一步也是该反应的决速步骤,如果使用手性质子梭进行不对称质子转移可以实现该反应的不对称催化。朱守非教授和周其林院士等发现了手性磷酸是一种非常有效的手性质子梭,支志明院士、龚流柱教授、张俊良教授、刘瑞雄教授、徐新芳教授、孙江涛教授等发现金和磷酸两种催化剂能兼容并有效实现不对称催化。在此基础上,近日刘路教授课题组通过使用金/手性磷酸共催化的策略实现了非活化芳烃的高对位选择性和对映选择性的C(sp2)-H官能团化反应(图3)。
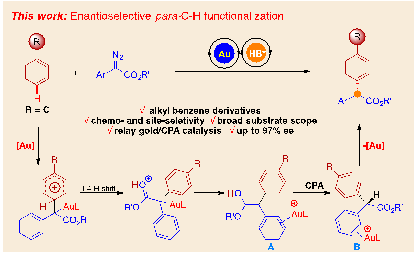
图3. 非活化芳烃高对位选择性的不对称C(sp2)-H官能团化反应
经过反应条件优化,在最优条件下作者对底物范围进行了考察(图4)。在重氮的邻、间、对位取代均不影响反应结果,并且对常见的各种取代基均兼容,包括卤素、氰基、硝基等以及稠环结构均能取得优异的对映选择性。随后对不同的烷基苯进行了考察,对于各种单烷基取代苯、多烷基取代苯均表现出出色的对映选择性,特别是在苄位没有监测到C(sp3)-H键插入产物。一个有趣的例子是利用共催化体系,可以获得甲苯和乙苯的一对对映异构体(3aw)。
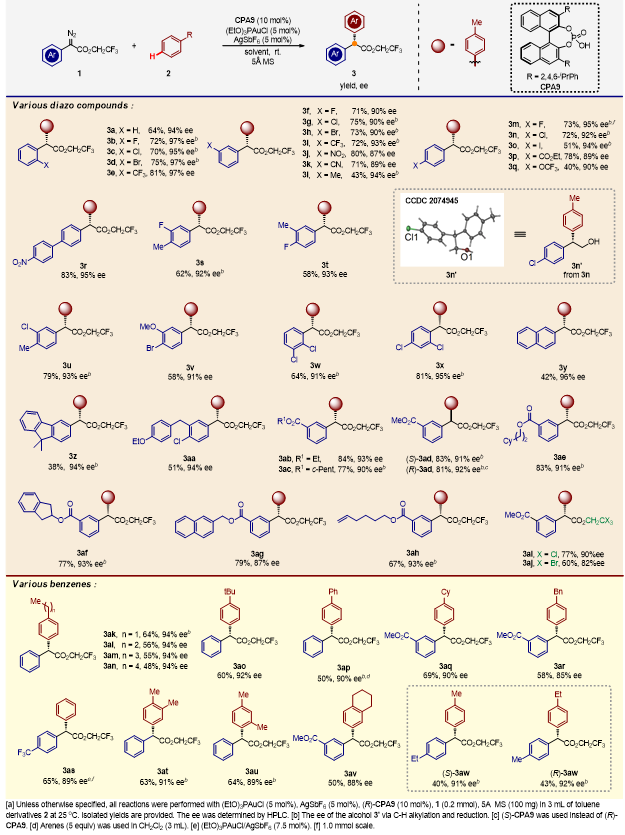
图4. 底物适用性考察(图片来源:Angew. Chem. Int. Ed.)
作者还对烷基重氮酯参与的反应进行了进一步的条件筛选,并进行了适用性考察(图5),苯环上有不同取代基的芳基乙酸甲酯重氮均兼容该反应(5a-5h),能获得90%左右的ee值,重氮含有较大的酯基同样适用(5i)。
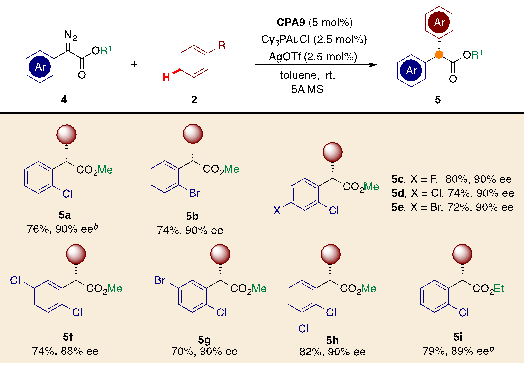
图5. 烷基重氮酯参与反应的适用性考察(图片来源:Angew. Chem. Int. Ed.)
该反应具有反应条件温和、效率高、立体选择性好、适用范围广、易规模制备等优点,是一种快速获得手性1,1-二芳基乙酸酯的方法,该类结构是重要的手性砌块。作者将催化获得的手性1,1-二芳基乙酸酯进行了丰富的转化,获得了包括b,b-二芳基胺(6,7),手性吲哚(8c)以及手性异喹啉(10m)等结构在内的生物活性分子。
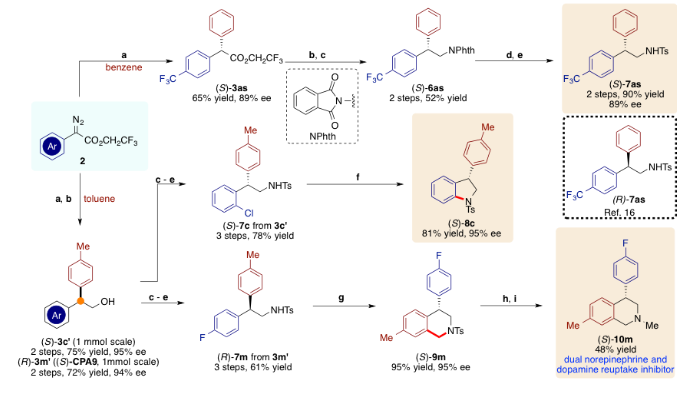
图6. 规模制备及产物转化(图片来源:Angew. Chem. Int. Ed.)
最后作者结合前期工作对该反应的机理进行了初步研究,氘代实验结果与之前报道一致(图7a),线性效应实验结果显示手性磷酸的ee值与产物之间存在明显的负非线性效应,这可能是由于手性诱导步骤中涉及一个以上的手性磷酸导致(图7b)。对催化剂比例研究的结果表明,手性磷酸与金催化剂的比例为2时能得到优异的产率和对映选择性(图7c)。
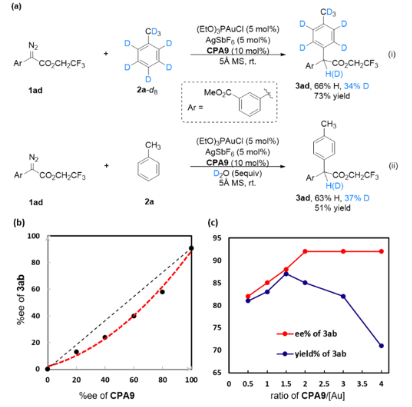
图7. 机理实验(图片来源:Angew. Chem. Int. Ed.)
华东师范大学刘迅绅博士为论文第一作者,刘路教授为论文唯一通讯作者,唐智琼硕士、硕士生司志姚和本科生章智焜、赵蕾也参与此课题的研究,复旦大学张俊良教授和湖南大学赵万祥教授对该研究提供了宝贵意见。该工作得到了国家自然基金科学委、上海市科委项目的资助。
总结:
刘路教授课题组通过使用金/手性磷酸共催化的策略实现了非活化芳烃的高对位选择性和对映选择性的C(sp2)-H官能团化反应。还对烷基重氮酯参与的反应进行了进一步的条件筛选,并进行了适用性考察。该反应具有反应条件温和、效率高、立体选择性好、适用范围广、易规模制备等优点,是一种快速获得手性1,1-二芳基乙酸酯的方法,该类结构是重要的手性砌块。
课题组网站:https://faculty.ecnu.edu.cn/_s34/ll2/main.psp
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn