

正文
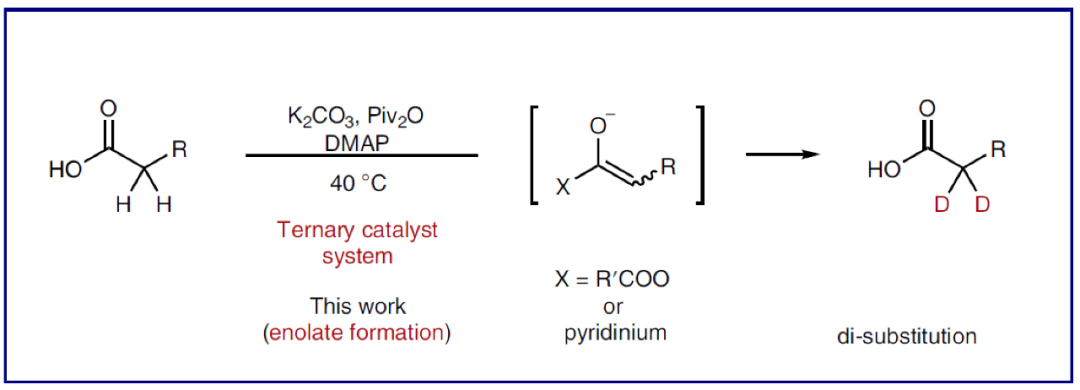
(图片来源:Nature Synthesis)
选择性氘原子标记可以大大增强药物的化学稳定性和耐受性,而对其功能的影响却非常小(Fig. 1a)。因此,对氘标记分子的探索可以为多个科学领域功能分子的创新和发现提供新的途径。羧酸是普遍存在于药物(如非甾体抗炎药)和天然产物中的重要结构单元。利用羧酸中羧基官能团的多样合成转化(如通过缩合生成酯和酰胺,通过氢化还原生成醇,通过Curtius重排生成胺)可以有效实现分子结构的多样性,从而增强分子的功能性。此外,羧酸还可以烷基自由基或阳离子前体,应用于过渡金属催化以及光催化反应中。因此,氘原子标记的羧酸可以作为一类有价值的氘化合成子应用于有机合成中。且发展温和的、高选择性的羧酸α-氘化方法具有重要意义(Fig. 1b)。尽管目前化学家们已经发展出一系列羧酸的氘标记方法,但发展一种温和的,且可以应用于含羧酸骨架的药物和天然产物中的高效氘化方法,仍然具有很大的挑战。目前,利用强碱(如LDA)和氘化试剂可以实现单氘化过程。而若想实现双氘化过程则需要更苛刻的反应条件,如更强的碱性条件和高温等(Fig. 1c, left)。目前最先进的催化方法仍需要高温条件且需要贵金属参与(Fig. 1c, right)。虽然贵金属可以催化实现脂肪酸的氘化,但目前还没有发展出在温和条件下高选择性的实现羧酸α-氘化的方法。由于羧酸固有的Brønsted酸性以及其α-位的弱酸性,因此通常需要两当量以上的强Brønsted碱才可以使羧酸形成烯二醇化物(Fig. 1d, left)。最近,日本九州大学R. Yazaki 和T. Ohshima课题组发展了一种三重催化体系(K2CO3, Piv2O, DMAP),在温和条件下,高化学选择性的实现了羧酸α-位的氘化反应。反应具有良好的官能团兼容性和底物适用性,并可以兼容众多天然产物和药物等结构复杂分子,具有良好的实用性(Fig. 1d, right)。
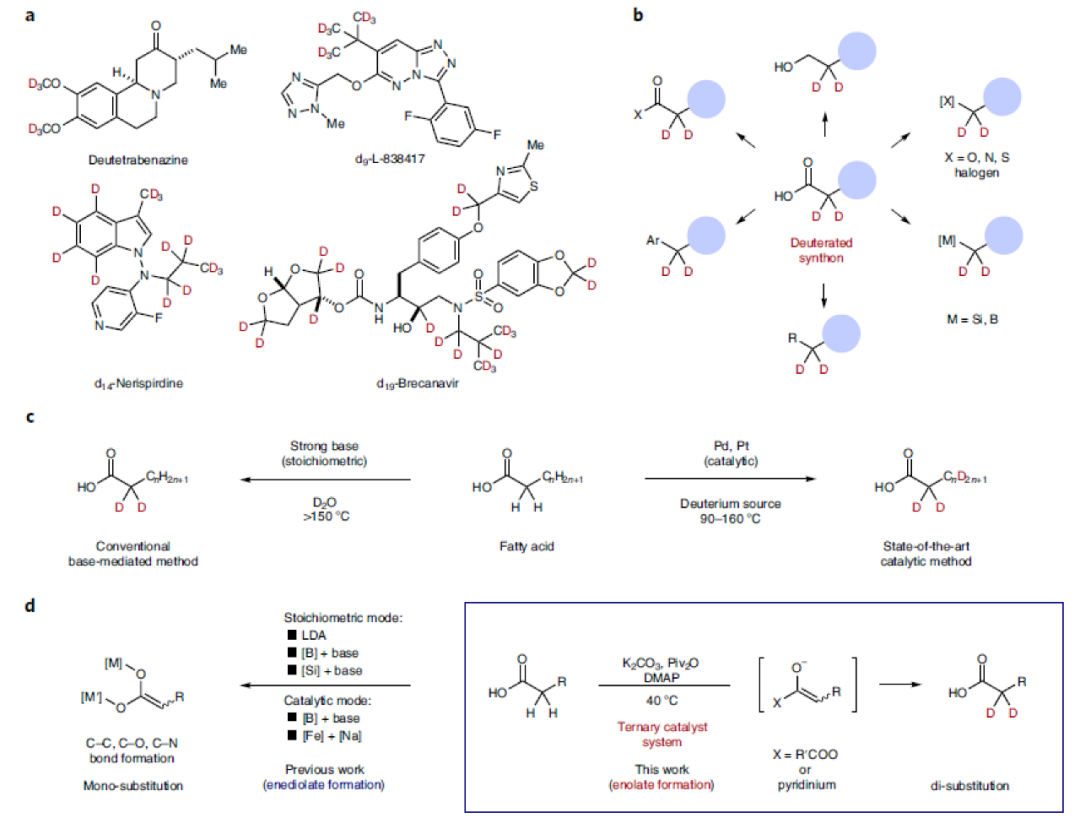

(图片来源:Nature Synthesis)
为了发展此策略,作者聚焦于α-H具有较强酸性的混合酸酐,其可以很容易的利用相应的羧酸制备。经典的Perkin反应表明,混合酸酐可以在弱Brønsted碱的存在下有效脱质子,形成稳定的烯醇物种。作者认为,此反应可能通过以下机理进行的(Fig. 2a):首先混合酸酐I与DMAP形成吡啶盐物种II,其在弱Brønsted碱(羧酸盐)作用下形成烯醇物种III并伴随着羧酸盐与混合酸酐的酰基交换。为了避免混合酸酐和吡啶盐的水解,作者选用氘代丙酮作为氘源。烯醇物种III将被氘代羧酸氘化得到α-氘化酰基吡啶物种IV,随后与羧酸盐发生酰基交换得到α-氘代羧酸产物。
基于上述机理假设,作者利用4-(4-甲氧基苯基)丁酸1作为模板底物进行条件优化。通过条件筛选,作者发现使用K2CO3, Piv2O和DMAP的三重催化体系在氘代丙酮中反应24小时可以以94%的氘代率得到相应的产物1-d2。此外,作者通过控制实验表明三种催化剂均很重要,缺一不可(Fig. 2b)。接下来,作者使用1作为原料进行了克级规模试验,反应72小时后以重水淬灭可以以95%的氘代率得到产物1-d2,证明此转化的实用性(Fig. 2c)。
为了进一步验证上述机理,作者进行了控制实验(Fig. 2d)。实验结果表明DMAP可以有效促进烯醇化过程的进行。此外,计算结果表明通过酰基吡啶物种II的烯醇化过程是可行的。
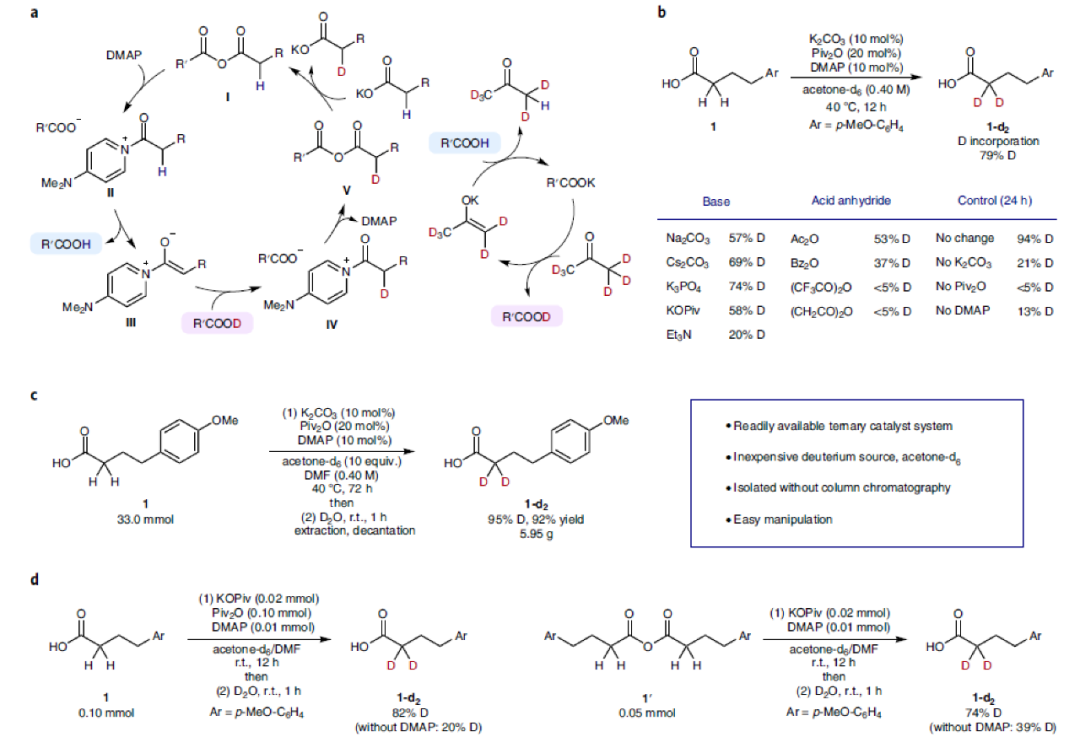

(图片来源:Nature Synthesis)
在得到最优反应条件后,作者对此羧酸α-氘化反应的底物范围进行了考察(Table 1)。实验结果表明此转化具有良好的官能团兼容性和底物适用性。包括三氟甲基(2-d2)、频哪醇硼酯(3-d2)、Boc保护的胺基(4-d2)、氮杂环丁烷(5-d2)等基团均可兼容。值得注意的是,对于天然产物(亚油酸6-d2、亚油酸衍生物7-d2、GABA衍生物8-d2-10-d2)和药物(氯芬衍生物11-d2、恶丙嗪12-d2、氯霉素13-d2、加巴喷丁衍生物14-d2、依托多拉酸15-d2)等复杂分子也均可以兼容。此外,α-取代的羧酸也可以兼容(16-d2-18-d2)。除了烷基羧酸外,α-芳基羧酸(如联苯乙酸、伊索克酸、消炎痛、舒林酸、酮洛芬、洛索洛芬等)也可以以类似的效率实现氘化过程(19-d2-27-d2)。此外,此反应对连有杂原子(S,O,N)的羧基α-碳原子的氘化过程仍然有效(28-d2-38-d2)。由此,一系列保护的α-氨基酸(丙氨酸、缬氨酸、丝氨酸、赖氨酸、蛋氨酸)和多肽衍生物也均可以利用此方法实现α-碳原子的氘代(32-d2-38-d2)。
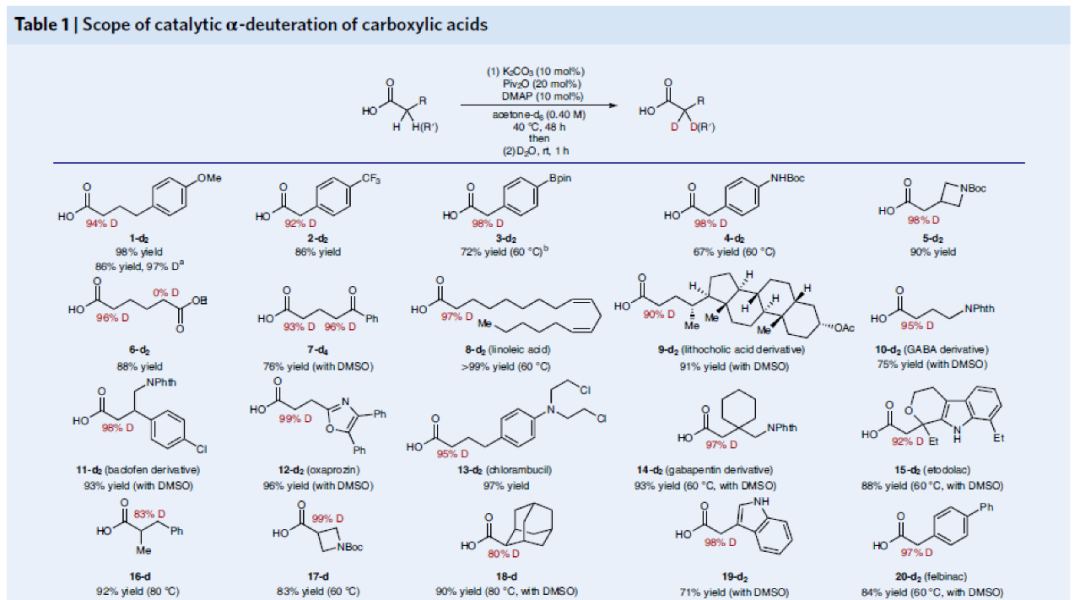
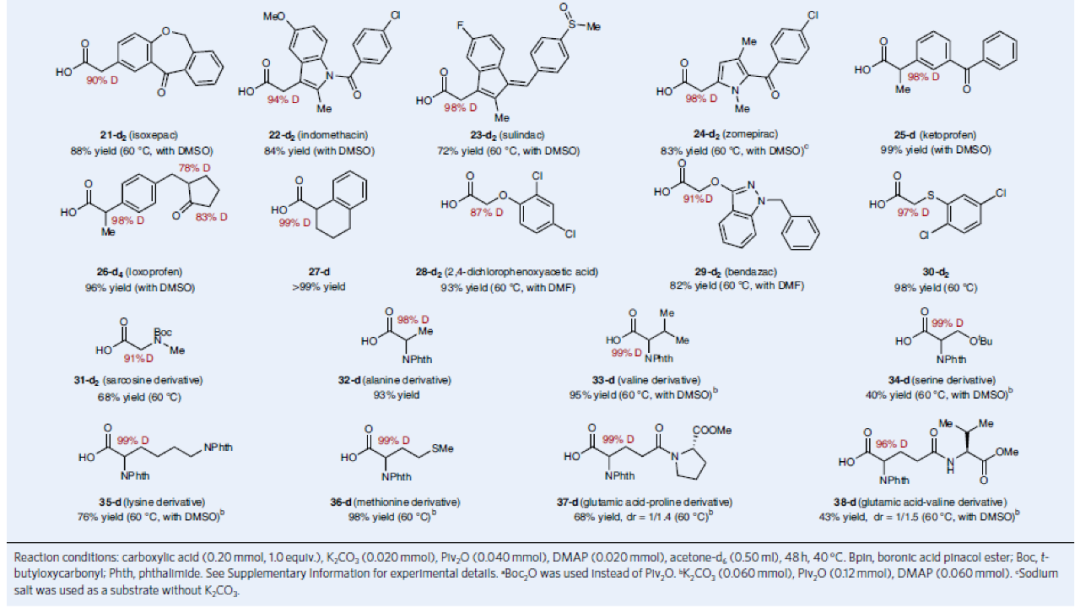
(图片来源:Nature Synthesis)
接下来,作者对合成出的α-氘化产物进行了多种合成转化(Fig. 3)。首先,作者使用合成出的产物1-d2,通过缩合、还原以及Curtius重排等过程实现了羧基的合成转化,并且这些转化过程对氘代率并没有影响。随后,作者利用衍生产物43-d2的脱羧反应分别实现了苄位氘化产物44-d2、α-氘化频哪醇硼酯45-d2以及β-氘化酮46-d2的合成(Fig. 3a)。此外,作者分别成功实现了47-d2(Fig. 3b)和4-d2(Fig. 3c)的脱羧氘化反应,实现了端位氘代甲基产物的合成。以上合成转化证明了此反应具有良好的实用性和应用性。
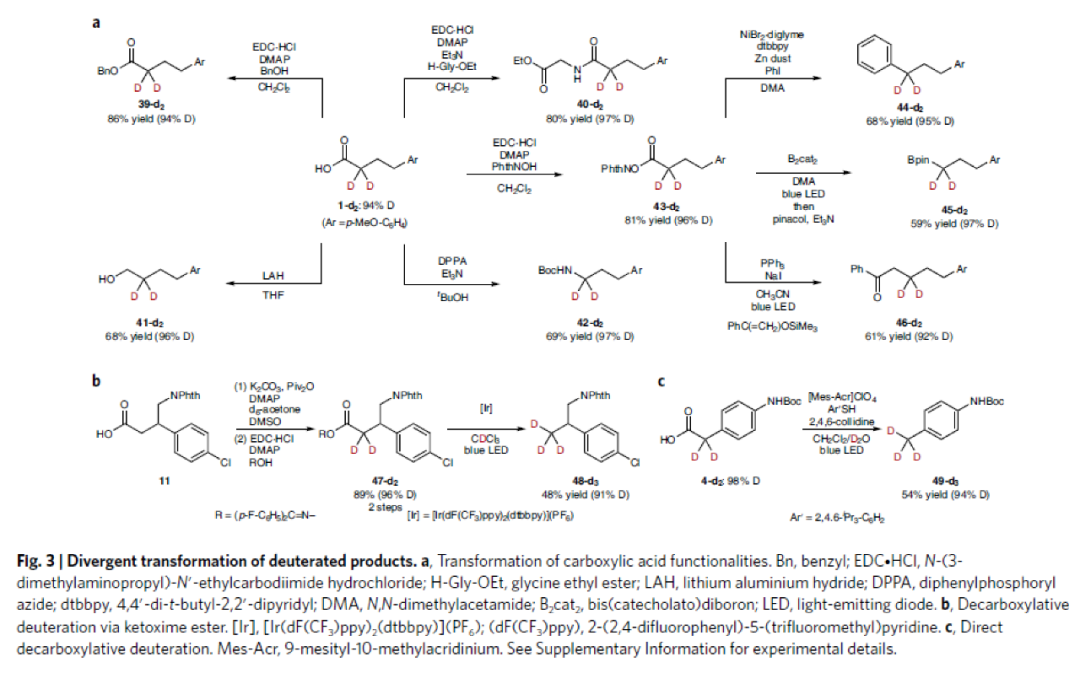
(图片来源:Nature Synthesis)
最后,作者利用发展出的方法实现了氘化EP3受体拮抗剂60-d3的全合成(Fig. 4a)并对其其代谢稳定性进行评估(Fig. 4b)。实验结果表明,氘代的EP3受体拮抗剂60-d3相比于非氘化的EP3受体拮抗剂60在人类细胞中的代谢稳定性得到增强。
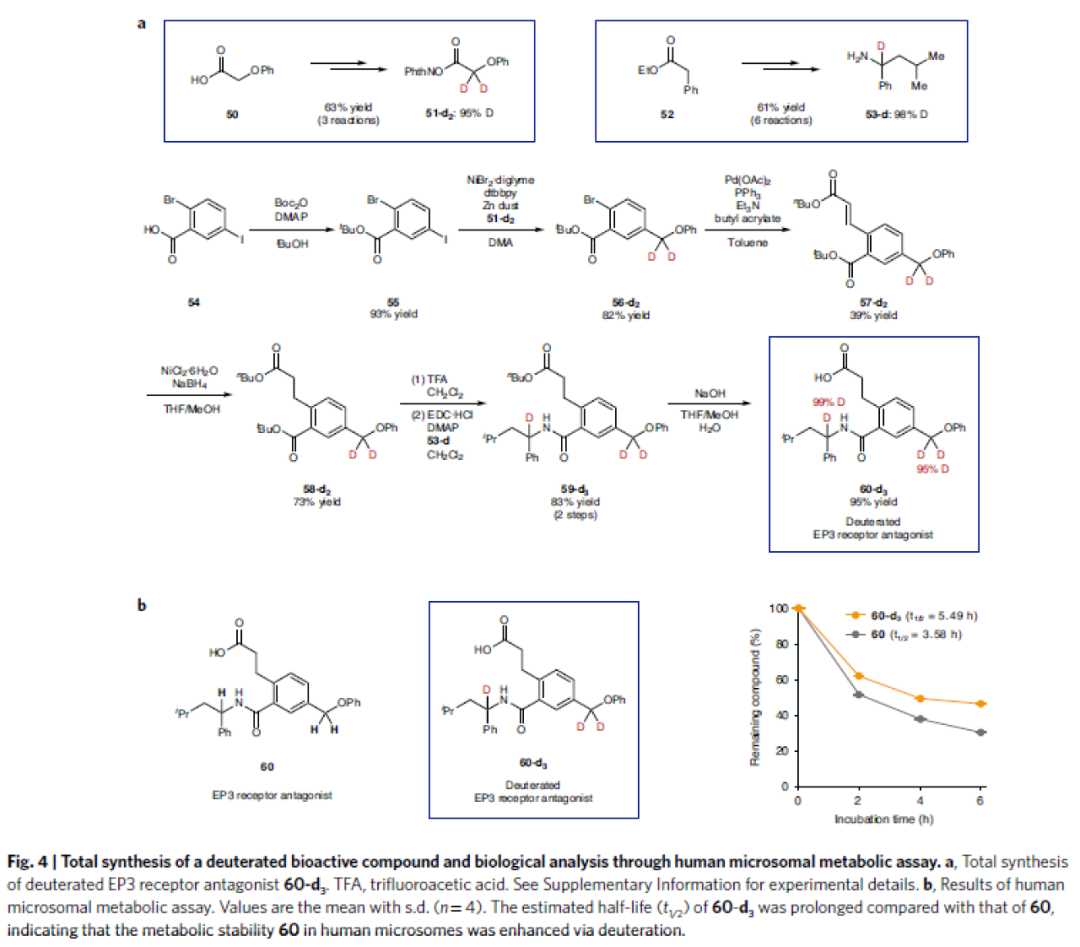
(图片来源:Nature Synthesis)
总结
日本九州大学R. Yazaki 和T. Ohshima课题组发展了一种三重催化体系(K2CO3, Piv2O, DMAP),高效实现了羧酸α-位的氘化反应。反应条件温和,可操作性强,且具有良好的化学选择性和底物适用性。重要的是,此转化可以兼容一系列天然产物和药物等结构复杂分子,且可以进行大量合成。此外,作者对合成出的氘化产物进行了多种合成转化并利用发展出的方法实现了氘化EP3受体拮抗剂60-d3的全合成,进一步证明了此反应的实用性。
文献详情:
长按或扫码左侧二维码查看原
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn