


(图片来源:Nat. Commun.)
近几十年来,奎宁一直吸引着合成有机化学家的注意,由于它包含了四个手性中心,因此高立体选择性的实现其合成具有很大的挑战。自从1944年Woodward和Doering课题组首次实现了外消旋奎宁的合成后,Stork、Jacobsen、Kobayashi、Jacobsen、Aggarwal、Maulide以及Chen等课题组分别利用不同策略实现了手性奎宁的合成。近些年,有机催化已应用于奎宁的全合成中。Hatakeyama和Ishikawa课题组分别利用有机催化策略实现了手性奎宁的合成。虽然目前已经发展出了多种(-)-奎宁的不对称全合成方法,但开发一种高效实用的合成方法仍然是必要的。此外,由于奎宁在药物和有机催化中的重要性,发展其结构的多样衍生化具有重要意义。
一锅法是指在一锅反应中形成多根键并构建复杂分子的有效方法。此外,一锅反应操作通过原位淬灭过程可以避免多个纯化步骤,从而最大限度地减少了化学废物的产生并节省了时间。基于此,Yujiro Hayashi课题组提出了“pot economy”这一概念。随后,该课题组基于这一概念完成了许多全合成。最近,Yujiro Hayashi课题组发展了利用有机催化介导,通过五锅反应以14%的总收率高效实现了(-)-奎宁的不对称全合成。
Fig. 1展示了(-)-奎宁的逆合成分析过程。首先,(-)-奎宁6可以利用哌啶前体2通过分子内的SN2反应实现C6-N键的构建;而2可以通过喹啉与哌啶醛3的加成反应来构建;3则可以通过取代的哌啶衍生物4通过官能团转化得到;最后,4可以通过醛5、硝基烯烃6以及亚胺7的三组分偶联反应来合成。
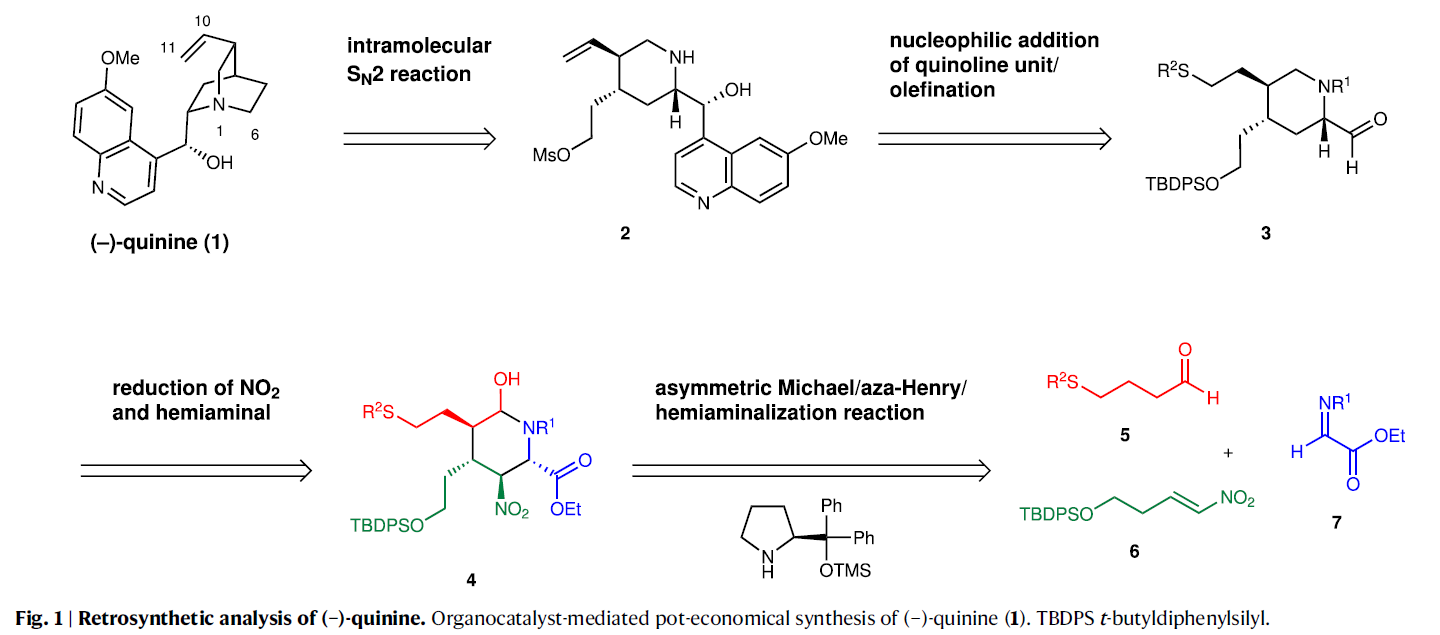
(图片来源:Nat. Commun.)
早些时候,作者报道了二苯脯氨醇硅醚介导的Michael反应、aza-Henry反应和半缩胺醛化反应,一锅实现了哌啶骨架的合成(Fig. 2)。由于在早期的研究中使用了简单的起始原料,作者认为在使用多官能团化底物时是否可以高立体选择性实现转化将是一个巨大的挑战。
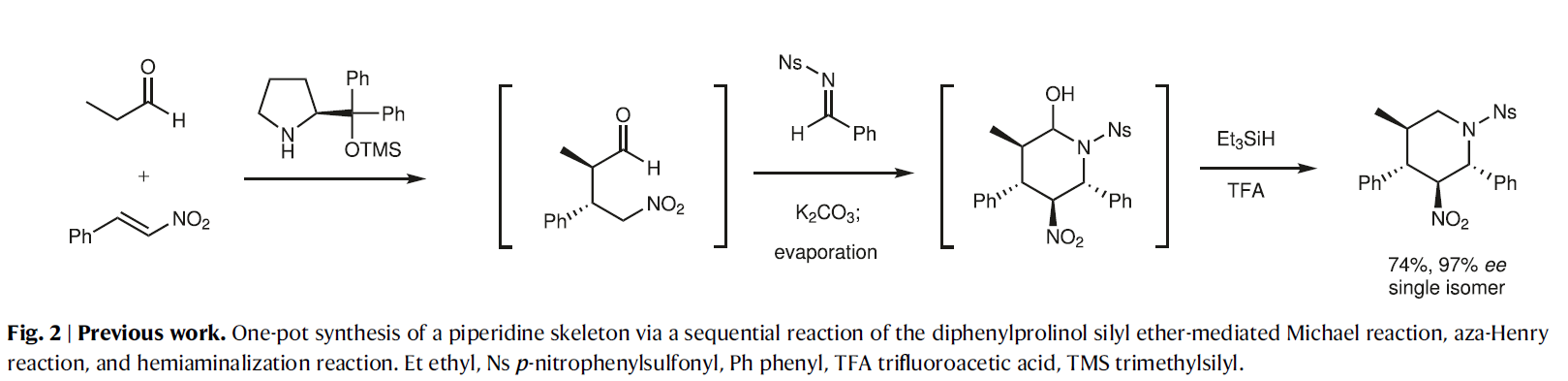
(图片来源:Nat. Commun.)
第一锅反应:
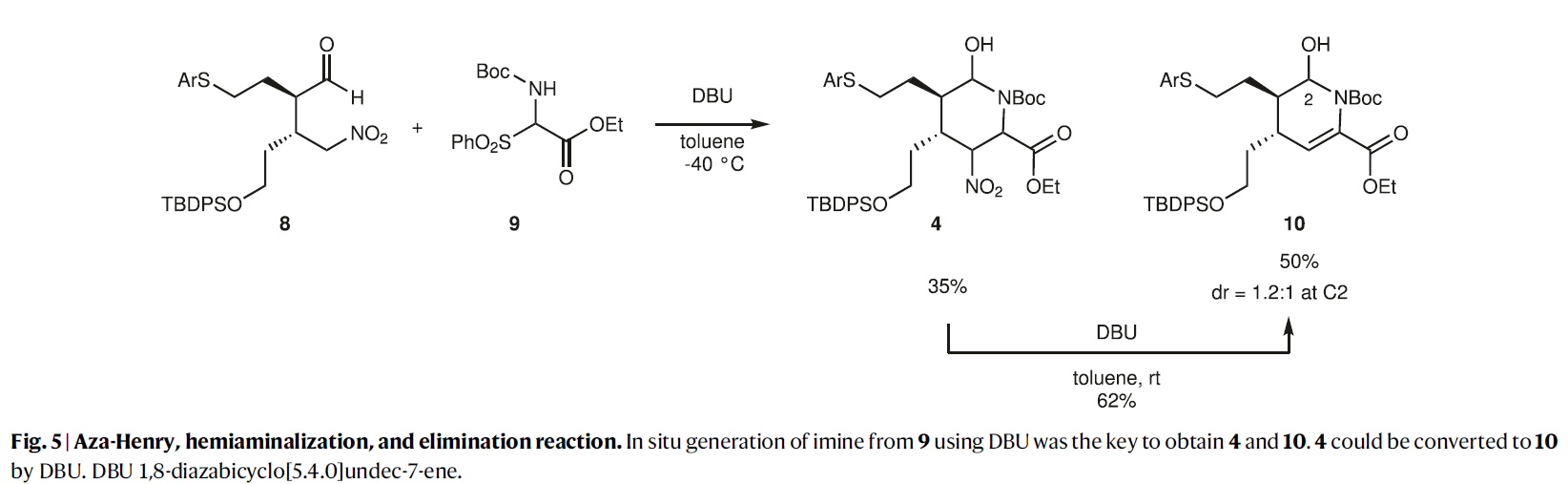
考虑到合成后期需要引入C10-C11双键,因此作者选择5作为起始原料。在二苯脯氨醇硅醚的催化下,5与硝基烯烃6发生不对称Michael反应,以92%的产率和98%的ee值得到了产物8(dr = 10:1)(Fig. 3)。然而,随后的aza-Henry反应则具有一定的困难。在作者之前的报道中使用了芳基醛形成的Ns(对硝基苯磺酰基)亚胺(Fig. 2)。而乙醛酸乙酯的Ns亚胺7a太不稳定很难操作(Fig. 4)。利用对甲氧基苯胺衍生的亚胺7b由于太过稳定也不能和8发生反应。相应的N-Boc亚胺7c虽然具有合适的稳定性和反应活性,但是其分离较困难。因此,作者选择由相应的磺酰基前体9与DBU原位生成N-Boc亚胺来参与反应。利用8和9的串联反应(包括亚胺的生成和aza-Henry反应两步)可以很好的进行,分别以35%和50%的产率得到了哌啶4和四氢吡啶10(Fig. 5)。虽然4是目标产物,但对于全合成来说10是一个更合适的中间产物,因为从4脱除NO2通常需要苛刻的反应条件。而4经DBU处理可以62%的产率得到10。
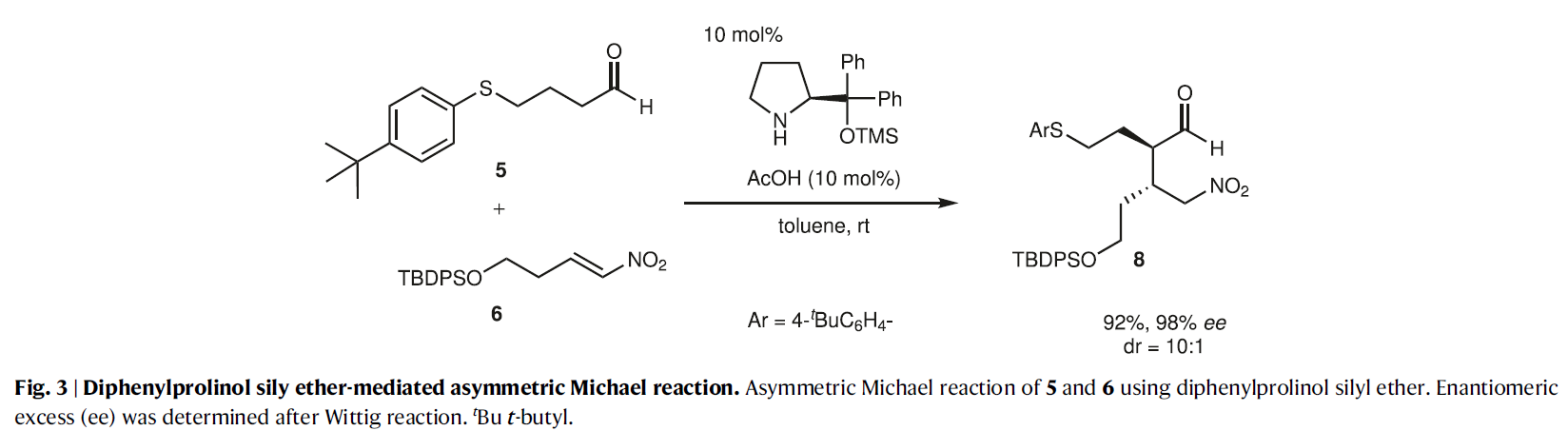
(图片来源:Nat. Commun.)
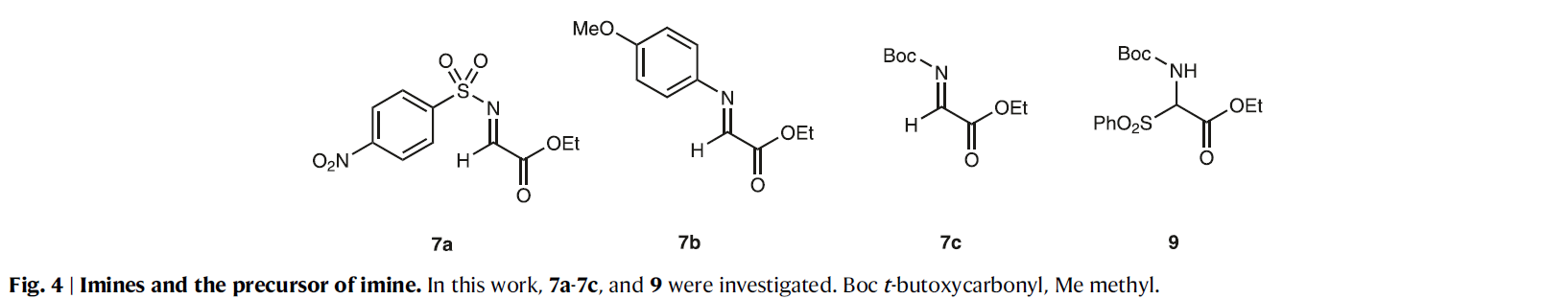
(图片来源:Nat. Commun.)
(图片来源:Nat. Commun.)
这些转化均可以在一锅中进行(5 + 6→10)(Fig. 6)。首先,5与6发生不对称Michael反应得到8。随后在同一容器中加入亚胺前体9和DBU后,发生了串联反应(原位亚胺生成、aza-Henry反应、半缩胺醛化反应)生成4。紧接着,4在DBU作用下消除HNO2,得到10的C2非对映体混合物。最终以良好的总收率,高的非对映选择性(C3 dr = 10:1)和良好的对映选择性(98% ee)实现了中间产物10的合成,且反应可以放大至十克级规模。需要注意的是,DBU作为碱在这个转化过程中起到了三个作用:(1)生成亚胺(9→7c);(2)促进aza-Henry反应;(3)消除HNO2。
第二锅反应:
第二锅反应始于在-20 oC下用Et3SiH和CF3CO2H(TFA)与10反应来还原去除C2的羟基。当反应混合物的温度升高到室温时,发生了脱Boc保护过程,生成烯胺12,而12可以发生互变异构生成亚胺13。当在反应容器中加入NaBH(OAc)3后,会发生立体选择性还原得到14。加入CH3CHO可以分解剩余的还原试剂,并在减压下去除多余的CH3CHO和TFA。因此,通过这种原位淬灭方法可以高效实现一锅法序列反应。
在反应混合物中进一步加入Boc2O和Et3N,可得到多取代的哌啶衍生物15(具有所需构型的单一异构体)。需要注意的是,TFA作为酸有三重作用:(1)它在低温(-20 oC)下促进10生成四氢吡啶;(2)在高温下脱除Boc基团;(3)生成亚胺离子13。使用同一种试剂在一锅反应中起多种作用体现了此合成策略的高效性。反应可以以克级规模进行,第二锅反应(10→15)的总产率为78%。
第三锅反应:
第三锅反应包括C10-C11烯烃制备和酯的还原。利用Matsuo的策略可以实现芳基硫醚15与16反应,生成了烯烃17。接下来,在相同的反应容器中低温(-95 oC)下加入DIBAL可以实现酯的还原,通过一锅两步反应以77%的产率得到了醛18,且此步骤仍可以实现克级规模合成。

(图片来源:Nat. Commun.)
第四锅反应:
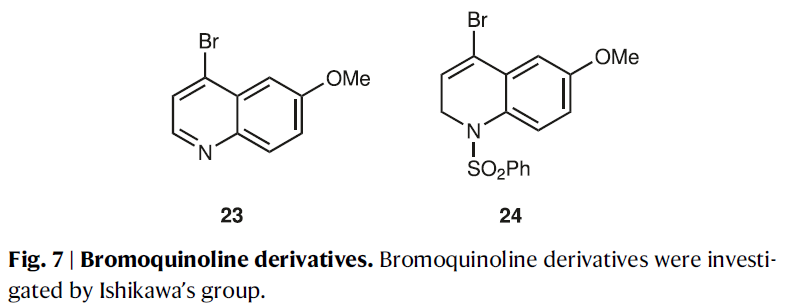
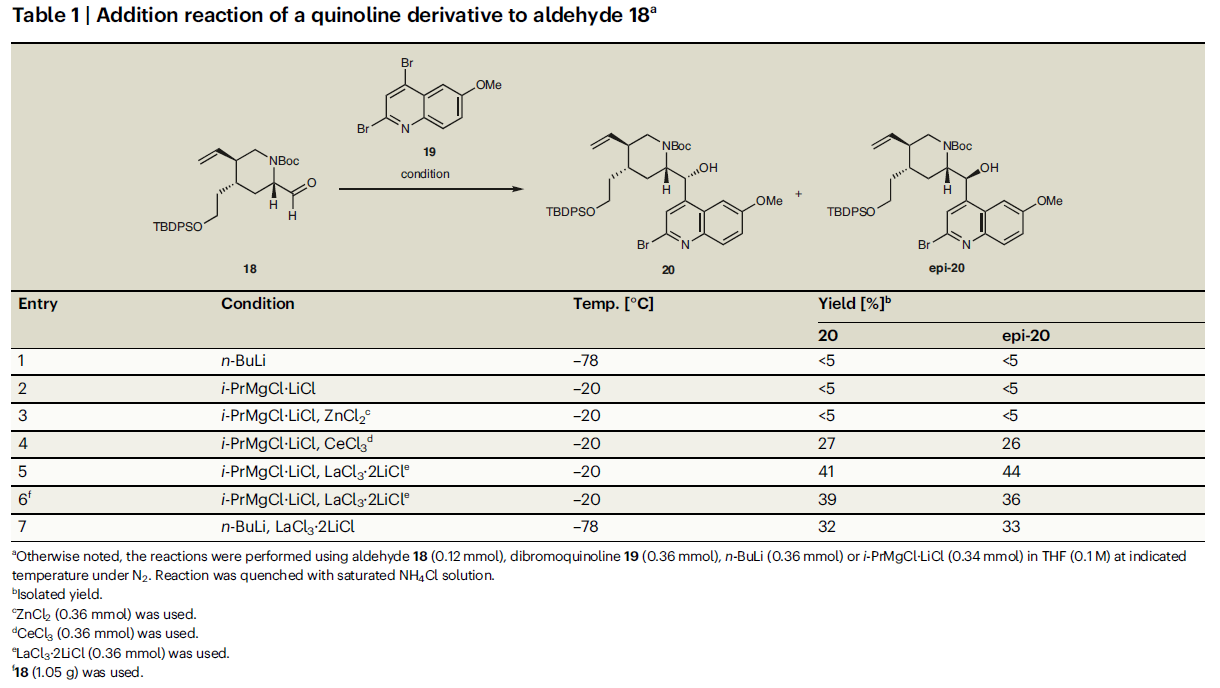
第四锅反应涉及在醛18上引入喹啉骨架。根据Ishikawa的报道,由于喹啉的C2位是亲电性的,因此由23生成的几种喹啉金属物种没有与类似的醛发生反应而生成了23的二聚体。因此其开发了由24生成的二氢喹啉锂试剂作为亲核试剂(Fig. 7)。为了合成奎宁的C2’衍生物,并降低喹啉在C2的亲电性,作者选用2,4-二溴-6-甲氧基喹啉19作为喹啉前体。通过一系列条件筛选(Table 1),作者发现当使用i-PrMgCl·LiCl进行卤镁交换在加入LaCl3·2LiCl作为添加剂后可以分别以41%和44%的产率得到产物20和epi-20(Table 1,entry 5)。此反应可以放大至克级规模(Table 1,entry 6),且epi-20可以通过DMP氧化和LDBBA还原两步转化为20(85%)。
(图片来源:Nat. Commun.)
(图片来源:Nat. Commun.)
第五锅反应:
当用20与锌和乙酸反应后,C-Br键被还原为C-H键从而生成21。随后21在原位生成的HCl作用下脱Boc和TBDPS保护得到哌啶22。当使用吡啶作碱时,可以利用MsCl选择性的与伯醇发生甲磺酰化,并得到哌啶的盐酸盐。随后在加入氨后可以得到哌啶2,且过量的氨可以通过减压去除。最后2通过子内的SN2反应实现了C6-N键的构建从而实现了(-)-奎宁1的合成。最后一锅反应(20→1)的总产率为55%。
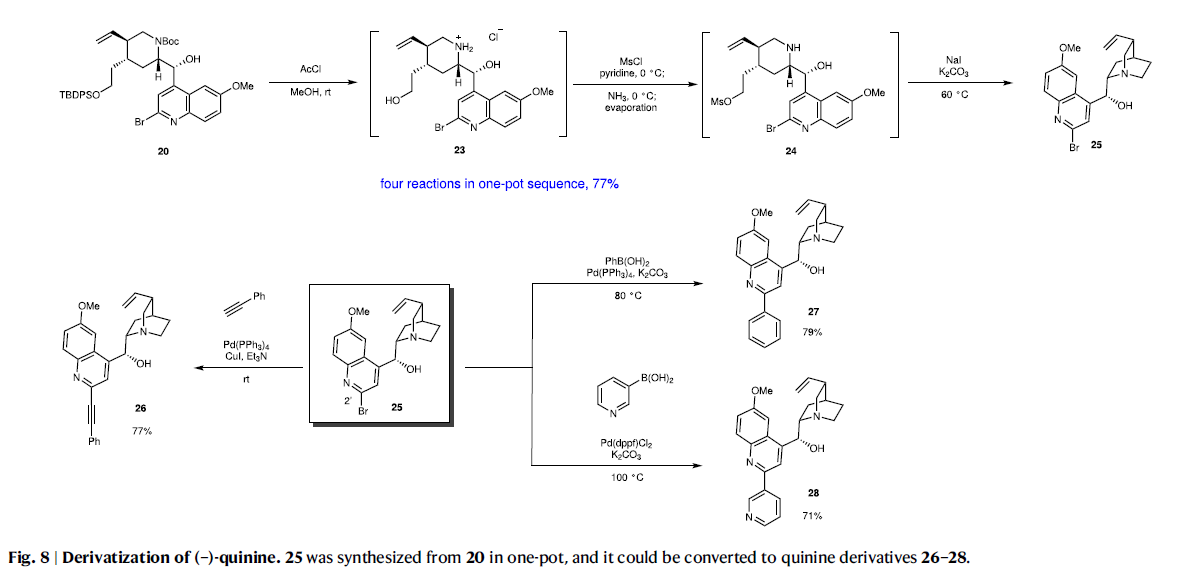
当使用Br(C2)-喹啉衍生物19作为亲核试剂时,使得(-)-奎宁在C2’位置的衍生成为可能。利用类似的方法作者以20为原料以77%的产率实现了Br(C2’)-(-)-奎宁25的合成。此外,利用Sonogashira偶联和Suzuki偶联可以成功的在分子内引入炔基、芳基和杂芳基,以良好的产率实现26、27和28的合成(Fig. 8)。
(图片来源:Nat. Commun.)
总结
日本东北大学Yujiro Hayashi课题组发展了高对映选择性和步骤经济性的策略,仅通过五锅反应就以14%的总收率实现了(-)-奎宁的全合成。此外,使用2,4-二溴-6-甲氧基喹啉来引入喹啉骨架的策略使(-)-奎宁在C2’位置的衍生成为可能。此策略总共需要五次单独的一锅操作和五次柱层析纯化即可以实现(-)-奎宁的合成,具有优良的合成效率和实际应用性,为(-)-奎宁的全合成提供了新的途径。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn