

(图片来源:Nat. Catal.)
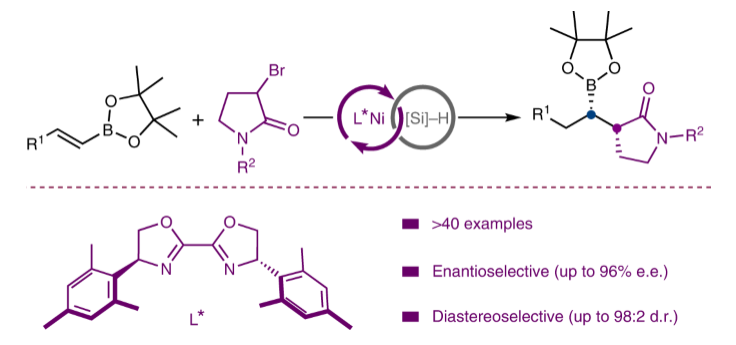
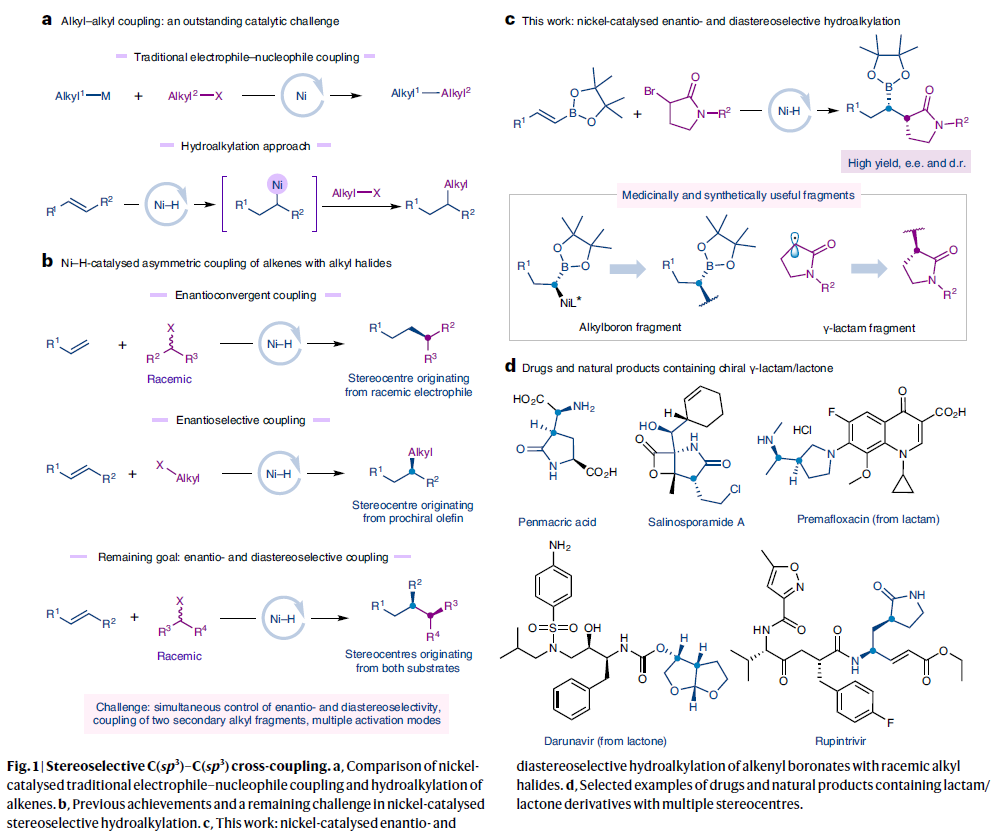
过渡金属催化的C(sp3)–C(sp3)偶联反应是实现药物分子模块化合成的可靠工具(Fig. 1a)。镍催化偶联反应的快速发展使此策略能够兼容更广泛的偶联配偶体,包括各种外消旋烷基亲电试剂和亲核试剂。为了避免过量有机金属试剂的使用,近些年Ni–H催化的氢-烷基化反应得到广泛的发展,且其具有良好的官能团兼容性。然而,在Ni–H催化的氢-烷基化反应中控制C(sp3)–C(sp3)键形成的立体化学则具有一定的挑战性。在过去几年里,化学家们发展了外消旋烷基亲电试剂与烯烃的对映体归一交叉偶联和烯烃的对映选择性氢-烷基化反应(Fig. 1b)。而前者生成了一个由烷基亲电试剂产生的对映体富集的C(sp3)中心,后者生成了一个由烯烃亲核试剂产生的对映体富集的C(sp3)中心。然而,利用两种反应试剂来引入两个相邻对映体富集C(sp3)中心的策略并没有报道(Fig. 1b)。尽管相邻手性碳的建立方法有所报道,但是其非对映选择性较差且均需使用炔丙基卤和有机锌试剂作为偶联配偶体。最近,瑞士洛桑联邦理工学院胡喜乐课题组发展了Ni–H催化内烯烃与消旋烷基溴化物的立体选择性氢-烷基化反应。通过此方法,可以利用两个不同反应试剂引入两个相邻的C(sp3)中心,并高立体选择性的实现C(sp3)-C(sp3)键的构建(Fig. 1c),从而实现了一系列含有手性内酰胺、内酯、吡咯烷等骨架的潜在活性分子的合成(Fig. 1d)。
(图片来源:Nat. Catal.)
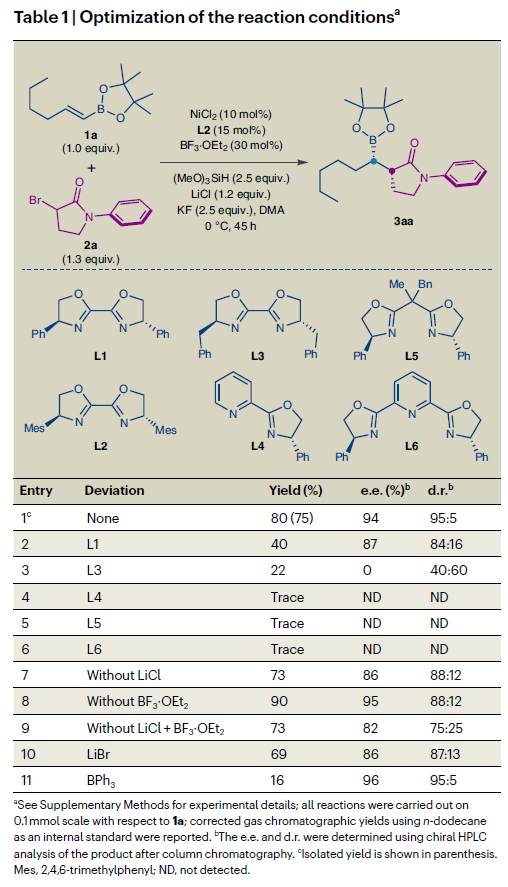
首先,作者以烯基频哪醇硼酯1a和α-Br-γ-内酰胺2a为模板底物进行条件筛选(Table 1)。发现当使用NiCl2(10 mol%)作催化剂,L2(15 mol%)为配体,BF3·OEt2(30 mol%)作路易斯酸添加剂,(MeO)3SiH(2.5 equiv)作氢源,KF(2.5 equiv)作碱,LiCl(1.2 equiv)作添加剂,DMA作溶剂,在0 oC下反应45小时可以以75%的分离产率得到目标产物3aa(94% ee,95:5 d.r.)(Table 1, entry 1)。且控制实验结果表明:1)芳基取代的Bi-Ox型配体对反应的立体选择性至关重要;2)锂离子和路易斯酸硼试剂可以有效增强立体控制效果。
(图片来源:Nat. Catal.)
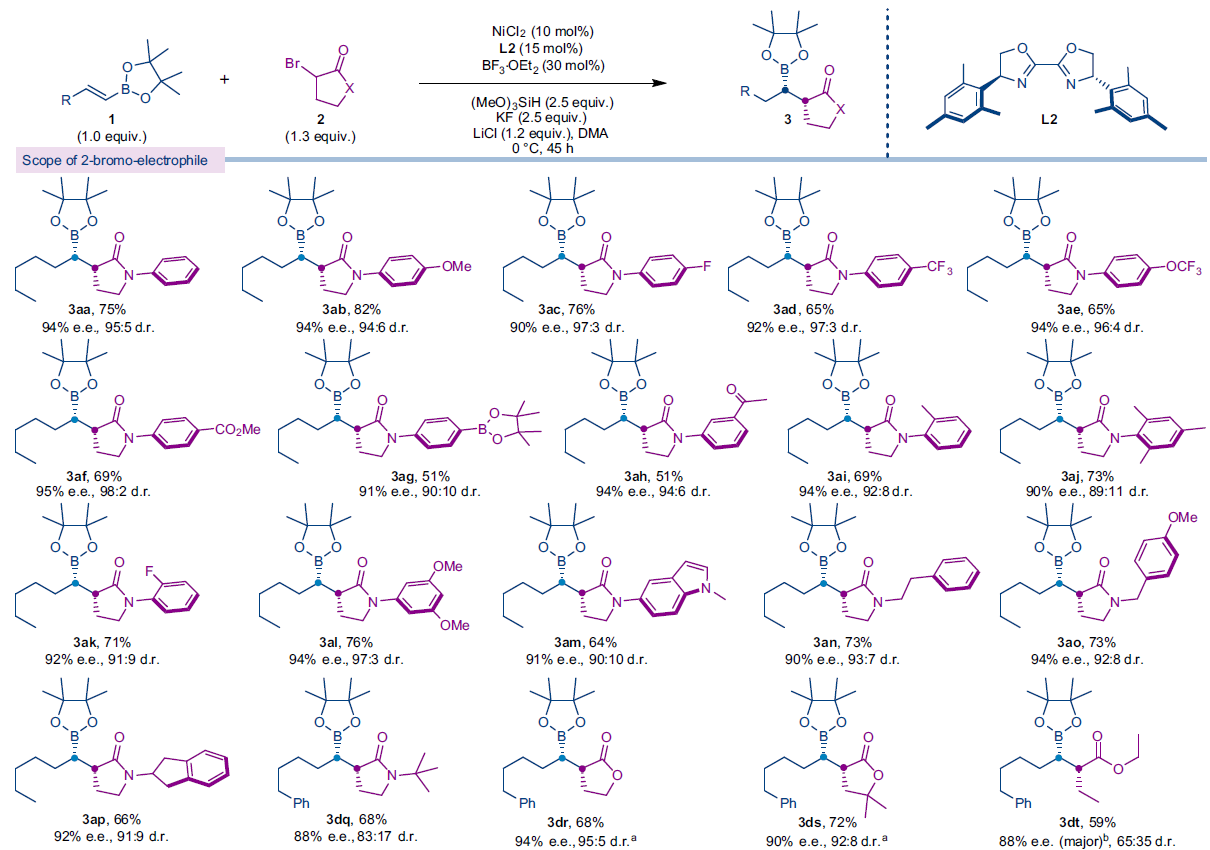
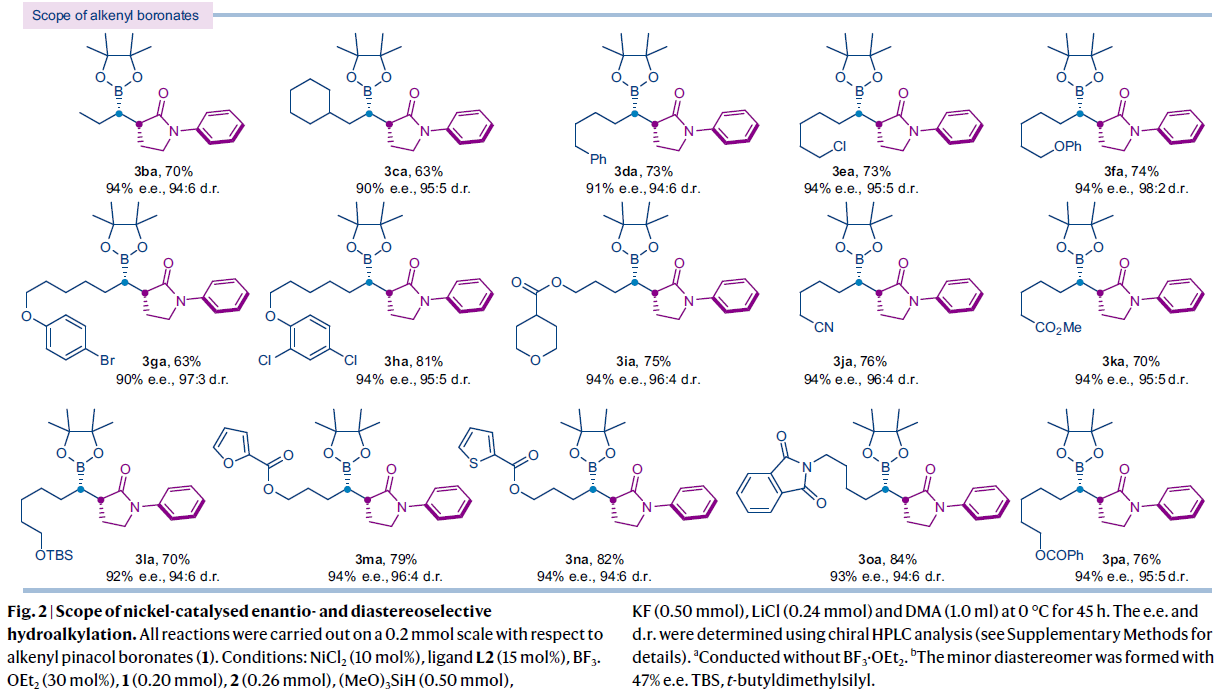
在得到了最优条件后,作者对此氢-烷基化反应的底物范围进行了探索(Fig. 2)。实验结果表明,一系列不同取代的2-溴-γ-内酰胺均可顺利实现转化,以51-82%的产率实现相应的氢-烷基化产物3aa-3dq的合成。γ-内酰胺氮原子上的芳基对位取代基可以兼容不同类型的吸电子基和供电子基,如-OMe(3ab), -F(3ac), -CF3(3ad), -OCF3(3ae), -CO2Me(3af), -COMe(3ah)。值得注意的是,可以发生进一步合成转化的-Bpin也可以兼容(3ag)。芳基邻位取代基会使产物的d.r.值略有降低(3ai-3ak)。此外,N-杂芳基(3am)和N-烷基(3an-3dq)取代的2-溴-γ-内酰胺均可兼容。对于氮原子上含有三级烷基取代的底物会严重影响产物的d.r.值(83:17)(3dq)。这些结果表明内酰胺氮原子上取代基的立体位阻会影响反应的非对映选择性。除了2-溴-γ-内酰胺以外,2-溴-γ-内酯也可以作为底物以良好的产率、对映选择性和非对映选择性实现相应的氢-烷基化产物3dr和3ds的合成。对于这些底物的转化不再需要BF3·OEt2作添加剂。对于非环状的2-溴酯类似物也可以良好的产率和ee值得到产物3dt,但是d.r.值较低。由此表明底物的环状结构对非对映选择性控制至关重要。遗憾的是,可能是由于立体位阻的影响,三级烷基溴并不能兼容。
一系列不同取代的烯基频哪醇硼酯也均可顺利实现转化,以63-84%的产率实现相应的氢-烷基化产物3ba-3oa的合成。烯烃上的不同的官能团,如烷基氯(3ea), 醚(3fa, 3ga, 3ha), 硅醚(3la), 酯 (3ia, 3ka, 3ma, 3na, 3pa), 烷基腈(3ja), 芳基(3da), 邻苯二甲酰亚胺(3oa)等均可兼容。此外,对于药物相关的杂环,如呋喃(3ma), 噻吩(3na), 四氢吡喃(3ia)也可兼容。值得注意的是,芳基氯和芳基溴(3ga, 3ha)亦可兼容此镍催化反应体系,这为产物的后续官能团化提供了多种可能性。产物3aa, 3ab, 3ad和3af的立体化学绝对构型通过单晶衍射得到证实。
(图片来源:Nat. Catal.)
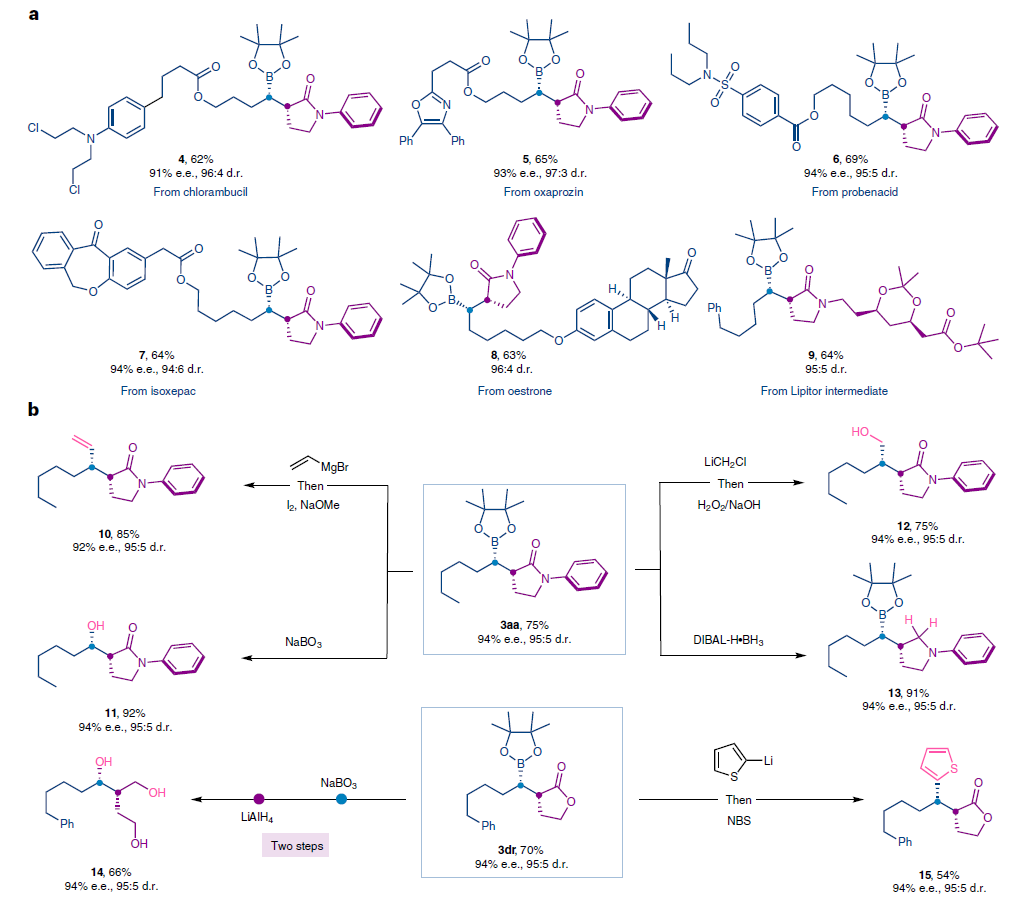
随后,作者尝试应用此策略对一系列药物和天然产物衍生物进行官能团化(Fig. 3a)。Chlorambucil、Oxaprozin、Probenecid、Isoxepac、Oestrone衍生的烯基频哪醇硼酯均可顺利实现转化,以良好的产率、对映选择性和非对映选择性实现了氢-烷基化产物4-8的合成。此外,对于在合成Lipitor中应用的胺中间体衍生的2-溴-γ-内酰胺也可以顺利实现转化,以64%的产率得到产物9(d.r. = 95:5)。
接下来,作者尝试对合成的产物进行多样性合成转化(Fig. 3b)。产物中的硼基可以立体专一的转化成乙烯基(10)、羟基(11)、羟甲基(12)、噻吩基(15)等,且所有的转化均不会使e.e.值和d.r.值降低。此外,内酰胺骨架可以被还原成药物相关的吡咯烷(13)而不会发生消旋化。产物3ag的内酯环通过连续的氧化和还原以66%的产率得到手性非环三醇14,且立体化学得到保持。
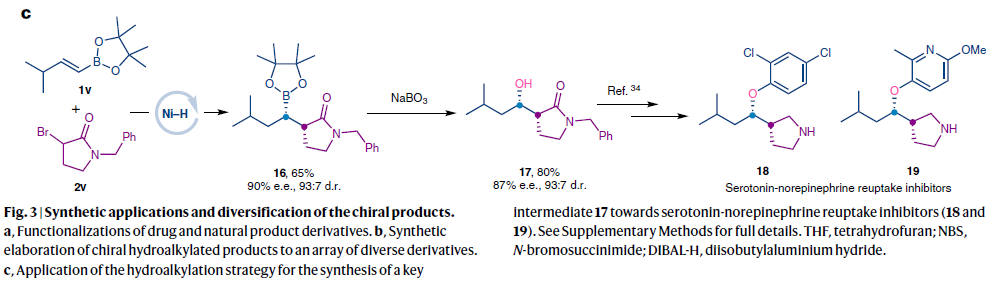
最后,利用此方法作者还实现了两个抗抑郁药物分子的关键中间体18和19的合成。
(图片来源:Nat. Catal.)
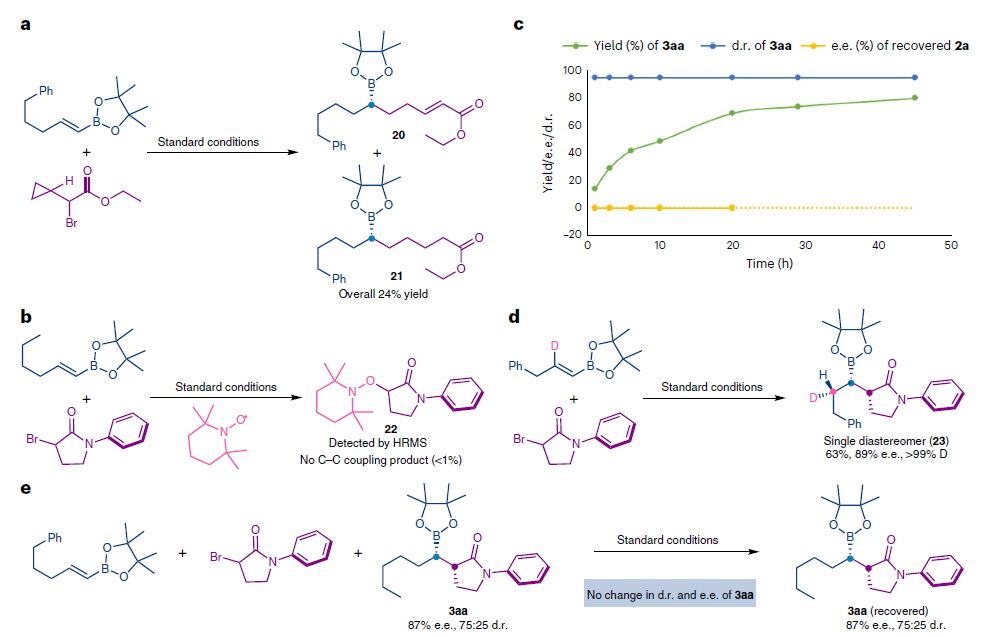
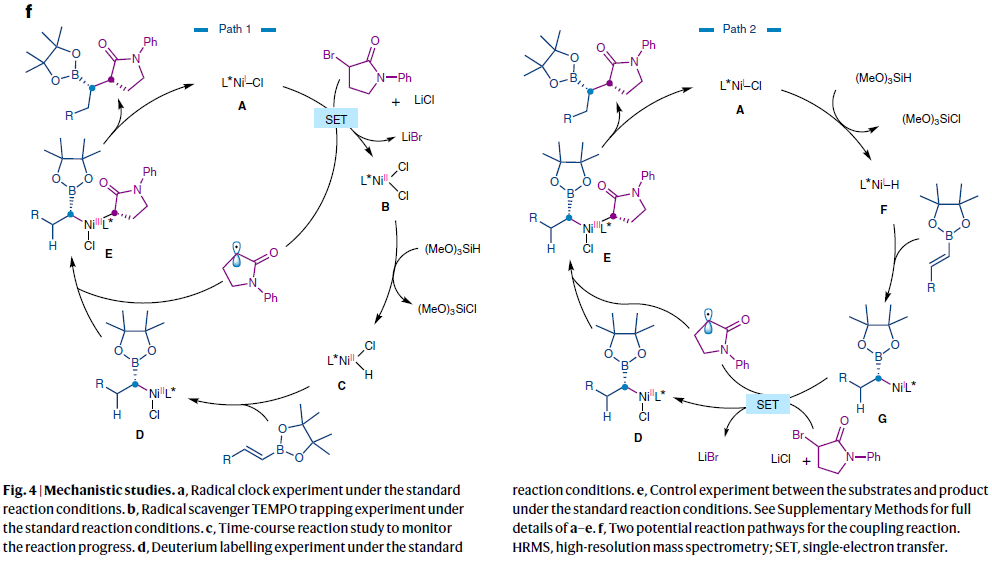
为了深入理解反应机理,作者进行了一系列控制实验(Fig. 4)。首先,在自由基钟实验中,作者观察到了环丙基的开环(Fig. 4a)。随后,在自由基捕获剂TEMPO的存在下,作者发现反应被完全抑制,并观察到了TEMPO-加合物22的生成(Fig. 4b)。上述实验均表明烷基卤活化后会产生烷基自由基中间体。随后,作者通过对时间与产物3aa的非对映选择性以及回收原料2a的对映体过量关系进行监测,得出外消旋烷基卤化物的转化是通过对映归一过程进行的,而非动力学拆分过程(Fig. 4c)。接下来,作者利用氘代的烯基频哪醇硼酯参与反应,可以以69%的产率得到单一的非对映体产物23,由此表明烯烃插入Ni–H键是反应立体选择性的决定步骤(Fig. 4d)。当使用BF3·OEt2作添加剂时,反应的非对映立体选择性会有所增强。这可能是由于BF3·OEt2或反应中形成的另一物种会促使不同异构体间的异构化过程。但作者通过控制实验排除了上述可能性。因为当将产物3aa在标准条件下反应并没有观察到3aa的e.e.值和d.r.值发生改变(Fig. 4e)。
最后,基于上述实验结果和文献报道,作者提出了此转化可能的反应机理(Fig. 4f)。作者认为此转化可能包含基于NiI/NiII/NiIII的两种可能的催化循环。在path 1中,首先NiI–Cl物种A通过单电子转移活化烷基溴得到双卤NiII物种B和α-羰基烷基自由基。随后物种B与(MeO)3SiH反应得到NiII–H物种C,并与烯烃发生迁移插入得到NiII-α-硼-烷基中间体D。而D可以捕获α-羰基烷基自由基形成NiIII双烷基物种E。最后E通过还原消除得到偶联产物并再生NiI–Cl物种A。在path 2中,NiI–Cl物种A优先与(MeO)3SiH反应得到NiI–H物种F。随后F与烯烃发生迁移插入得到NiI-α-硼-烷基物种G。接着中间体G活化烷基卤得到NiII-α-硼-烷基中间体D和α-羰基烷基自由基。接下来,这两个物种重新结合得到NiIII双烷基物种E。最后E通过还原消除得到偶联产物并再生NiI–Cl物种A。对于这两个催化循环,作者认为立体选择性主要来自于对映选择性的氢-金属化过程得到手性Ni-α-硼-烷基中间体以及NiIII双烷基物种的非对映选择性还原消除。后面则通过Ni-α-硼-烷基中间体可逆的Ni-C键均裂来诱导对映体归一过程。这两个催化循环的主要区别在于活化烷基亲电试剂的物种不同。
(图片来源:Nat. Catal.)
总结
瑞士洛桑联邦理工学院胡喜乐课题组发展了Ni–H催化内烯烃与消旋烷基溴化物的氢-烷基化反应,高立体选择性的实现了C(sp3)-C(sp3)键的构建。该方法具有良好的底物适用性和官能团兼容性,可以兼容包括生物活性分子在内的复杂分子。利用此方法为具有多个立体中心的C(sp3)富集分子的模块化合成提供了新的思路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn