- 首页
- 资讯
JMC:山大李敏勇团队在靶向蛋白降解新策略和新技术研究方面取得新进展
来源:山东大学 2023-01-09
导读:近日,山东大学药学院李敏勇教授团队在新型靶向蛋白降解策略研究领域取得新进展,在药物化学权威期刊Journal of Medicinal Chemistry(中科院一区,TOP)上发表了题为“Targeted Protein Degradation Induced by HEMTACs Based on HSP90”的研究性论文,药学院博士研究生李臻臻为第一作者,李敏勇教授为独立通讯作者,山东大学为第一作者单位和唯一通讯作者单位。

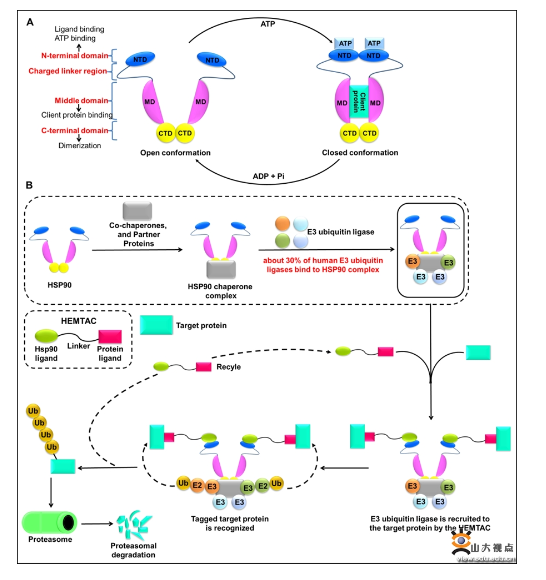
在对药物化学的不断探索中,新的靶向疾病驱动蛋白的策略正在不断地被开发,其中,由小分子诱导的靶向蛋白降解策略是近年来最值得关注的,该策略可以靶向无活性位点或者不可成药的蛋白靶标,使得降解任意一种蛋白成为了可能。PROTAC技术相关的候选药物ARV-110和ARV-471已进入临床II期,PROTAC技术主要针对细胞内蛋白,而LYTAC和AbTAC等一系列技术可以降解细胞外分泌蛋白和膜蛋白。蛋白降解技术在靶向不可成药靶点和疾病治疗方面展现出了非常大的潜力。虽然这些新的降解技术的出现可以克服小分子抑制剂的局限性,但是,新兴的降解技术也存在一些局限性,小分子PROTAC通过“劫持”E3连接酶发挥其降解作用,然而已有研究表明基于VHL和CRBN的小分子PROTAC在细胞中会引起脱靶效应和耐药机制的产生。因此,迫切需要扩大靶向降解技术的范围,开发新的蛋白降解技术。李敏勇教授团队基于热休克蛋白90(HSP90)能够结合E3泛素连接酶形成复合物的关键特性以及HSP90与肿瘤之间的密切关系,设计开发一种新型的蛋白降解技术,并将其命名为热休克蛋白90介导的靶向嵌合体(HEat shock protein 90 (HSP90)-MediatedTArgetingChimeras, HEMTACs)。小分子HEMTACs包含三个部分:与靶蛋白结合的配体、连接链和与HSP90结合的配体。连接链连接两个配体构成小分子HEMTACs。HEMTACs通过“劫持”HSP90,也就是“劫持”HSP90/E3泛素连接酶复合物(HSP90/E3),可以诱导目标蛋白(POI)、HEMTAC和HSP90/E3复合物之间形成新的三元复合物。形成的POI-HEMTAC-HSP90/E3三元复合物是将E3泛素连接酶招募到目标蛋白以及随后的泛素分子转移并诱导目标蛋白被蛋白酶体降解的必要条件。该研究工作以CDK4/6抑制剂和HSP90抑制剂作为相应的配体设计并合成了一系列靶向CDK4/6的小分子HEMTACs。活性评价结果表明,小分子HEMTAC在B16F10黑色素瘤细胞中能够成功诱导CDK4/6的降解,并且小分子HEMTAC具有显著的体内抗黑色素瘤的作用。综上,这一概念验证研究证明了小分子HEMTACs作为一种新型的靶向降解策略的可行性,并为降解同一靶点提供了更多的选择,同时也为开发其他相关的蛋白降解技术提供了一种新的、行之有效的策略。近年来,李敏勇教授团队综合应用合理药物设计、计算机辅助药物分子设计、分子生物学和化学生物学等手段进行药物化学研究工作,在生物活性的可视化研究、分子探针研究以及合理药物设计与药物化学研究等方面取得了一系列研究成果,近5年先后以通讯作者在J. Am. Chem. Soc.、Cell Chem. Biol.、Acta Pharm. Sin. B、J. Med. Chem.、Anal. Chem.等期刊发表SCI论文70余篇,被SCI引用5400余次,被引H指数为41;授权中国和PCT发明专利20项。上述研究成果获得了国家自然科学基金、山东省泰山学者、山东省自然科学基金、微生物技术国家重点实验室创新群体基金等项目的资助。论文链接:https://doi.org/10.1021/acs.jmedchem.2c01648
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn