

(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
首先,作者选择ACP 1a作为模板底物对此铑催化的(3+2+2)碳环化反应进行探索(Table 1)。通过一系列反条件筛选,作者发现当使用1a (1 equiv), 5 mol % [Rh(COD)Cl]2, 20 mol% PPh3, 在p-xylene (0.05 M)中,120 °C反应可以以92%的产率, 良好的非对映选择性(dr ≥19:1)得到(3+2+2)碳环化产物2a(Table 1, entry 3)。此外,当使用20 mol% P(OPh)3作配体时,仍可以以91%的产率得到2a(dr ≥19:1)(Table 1, entry 10)。由此表明反应的决速步不受配体性质的影响。
(图片来源:J. Am. Chem. Soc.)
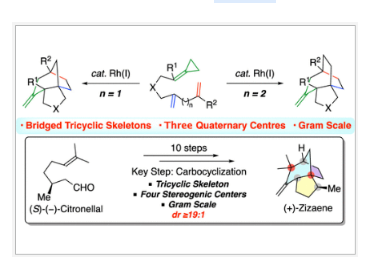
在得到了最优反应条件后,作者对此转化的底物适用范围进行了探索(Table 2)。实验结果表明不同取代的氮桥连、碳桥连以及氧桥连的1,4-二烯烃底物均可兼容,以70-95%的产率得到相应的三环产物2a-2i。此外,该转化还兼容额外引入的角甲基,使中间体具有三个新的季碳中心,并得到相应的产物2j-2o (52-83%)。遗憾的是,含有角甲基的氧桥连的底物在反应中会发生降解从而得到复杂的混合物。而对于ACP连接的1,5-二烯烃同样可以顺利经历此分子内碳环化过程,以41-88%的产率得到相应的三环产物3p-3t, 3v-3x。遗憾的是,可能是由于立体位阻的影响,芳基取代的氧桥连底物仅仅得到了痕量产物3u。整体来讲,此转化提供了一种简便的方法,在一次操作中高非对映选择性的实现了含有多达3个立体中心的桥接三环骨架的合成。
(图片来源:J. Am. Chem. Soc.)
基于上述实验结果和文献报道,作者提出了此转化可能的反应机理(Scheme 2)。首先,ACP 1与Rh(I)发生氧化加成得到四元环Rh(III)中间体A。随后,A经历重排得到的Rh(III) TMM(trimethylenemethane)络合物与1,1-二取代烯烃的近端配位得到中间体B。接下来,TMM络合物经历1,2-插入得到烯丙基金属环中间体C。另一个端烯配位促使发生2,1-插入到更具亲核性的Rh-C键得到中间体D。最后,D通过C(sp3)-Rh-allyl还原消除得到三环产物2或3并再生Rh(I)催化剂。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
总结
P. Andrew Evans课题组报道了铑催化ACP连接的1,4-二烯烃或1,5-二烯烃的分子内(3+2+2)碳环化反应,实现了一系列桥接三环骨架的合成。此转化底物适用性广泛,为构建具有多于三个季碳中心的桥接三环化合物提供了一种新的途径。值得注意的是,作者利用简单易得的起始原料,通过10步合成即实现了倍半萜烯类天然产物(+)-Zizaene的不对称全合成,证明了此转化的实用价值。
文献详情:
Yu Zhu, Jie Zheng, P. Andrew Evans*, Intramolecular Rhodium-Catalyzed [(3+2+2)] Carbocyclization Reactions with Dienylidenecyclopropanes: A Concise and Stereoselective Total Synthesis of the Sesquiterpene (+)-Zizaene. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.2c10923
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn