


肝细胞癌(HCC)是全球第六大常见癌症,也是癌症相关死亡的第三大原因。尽管在免疫治疗、手术切除和肝移植方面取得了重大进展,HCC的预后仍然不佳。
随着对肿瘤生物学及肿瘤代谢复杂性的了解深入,发现代谢重编程控制肿瘤能量和生物合成途径,这是恶性肿瘤的标志之一。越来越多的研究证实肿瘤葡萄糖有氧糖酵解途径是肿瘤治疗的潜在靶点。基于肿瘤葡萄糖代谢的检测技术如PET/CT、同位素示踪检测、代谢流等已被广泛应用于肿瘤临床诊断和治疗中。
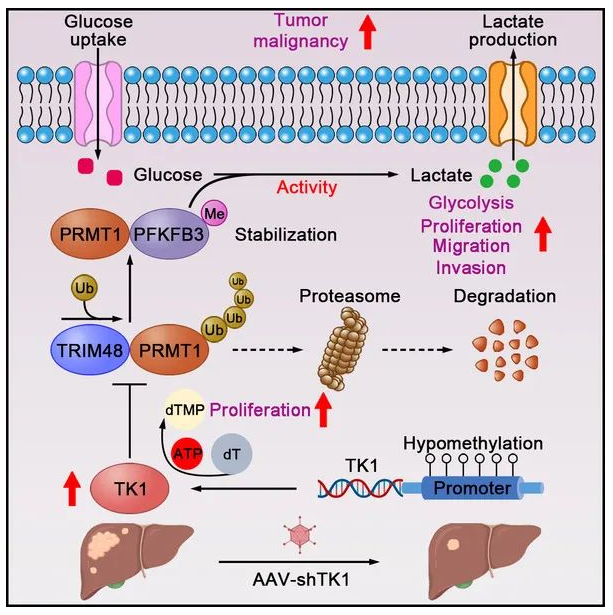
本研究基于大规模转录组数据库筛选,确定了TK1与HCC恶性生物学行为、代谢重编程和预后不良高度正相关,是HCC进展的关键驱动因素;并首次揭示了TK1以激酶依赖和非激酶依赖的方式促进HCC的恶性进展。
TK1不仅可以通过其经典功能产生脱氧胸腺嘧啶核苷酸(dTMP)来促进HCC的增殖能力,还可以通过阻断TRIM48介导的泛素化降解来稳定蛋白质精氨酸甲基转移酶1(PRMT1),从而促进肿瘤糖酵解和糖酵解相关恶性生物学行为。同时,在化学诱导HCC小鼠模型中也验证了靶向肝脏TK1的潜在治疗作用。因此,同时靶向TK1的激酶依赖和非激酶依赖的分子机制有助于开发或制定不同的HCC治疗策略。
南京医科大学第一附属医院肝胆中心主任王学浩院士为该研究论文的通讯作者,第一附属医院肝胆中心主任李清博士为该研究论文的第一作者。本研究获得国家自然科学基金重点项目在内的多项国家级项目的支持。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(23)00095-5
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn