


研究背景
苯并呋喃的开环反应是一种很有价值但尚未开发的苯酚衍生物的制备方法。近日,华南理工大学制浆造纸工程国家重点实验室黄良斌教授课题组及南京大学王敏燕教授课题组报道了镍催化苯并呋喃与硅烷的开环反应,选择性地得到了邻烯基、支链烷基硅烷和烯基硅烷取代的苯酚衍生物。作者通过控制实验和DFT计算验证Ni-H迁移插入再β-O消除来实现苯并呋喃的C-O键活化,但不是通过Ni(0)直接氧化加成到苯并呋喃的C-O键。进一步的区域选择性氢硅化或脱氢硅化是通过Ni(I)-H或Ni(I)-[Si]中间体,形成支链/直链性烷基硅烷或烯基硅烷取代的苯酚衍生物。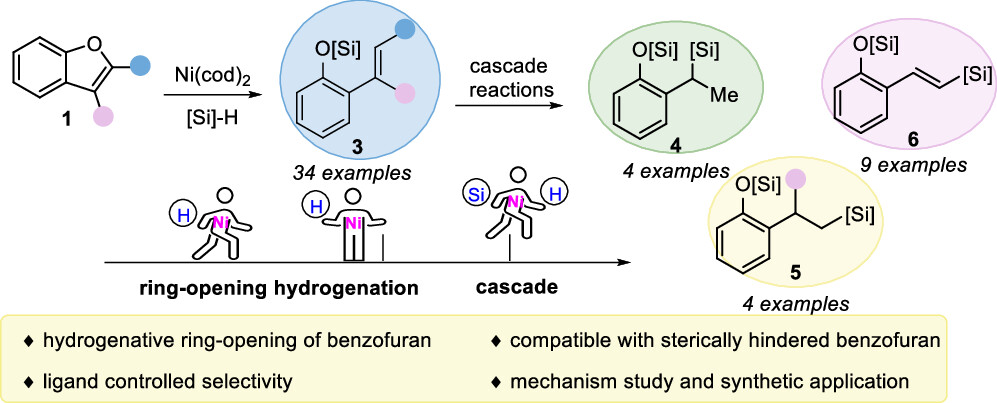
图文解读
镍催化苯并呋喃开环,多样构建邻位官能团化的苯酚衍生物
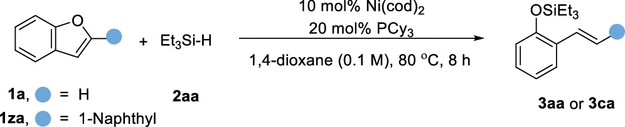
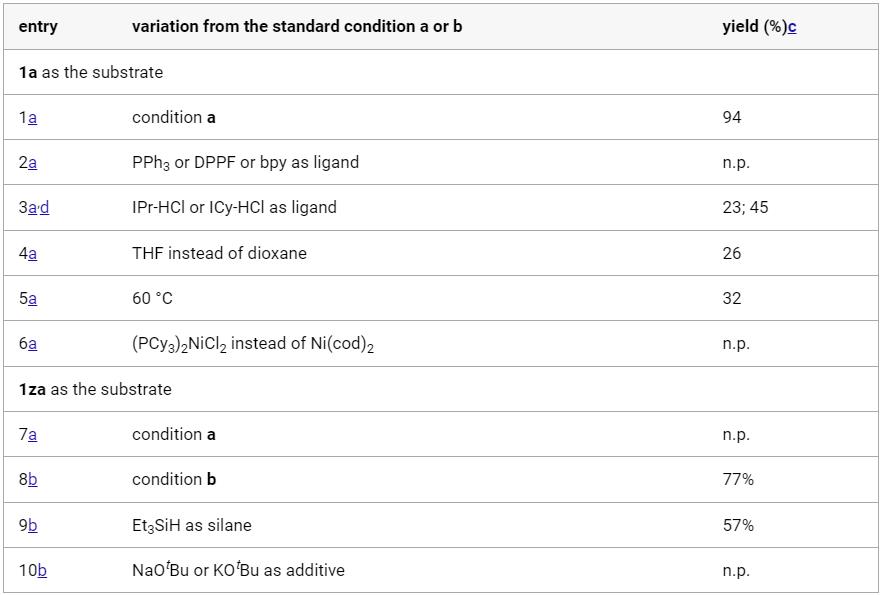
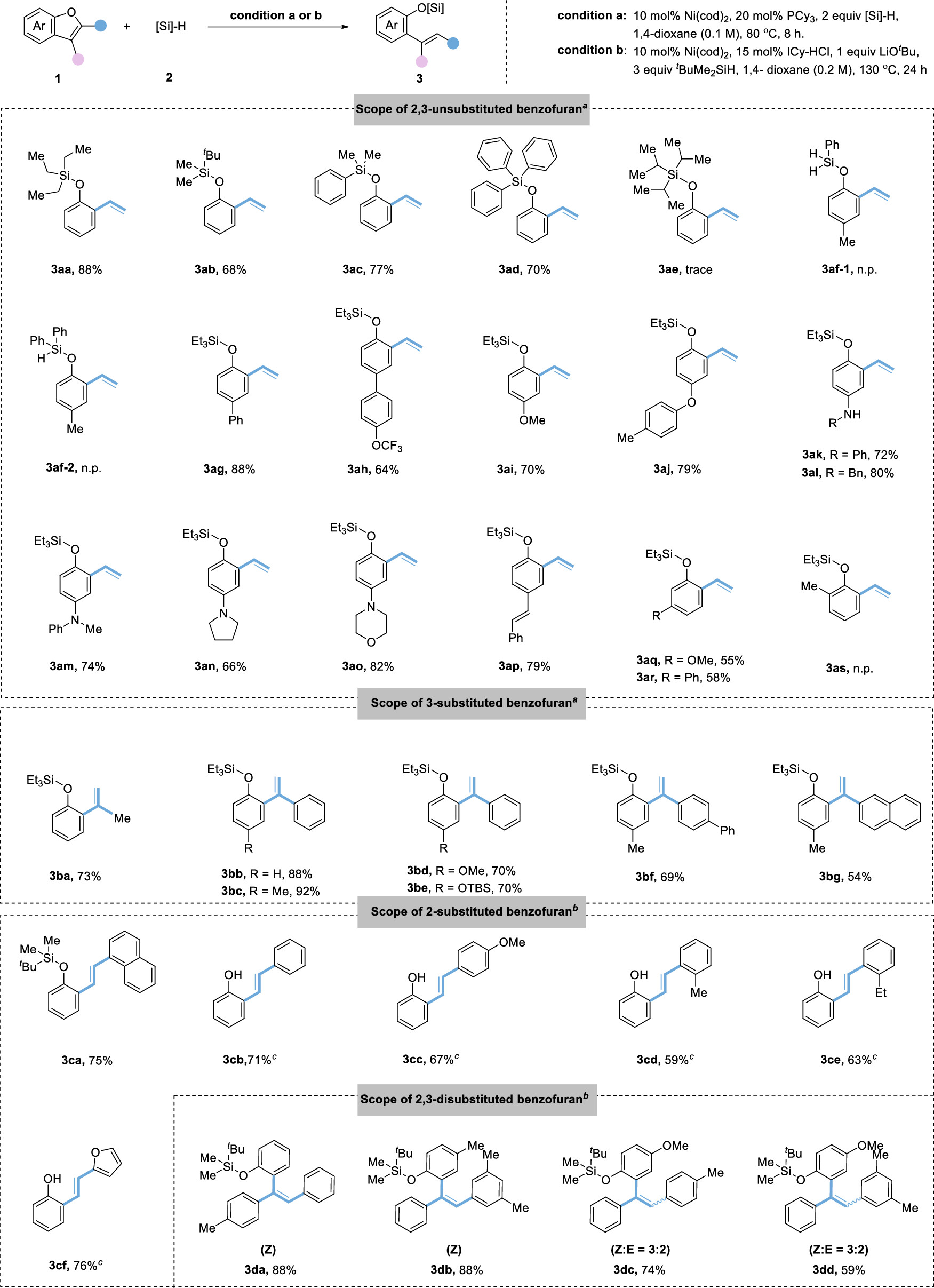
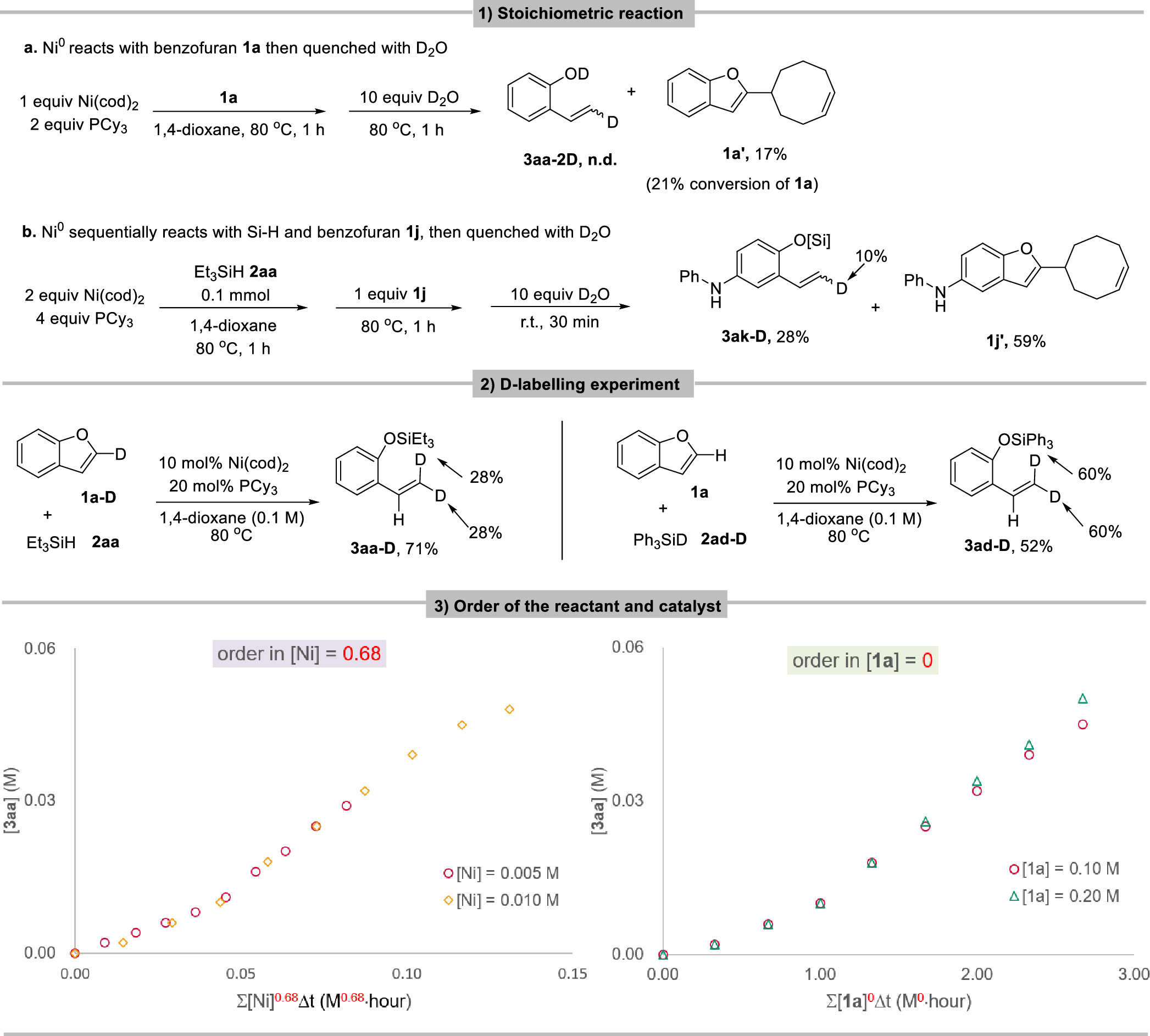
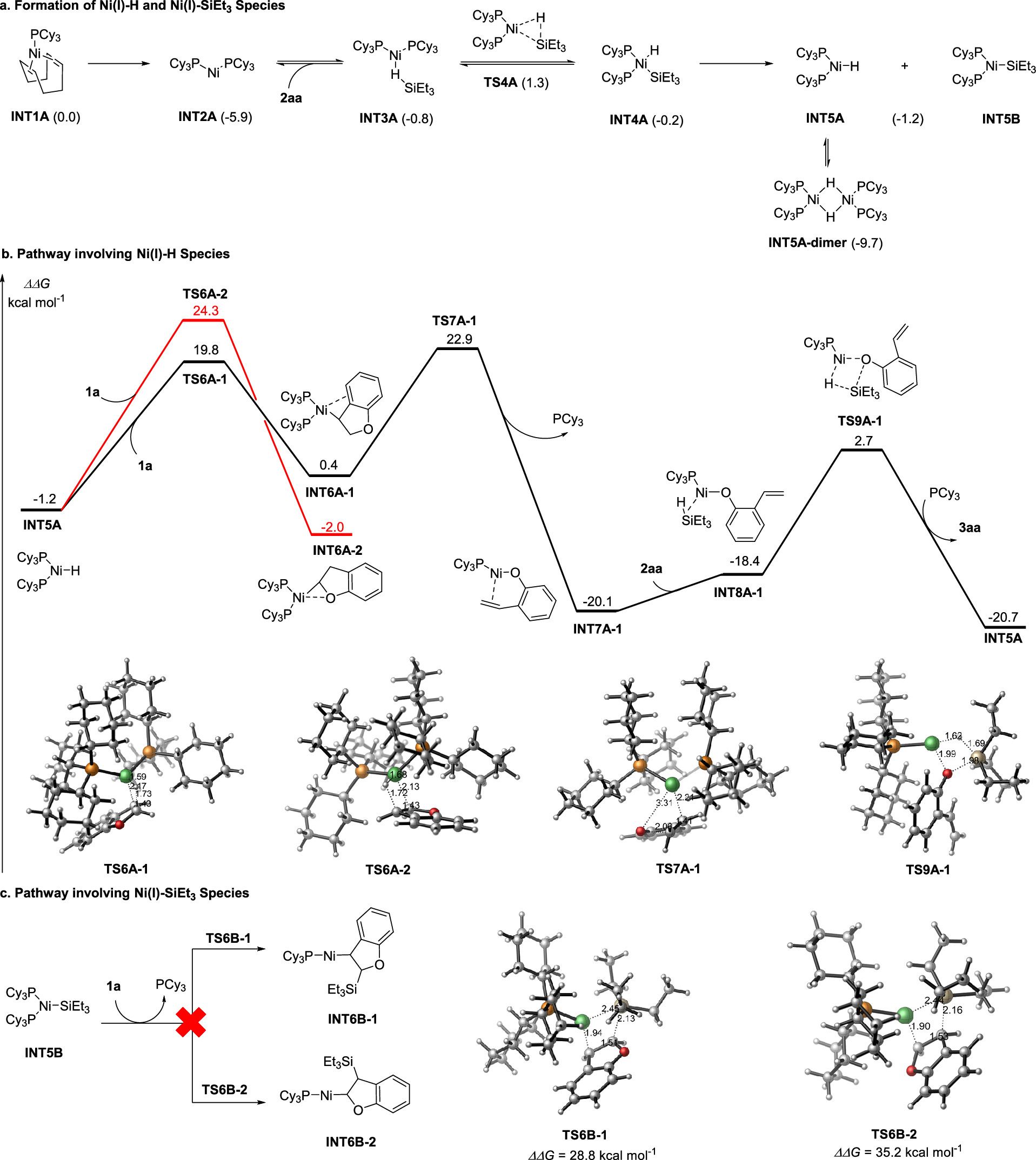
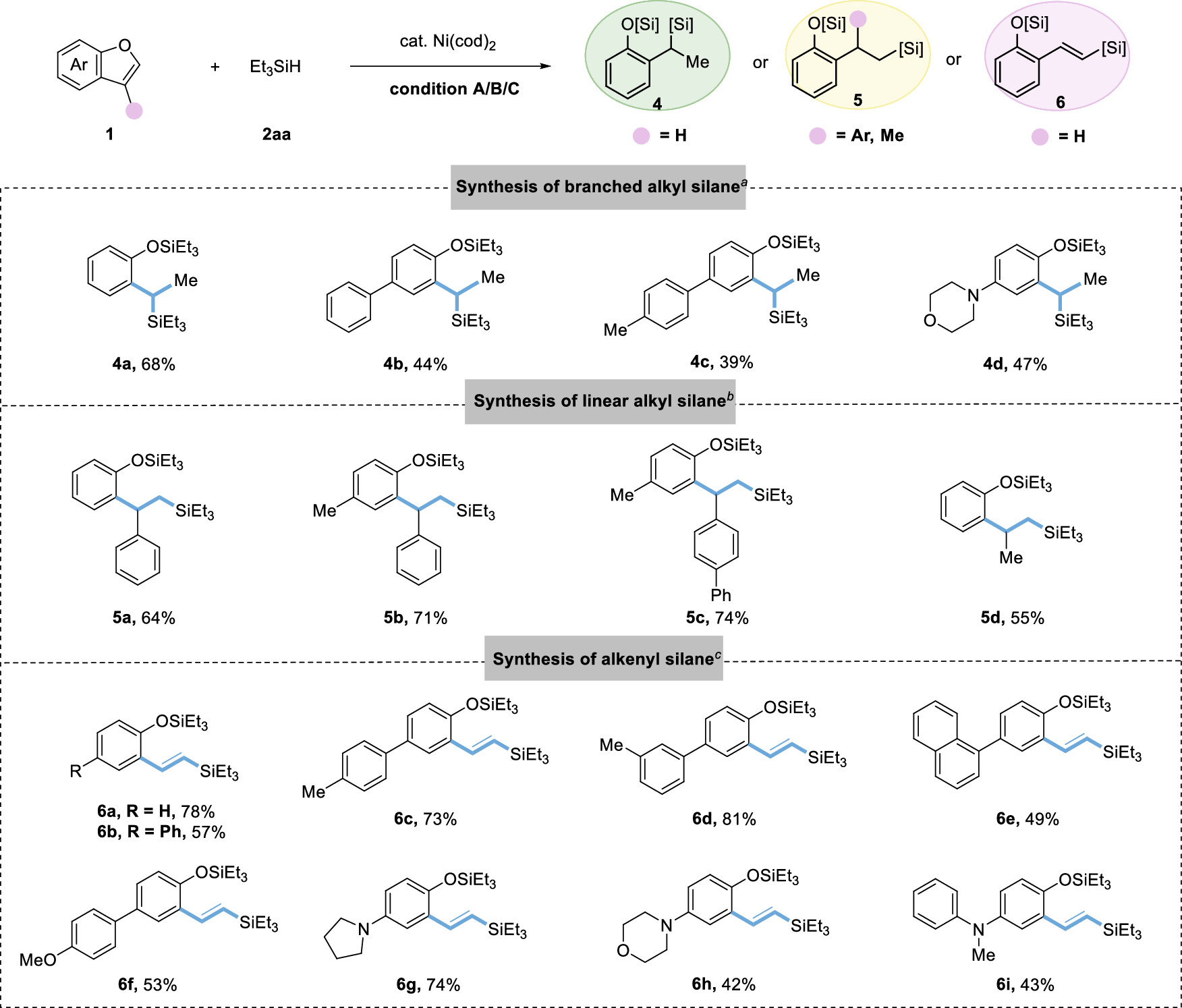
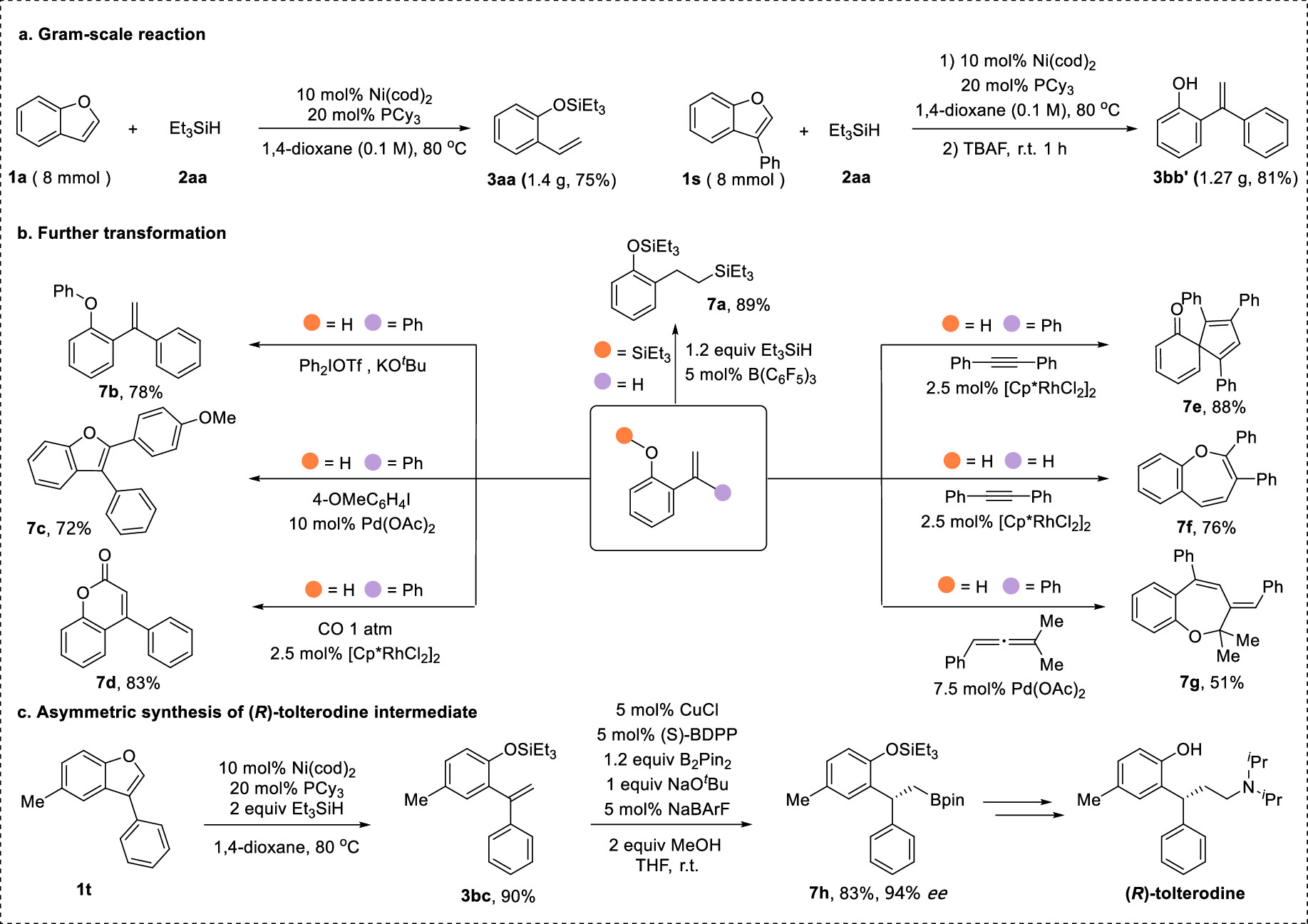
传统的苯酚衍生物,包括活化的磺酸盐、芳基羧酸盐、芳基醚,甚至不受保护的酚,被广泛用作亲电试剂;通过Csp2−O键的活化,在(还原)交叉偶联反应中用于构建各种碳-碳和碳-杂原子键。然而,这些转化总是产生化学计量的废物。苯并呋喃作为功能分子中的关键骨架,可以从各种简单的原料制备,只需一两步即可。苯并呋喃开环转化为构建邻烯基/烷基取代苯酚衍生物提供了一种高效且原子经济的策略。然而,由于其较高的C-O键强度,空间位阻,并芳香稳定,这种转化相对稀少,特别是2,3-二取代苯并呋喃。尽管取得了这些进展,但苯并呋喃的直接开环氢化的研究尚未取得进展。这主要是因为开环产物邻羟基苯乙烯中的末端C-C双键反应活性更高,极易发生过度还原。例如,游书力教授小组报道了一种温和的铜催化2,3-非取代苯并呋喃与硅烷的开环反应,然后进行对映选择性氢胺化反应,得到了手性N,N-二苄基氨基酚,且反应需要过量的苯并呋喃的底物。受到Martin、Chatani和Hartwig等课题组关于镍催化的C-O键活化的启发,作者认为这种策略可以应用于苯并呋喃的化学选择性开环氢化。基于此,本文报道了以硅烷为还原剂的镍催化苯并呋喃开环反应。 图1. 苯并呋喃开环 作者首先以苯并呋喃1a和三乙基硅烷2aa作为模板底物进行条件筛选,在最优条件下可获得94%产率的开环氢化产物3aa。另外,通过更换配体、硅烷及提高反应温度、浓度等,也可以使大位阻的底物2-萘基苯并呋喃开环,产率77%(图2)。 aReaction condition a: 1a/1za (0.1 mmol), Et3SiH (23.2 mg, 0.2 mmol), Ni(cod)2 (2.7 mg, 0.01 mmol), PCy3 (5.6 mg, 0.02 mmol) in 1 mL 1,4-dioxane at 80°C for 8 h under N2 atmosphere. bReaction condition b: 1za (0.1 mmol), tBuMe2SiH (34.8 mg, 0.3 mmol), Ni(cod)2 (2.7 mg, 0.01 mmol), ICy-HCl (4.0 mg, 0.015 mmol), LiOtBu (0.1 mmol) in 0.5 mL 1,4-dioxane at 130°C for 24 h under N2 atmosphere. cGC yield with n-dodecane as an internal standard. d20 mol % LiOtBu was added. 图2. 条件优化 苯并呋喃开环氢化反应的底物范围广泛,对于其他三级硅烷也能有良好的收率。值得注意的是,大位阻底物2,3-取代的苯并呋喃也可以实现开环反应(图3)。 图3. 苯并呋喃开环氢化的底物范围 为了进一步了解反应机理,作者进行了一系列控制实验,排除了Ni(0)对苯并呋喃的C-O键直接氧化加成,EPR实验证明了Ni(I)的存在,DFT计算表明是Ni(I)-H插入苯并呋喃再β-O消除来实现苯并呋喃开环转化(图4、5)。 图4. 控制实验和KIE实验 图5. DFT计算 由于Ni-H可以进一步迁移插入到氢化开环产物的烯烃中,作者认为烯烃的硅氢化反应可以与苯并呋喃氢化开环反应相结合。这种转化的关键挑战之一是控制镍催化支链氢硅化、直链氢硅化和脱氢硅化反应的化学选择性。作者经过细致的条件优化,可以实现2,3-未取代苯并呋喃的开环支链氢硅化反应,生成所需的支链烷基硅烷苯酚衍生物。有趣的是,对于3-芳基/烷基取代的苯并呋喃,在SICy-HCl作为配体存在的条件下,这些转化选择性地提供了产率良好的邻位线性烷基硅烷苯酚衍生物。此外,在10 mol% Ni(cod)2、20 mol% PCy3和3当量的1-辛烯作为氢受体的作用下,可以实现2,3-未取代苯并呋喃的开环脱氢硅化合成所需的乙烯基硅烷(图6)。 图6. 苯并呋喃开环进一步串联反应的底物范围 克级反应和产物衍生化证明了该方法的实用性(图7)。 图7. 克级反应以及衍生化 研究总结 总之,该团队开发了一种高效、稳定的苯并呋喃的镍催化开环反应,简化了一系列邻位功能化苯酚衍生物的制备。该方法底物范围广、条件温和、化学选择性好。DFT计算和动力学实验表明,苯并呋喃的C-O活化是通过插入Ni-H和消除β-O来实现的。进一步对苯并呋喃进行级联开环转化,可得到支链/直链烷基硅烷和烯基硅烷取代苯酚衍生物。 该工作以“Nickel-Catalyzed Ring-Opening of Benzofurans for the Divergent Synthesis of ortho-Functionalized Phenol Derivatives”为题发表在《ACS Catalysis》上。文章第一作者为华南理工大学博士后吕昌辉和硕士研究生林跃萍,通讯作者为华南理工大学黄良斌教授和南京大学王敏燕教授。 该研究工作得到了制浆造纸工程国家重点实验室(2020C02)、国家自然科学基金(Nos. 21971074、22001076)、广东省自然科学基金(Nos.A1515010006、2021A1515010159)、中央高校基本科研业务费专项资金(Nos.JQ04、2020ZYGXZR035)的资助。 文章链接:https://pubs.acs.org/doi/10.1021/acscatal.2c04442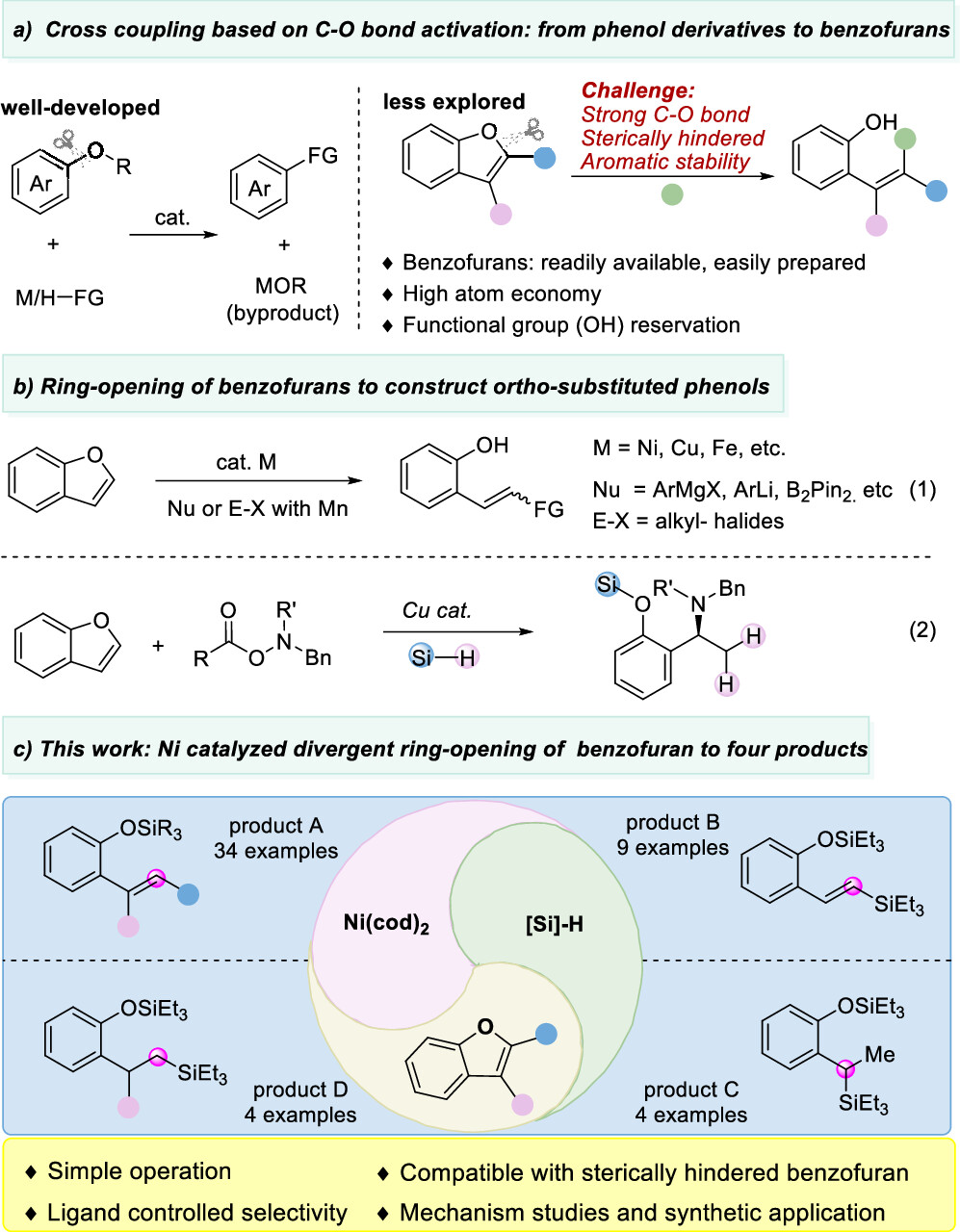
作者简介
黄良斌,华南理工大学制浆造纸工程国家重点实验室科研骨干,现任华南理工大学化学与化工学院教授、博士生导师。2004年进入北京化工大学生命科学与技术学院学习,2008年获制药工程学士学位。同年加入华南理工大学江焕峰教授课题组,2013年获得应用化学博士学位。随后获得德国洪堡奖学金的资助,加入德国凯泽斯劳腾理工大学Lukas Goossen教授课题组从事博士后研究。2016年4月至2018年10月分别在美国罗切斯特大学和威斯康辛大学-麦迪逊分校Daniel Weix课题组担任助理研究员职务。2018年11月加入华南理工大学开始独立科研工作,主要研究方向为新型催化体系设计及其在绿色合成中的应用、生物质高效催化转化的应用。主持或参与国家级、省部级项目多项,相关研究成果获教育部自然科学一等奖(2019,第二完成人)等。曾获教育部学术新人奖(2010)、广东省优秀博士论文(2014)、德国洪堡奖学金(2014)、广东省青年拔尖人才计划(2019)等。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn