

(图片来源:J. Am. Chem. Soc.)
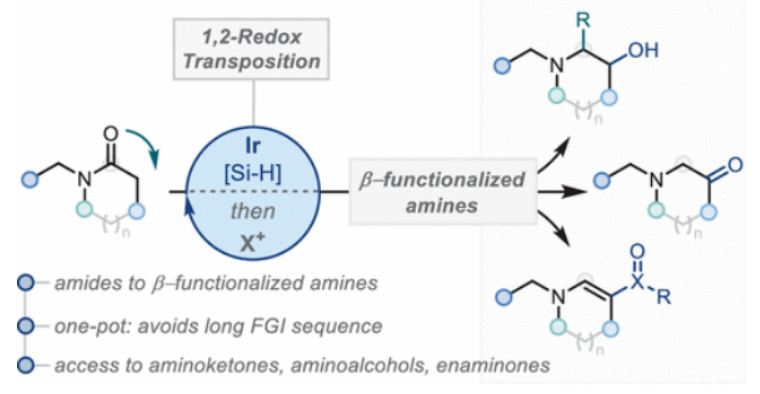
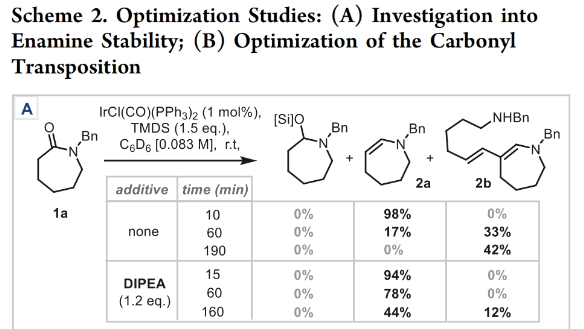
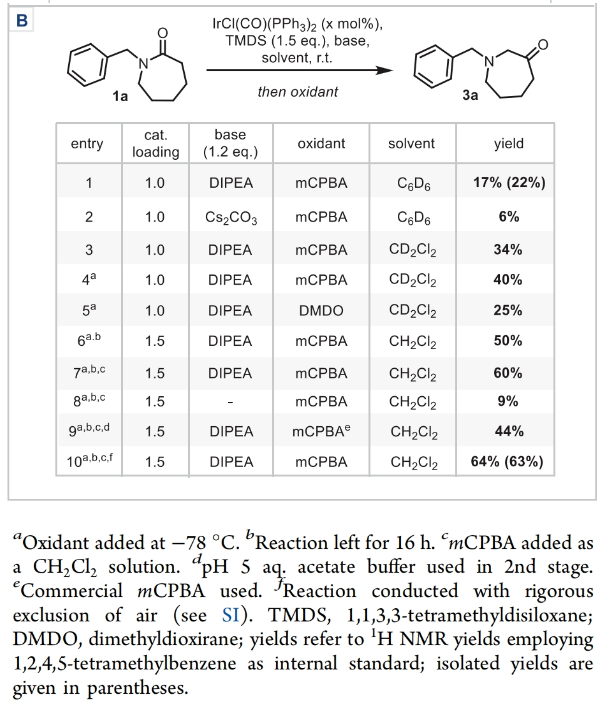
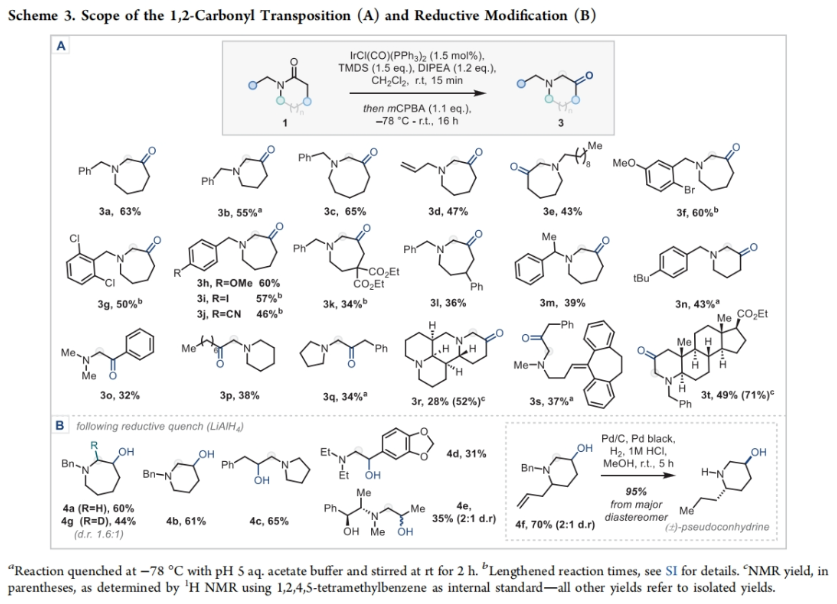
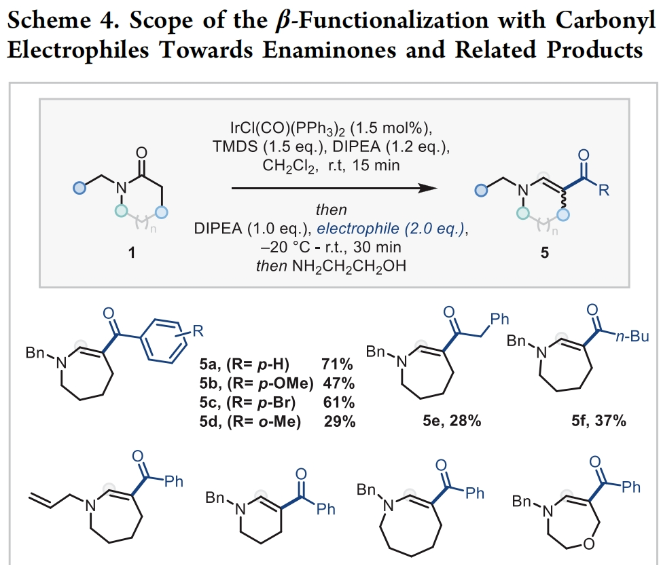
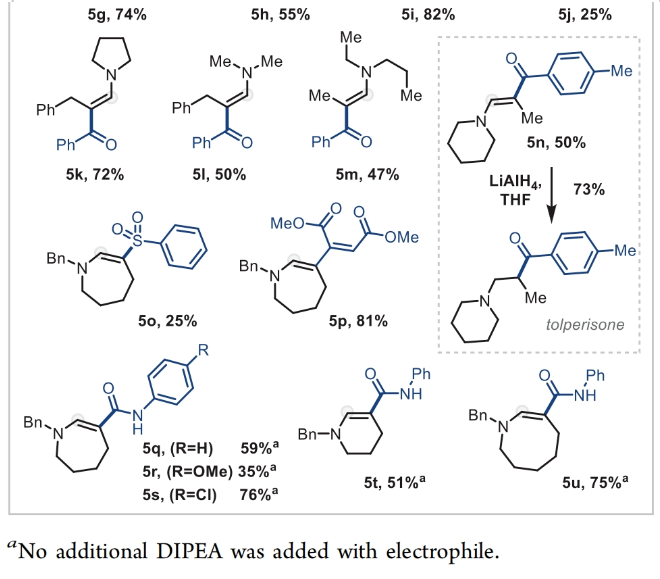
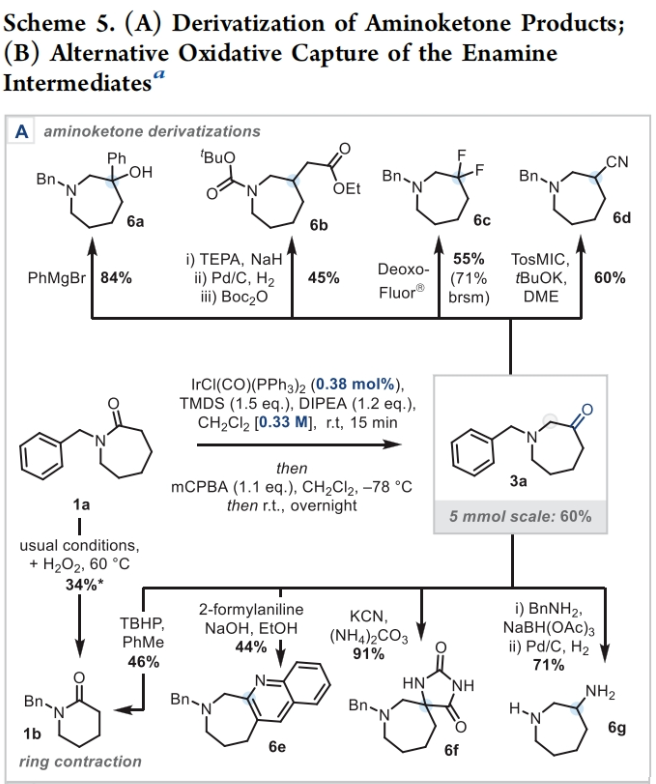
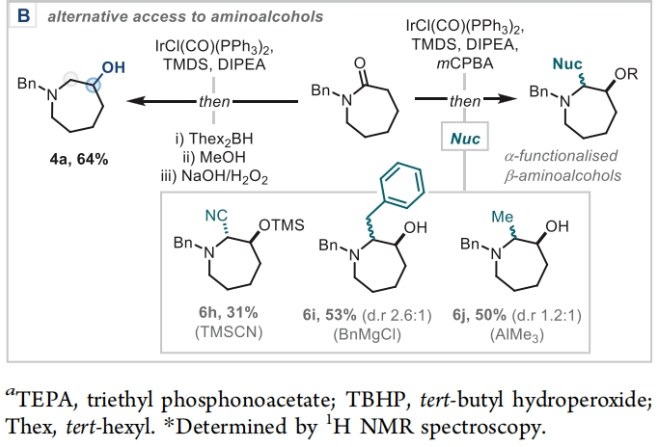
正文 能够改变相邻碳原子氧化水平的反应可以迅速从根本上来改变分子的反应性。基于β-官能化胺类化合物的重要性,使用酰胺作为起始原料,通过烯胺中间体直接实现β-官能化胺类化合物的合成具有重要的应用价值。最近,英国牛津大学Darren J. Dixon课题组报道了环状和非环状三级酰胺的羰基1,2-换位,从而一锅法实现了1,2-和1,3氧合叔胺的合成。此外,合成出的β-官能化胺类化合物可以通过一系列合成转化实现具有挑战性的生物相关骨架的构建(Scheme 1)。 (图片来源:J. Am. Chem. Soc.) 获得此种反应性的关键是建立可靠的形成稳定烯胺中间体的反应条件,以实现非环状酰胺和内酰胺底物的兼容。为了实现这一目标,作者选择N-苄基己内酰胺1作为模板底物进行反应探索。通过一系列反应参数优化,作者得出当使用1 (1.0 equiv), [IrCl(CO)(PPh3)2 (1.0 mol%), TMDS(tetramethyldisiloxane),(1.5 equiv), DIPEA (1.2 equiv), 在CH2Cl2中室温反应15分钟。随后加入mCPBA(1.1 equiv),在-78 oC反应16小时可以以63%的分离产率得到目标1,2-羰基换位产物3。其中,DIPEA的使用对形成稳定烯胺中间体至关重要(Scheme 2)。 (图片来源:J. Am. Chem. Soc.) 在得到了最优反应条件后,作者对此1,2-羰基换位反应的底物范围进行了探索(Scheme 3)。实验结果表明一系列不同环尺寸(6-8元环)的内酰胺均具有良好的兼容性,以34-65%的产率得到相应的1,2-羰基换位产物3a-3n。高兴的是,对于非环酰胺同样可以参与转化,以32-38%的产率得到相应的α-氨基酮产物3o-3q。值得注意的是,此体系对一系列复杂天然产物和药物活性分子衍生物仍具有良好的普适性(3r-3t,28-49%),证明了此转化的实用性。遗憾的是,在目前的反应条件下,一级酰胺和二级酰胺不能兼容,且N-芳基酰胺的反应性较差(Scheme 3A)。 有趣的是,稍微对反应条件进行改变,当在体系中加入还原剂LiAlH4淬灭时,可以通过对假定的β-羟基亚胺离子进行还原,从而得到β-氨基醇产物。例如,当底物1a经历Ir-还原/mCPBA-氧化后,在体系中加入LiAlH4(4 equiv),可以以60%的产率得到β-氨基醇产物4a。此外,当使用NaBH4的甲醇溶液替代LiAlH4可以以同样的产率得到产物4a。在此体系下,一系列内酰胺和酰胺均可顺利实现转化,以31-95%的产率得到相应的β-氨基醇产物4a-4f(Scheme 3B)。 (图片来源:J. Am. Chem. Soc.) 接下来,为了进一步开发此1,2-换位策略的应用并研究其构建C-C键的潜力,作者利用酰氯作为亲电偶联配偶体来实现α,β-不饱和β-氨基酮的合成,从而获得具有较高价值的1,3-氧合胺类骨架(Scheme 4)。当作者使用烯胺2a与苯甲酰氯反应后,通过氯化铵水溶液淬灭可以以71%的分离产率得到目标烯胺酮产物5a。一系列不同环尺寸的内酰胺和不同的氮取代基均可兼容,以25-82%的产率得到相应的环烯胺酮产物5a,5g-5j。此外,非环状酰胺也可实现此转化,以47-72%的产率得到产物5k-5m。接下来,作者对酰氯的底物范围进行了考察(5b-5f, 28-61%)。整体来讲,对位取代的芳酰氯与邻位取代的芳酰氯和烷基酰氯相比产物较低。除此之外,芳基异氰酸酯(5q-5u)、苯磺酰氯(5o)以及丁炔二酸二甲酯(5p)均可顺利参与反应,以35-81%的产率得到相应的产物5o-5u。值得注意的是,烯胺酮产物5n经LiAlH4还原后(73%),可转化为肌肉松弛剂托哌立酮(tolperisone)。 (图片来源:J. Am. Chem. Soc.) 最后,为了证明产物的实用性,作者进行了一系列衍生化实验(Scheme 5)。首先,作者利用1a作为起始原料,将反应放大至5.0 mmol规模并降低铱催化剂用量为0.38 mol%时,仍可以以60%的产率得到产物3a(Scheme 5A)。随后,作者使用3a与苯基格氏试剂反应以及通过Horner-Wadsworth-Emmons反应可以分别以84%和45%的产率得到β-氨基醇产物6a和γ-氨基酯产物6b。此外,产物3a中的氨基酮骨架还可以通过脱氧氟化以55%的产率得到β-二氟胺产物6c;通过Van Leusen反应以60%的产率得到β-胺基腈产物6d;通过Bucherer-Bergs环化以91%的产率得到螺环乙内酰脲产物6f;通过还原胺化/氢化以71%的产率得到具有较高应用价值的2-氨基吖庚因产物6g;通过Fried-länder喹啉合成反应可以以44%的产率得到三环产物6e。 接下来,为了进一步探索这种1,2-氧化还原换位方法的用途,作者使用一系列亲核试剂来捕获假定的中间β-羟基亚胺离子中间体(Scheme 5B)。在标准条件下,向体系中分别加入TMSCN、BnMgCl以及AlMe3,可以分别得到β-硅氧基-α-氨基腈6h(31%)和β-氨基醇6i(53%),6j(50%)。最后,作者受到Brown和Singaram工作的启发,使用铱催化的还原/硼氢化/氧化以64%的产率得到氨基醇产物4a。 (图片来源:J. Am. Chem. Soc.) 总结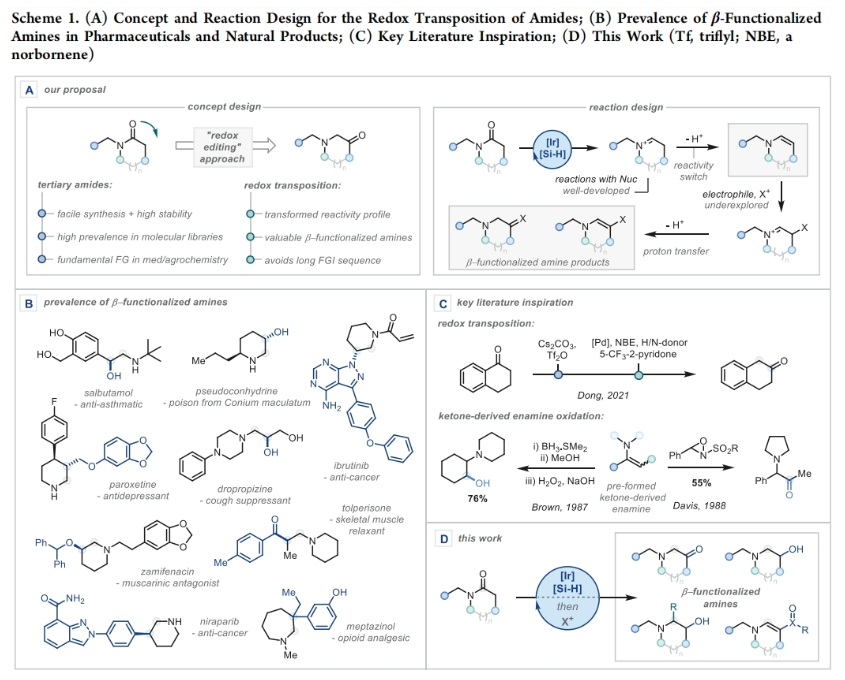
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn