

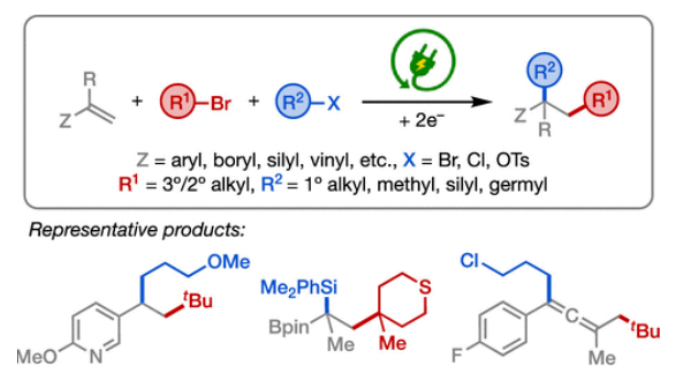
(图片来源:J. Am. Chem. Soc.)
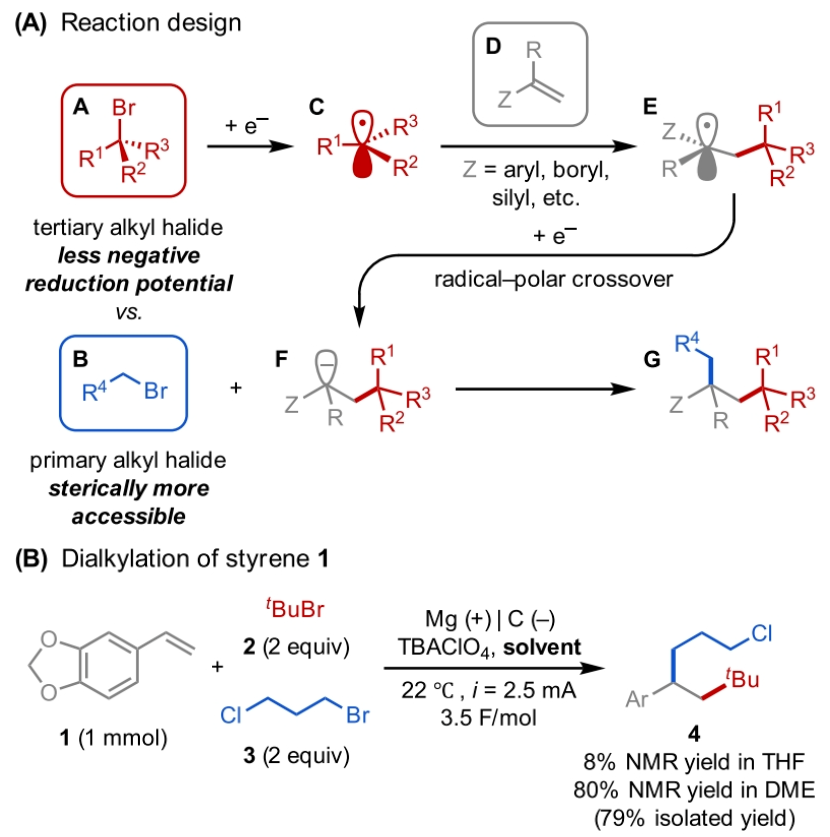
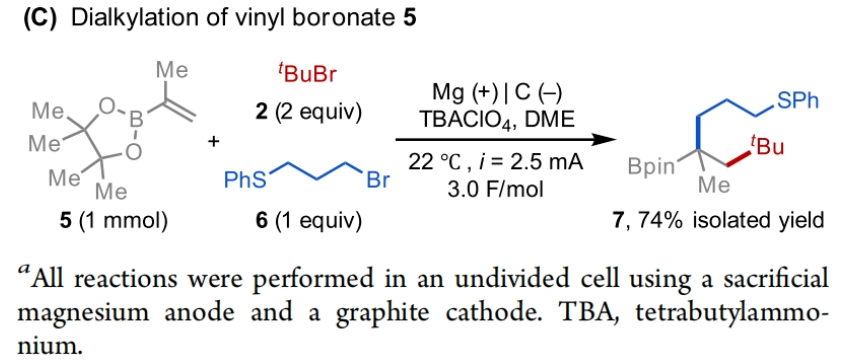
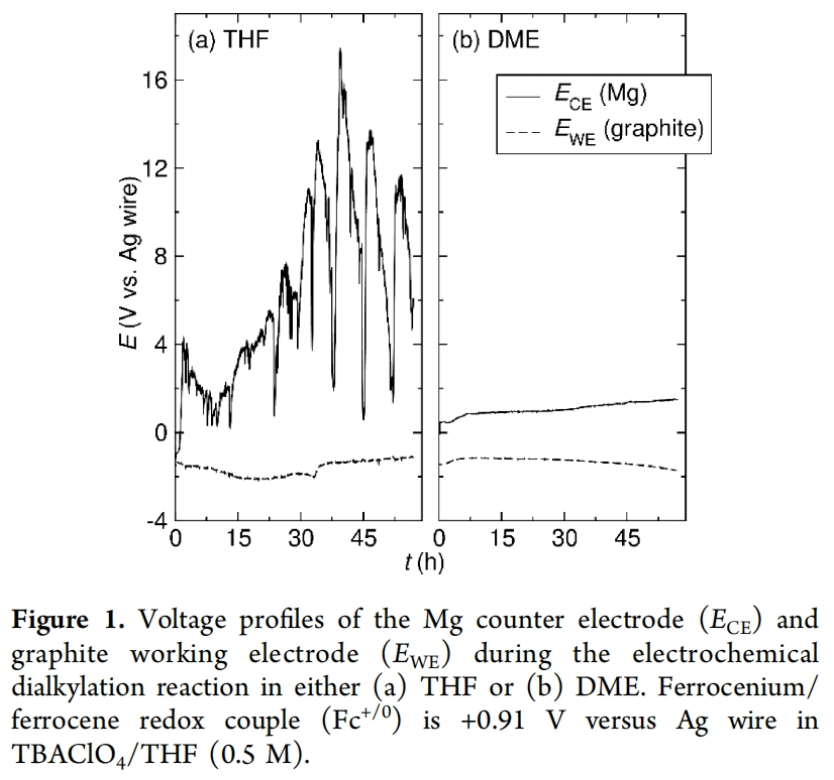
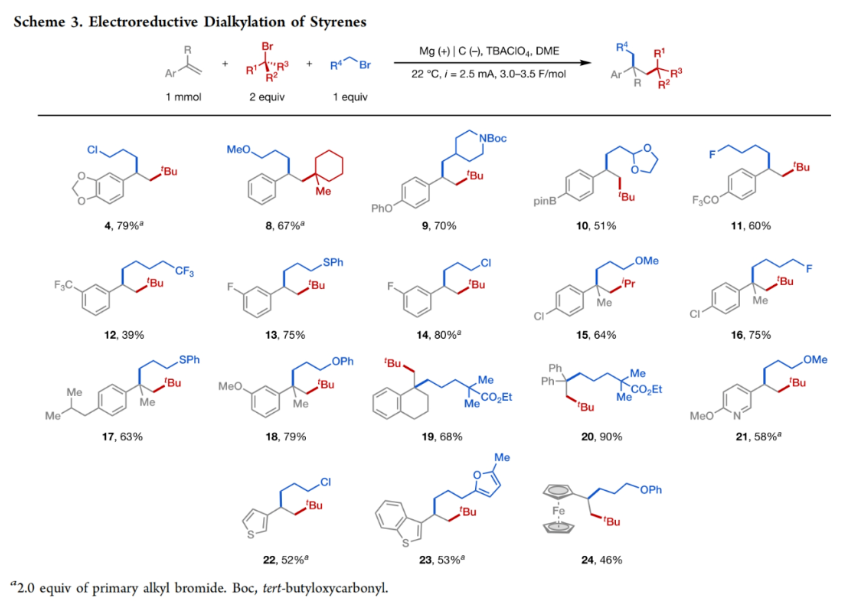
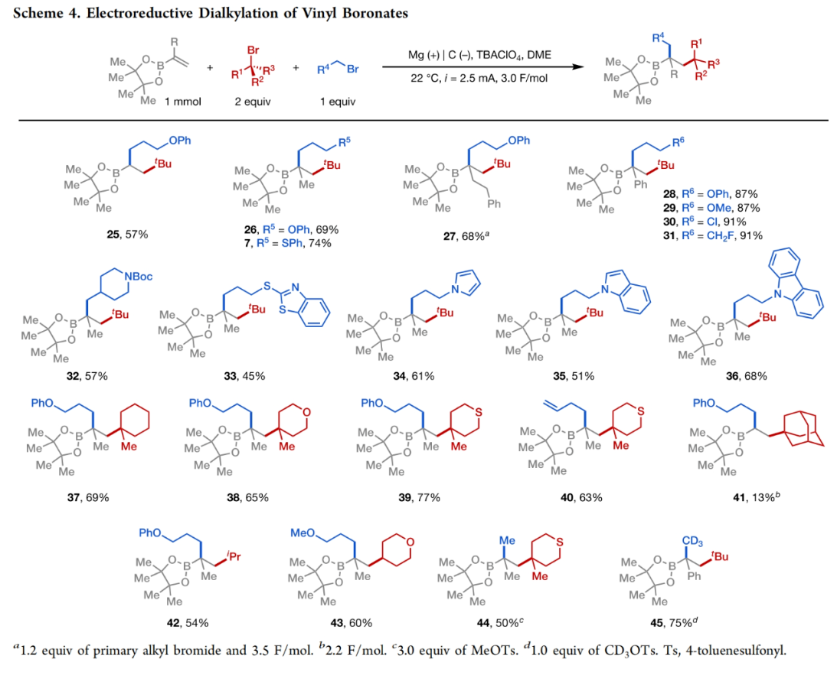
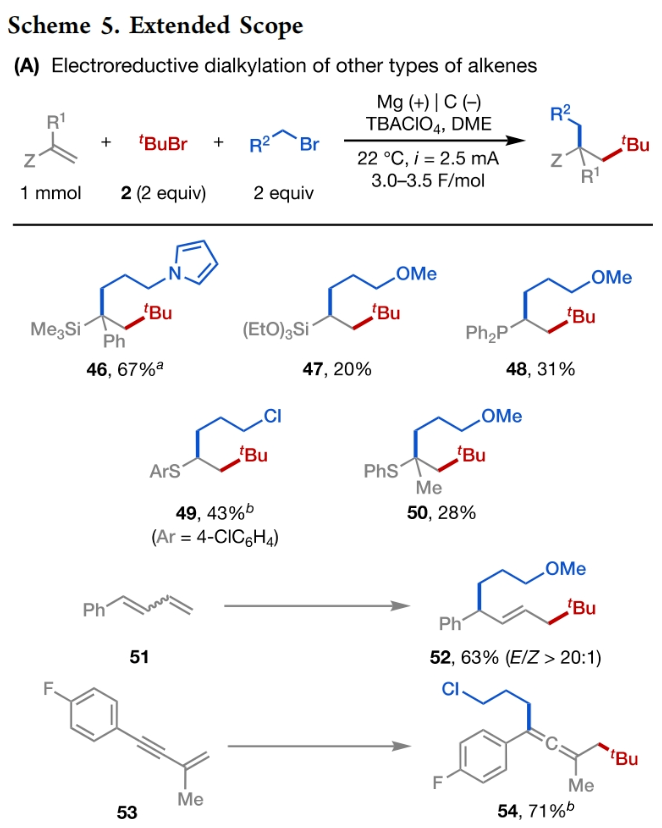
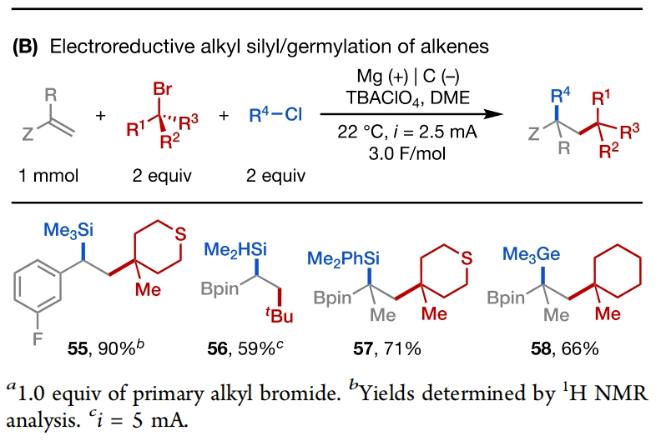
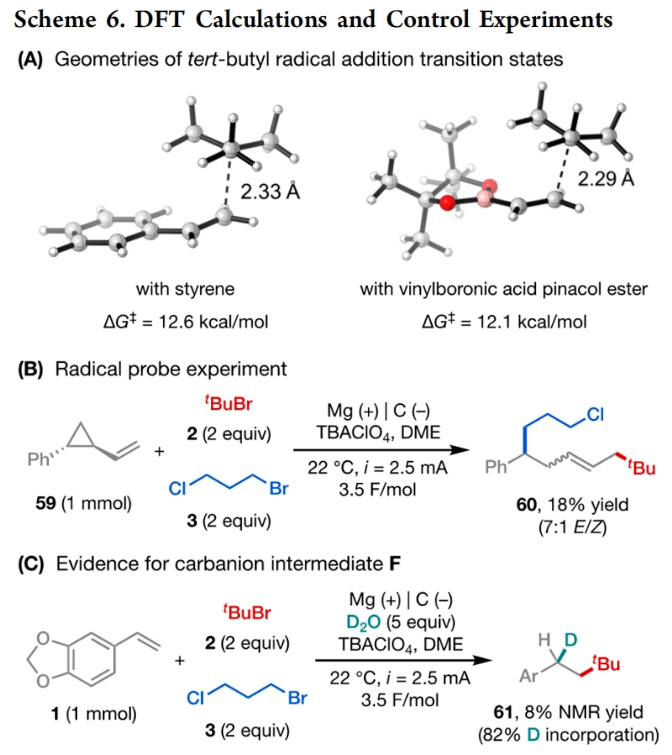
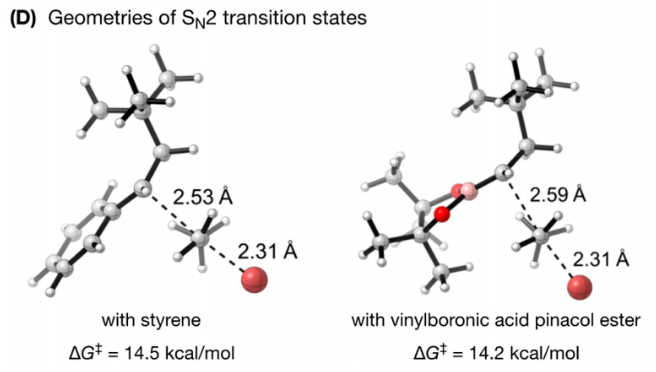
正文 发展构建C(sp3)-C(sp3)键的新方法是现代有机合成的一个突出目标之一。在这方面,烯烃的双烷基化是一种特别方便的模块化策略,其可以在一步操作中构建两根新的C(sp3)-C(sp3)键,从而迅速增加简单易得的烯烃原料的分子复杂性。在过去几十年里,这一领域取得了重大进展。此类反应通常使用烷基亲电试剂和烷基有机金属试剂以氧化还原中性的方式进行,并且通常还需要过渡金属催化剂的参与和烯烃上导向基团的辅助(Scheme 1A)。然而,由于此类反应对有机金属试剂(如有机锂、镁和锌络合物)的依赖,因此限制了该方法的官能团相兼容性和更广泛的适用性。 近些年,使用两种亲电试剂来实现烯烃的双烷基化,即还原双烷基化过程逐渐被报道。例如,Koh和舒伟课题组发展了镍催化,导向基团协助的烯烃与烷基卤化物和脂肪族氧化还原活性酯的双烷基化(Scheme 1B)。此外,傅尧课题组实现了镍催化,非导向的烯基硼酸酯与三级和一级卤代烃的双烷基化(Scheme 1C)。虽然此领域已经取得了一定的进展,但对镍催化剂的依赖则使得底物范围具有一定的局限性。此外,虽然导向基团的存在可以有效抑制β-H消除过程的发生,但由于叔烷基镍中间体的空间位阻,使得利用1,1-二取代烯烃构建季碳中心具有一定的挑战性。 基于上述局限性,最近,美国康奈尔大学(Cornell University)林松课题组利用不同取代的烷基卤化物的电性和空间位阻,在电化学条件下实现选择性活化从而能够实现对烯烃的区域选择性加成。此方法可以在不使用过渡金属催化剂的情况下实现烯烃的区域选择性双烷基化,为一系列具有重要用途的化合物的合成提供了新的途径(Scheme 1D)。 (图片来源:J. Am. Chem. Soc.) 近期,林松课题组报道了电催化非活化烷基亲电试剂的还原交叉亲电偶联反应(XEC)(Nature, 2022, 604, 292)。值得注意的是,反应中烷基卤化物的取代程度不同则展现出不同的反应活性。基于此,作者设想是否可以利用此策略实现烯烃的电还原双烷基化反应(Scheme 2A)。 首先,作者选用苯乙烯1,叔丁基溴2和1-溴-3-氯丙烷3作为模板底物,使用之前所发展的电还原XEC最优条件对反应进行探索(Scheme 2B)。当在THF中电解后,可以消耗95%以上的原料1,但仅以8%的收率获得了所需的产物4。作者认为4的产率较低主要由于Mg阳极的严重钝化所引起,这导致阳极电位迅速上升和不稳定,以此来补偿不断增加的电极电阻(Figure 1a)。而在二甲醚(DME)中反应时钝化层的厚度显著降低,即可在整个电解过程中保持低且稳定的电极电位(Figure 1b)。因此,当使用DME作溶剂时,分别使用2 equiv烷基溴作亲电试剂可以以79%的分离产率得到产物4。此外,当作者使用烯基硼酯5反应时,可以以74%的产率实现多取代烷基硼酯7的合成。而烷基硼酯可以作为重要的合成中间体实现多样的转化(Scheme 2C)。值得注意的是,产物4和7的形成均具有良好的化学选择性,且作者并没有观察到另一种区域异构体的形成。 (图片来源:J. Am. Chem. Soc.) 接下来,作者对此转化中取代的苯乙烯和烷基卤化物的底物范围进行了考察(Scheme 3)。实验结果表明一系列不同电性取代的苯乙烯和非活化烷基卤化物均具有良好的兼容性,以39-90%的产率,良好的区域选择性得到相应的双烷基化产物4-24。其中,氨基甲酸酯、缩醛、三氟甲基、硫醚、酯、二茂铁、卤素、三氟甲氧基、吡啶、噻吩等一系列基团均可顺利兼容。此外,当作者使用烯基硼酯作为起始原料时,可以以13-77%的产率得到相应的三级烷基硼酯产物25-45(Scheme 4)。而这些烷基硼酯产物可以利用已知的转化实现多种不同结构骨架的构建。其中,药物中常见的氮杂环骨架,如哌啶(32),苯并噻唑(33),吡咯(34),吲哚(35)和咔唑(36)均可兼容。值得注意的是,高烯丙基溴也可以兼容体系(40),且烯烃部分在反应中完好无损。接下来,作者对其它类型烯烃的适用性进行了考察(Scheme 5A)。实验结果表明,烯基硅(46, 47)、烯基磷(48)和烯基硫 (49, 50)均可以较高的区域选择性实现转化,以20-67%的产率得到产物46-50。此外,当使用共轭二烯烃51反应时,可以63%的产率得到1,4-双烷基化产物52(E/Z > 20:1)。类似的,当使用烯炔底物53反应时,反应可以经历1,4-加成以71%的产率得到联烯类产物54。值得注意的是,当使用氯硅烷(55-57)或氯锗烷(58)作为亲电试剂时,还可以有效实现烯烃的烷基-硅基/锗基化,以66-90%的产率得到相应的产物55-58(Scheme 5B)。 (图片来源:J. Am. Chem. Soc.) 最后,为了深入理解反应机理,作者进行了DFT计算和控制实验(Scheme 6),并得出如下结论:1)CV(cyclic voltammetry)实验表明三级烷基溴通常比一级烷基溴更容易还原;2)环丙基开环实验证明了反应中涉及自由基中间体;3)同位素标记实验证明了碳负离子中间体的存在;4)碳负离子与与一级烷基溴的取代反应能垒较低。 (图片来源:J. Am. Chem. Soc.) 总结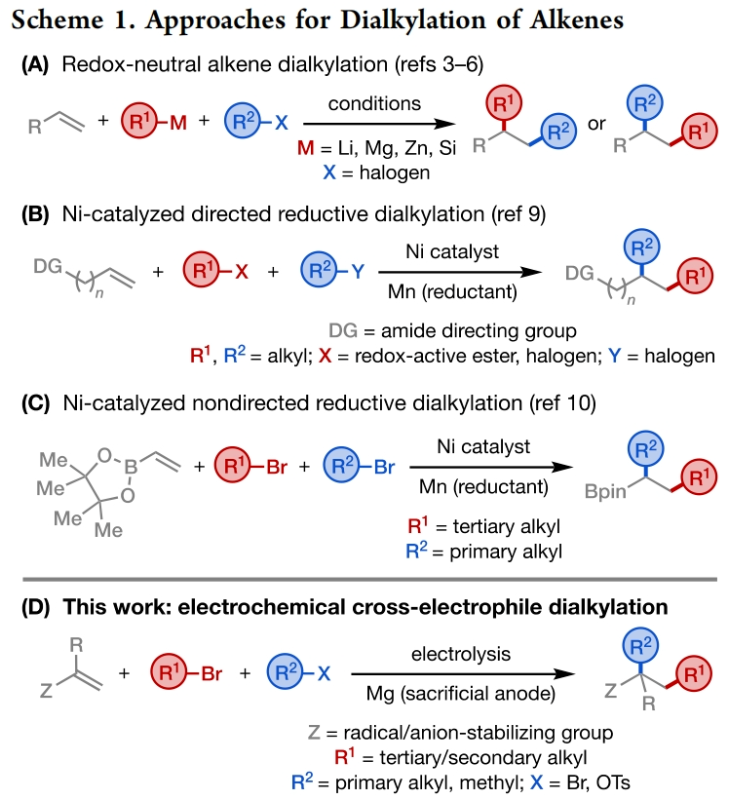
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn