

(图片来源:J. Am. Chem. Soc.)
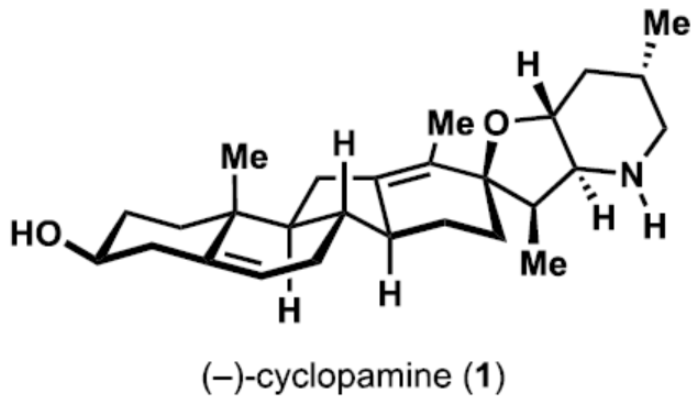
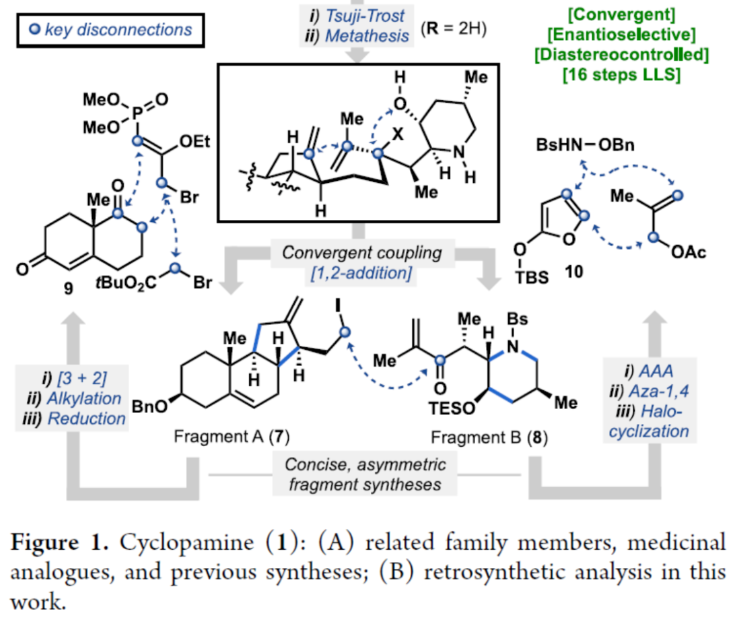
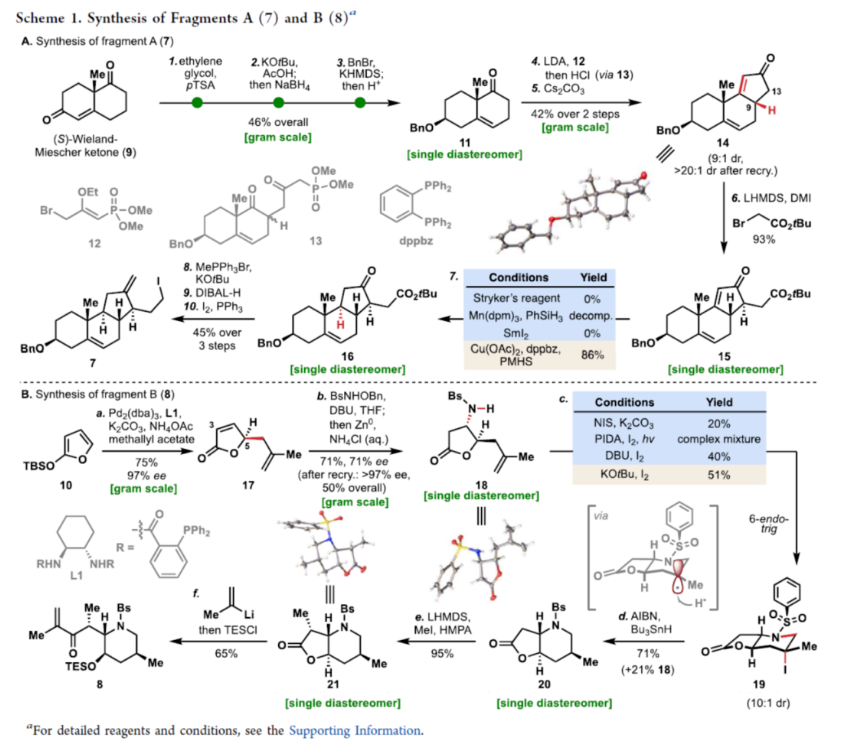
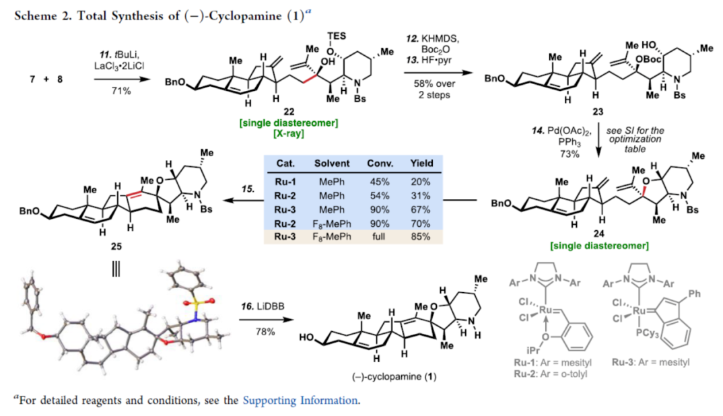
正文 Cyclopamine(1),首次从加州藜芦(Veratrum californicum)(California corn lily)中分离出来,是Veratrum生物碱家族的一个著名成员(Figure 1A)。Beachy等人的研究表明,Cyclopamine是高度保守的刺猬信号通路(hedgehog signaling pathway)的有效抑制剂,这对胚胎的正确分化和对称发育至关重要。尽管Cyclopamine的分解途径已知,可在酸性条件下产生Veratramine(3)或潜在的其它副产物,但Cyclopamine是一种很有前途的抗癌剂先导化合物,迄今为止已报道了许多药物类似物,最显著的是半合成制备的Saridegib(4)。 Veratrum生物碱的复杂结构多年来一直引起合成化学家的兴趣。关于Cyclopamine,罕见的C-nor-D-homo甾体骨架因完全取代的螺环THF单元、独特的trans-6,5-EF环系以及中心四取代烯烃而进一步复杂化,所有这些都对其合成提出了独特的挑战。1967年,Masamune课题组(J. Am. Chem. Soc. 1967, 89, 4521.)以高级中间体6为底物,经18步反应制备了Jervine(2),但对于高级中间体6需通过Hagemann’s酯或Hecogenin的降解中获得,涉及25步反应。2009年,Giannis课题组(Angew. Chem. Int. Ed. 2009, 48, 7911.)通过脱氢表雄酮(5)经20步反应,实现了Cyclopamine的半合成,其特征是仿生1,2-骨架重排以构建C-nor-D-homo甾体骨架。近日,美国斯克里普斯研究所Phil S. Baran课题组报道了一种Veratrum生物碱Cyclopamine(1)的简明和对映选择性全合成,最长线性步骤为16步。 通过逆合成分析发现(Figure 1B),Cyclopamine(1)可通过砌块22经Tsuji-Trost环化与关环复分解反应(RCM)反应制备。砌块22可由砌块7与砌块8经非对映选择性1,2-加成制备。砌块7可由(S)-Wieland-Miescher酮(9)经[3+2]、烷基化与还原反应制备。砌块8可由2-硅氧基呋喃经10经AAA、Aza-1,4与卤环化反应制备。 (图片来源:J. Am. Chem. Soc.) 砌块7的合成(Scheme 1A)。以(S)-Wieland-Miescher酮为底物,经烯酮异构化/缩醛保护还原反应,可以三步46%的总收率得到十氢萘中间体11。中间体11与膦酸酯试剂12在LDA/HCl条件下经烷基化/水解后,生成中间体13。中间体13可在Cs2CO3条件下经分子内Horner-Wadsworth-Emmons反应,可以两步42%的总收率得到中间体14,通过重结晶后可将非对映选择性提高至20:1以上。中间体14与溴乙酸叔丁酯在LHMDS/DMI条件下经烷基化反应,可以93%的收率得到中间体15,为单一非对映异构体。通过对反应条件的优化后发现,中间体15在Cu(OAc)2/dppbz/PMHS条件下进行1,4-还原反应,可以86%的收率得到中间体16,是单一非对映异构体。中间体16在MePPh3Br/KOtBu条件下进行Wittig烯化反应、在DIBAL-H条件下进行还原反应以及在I2/PPh3条件下进行Appel反应,可以三步45%的总收率得到碘化物中间体7。 砌块8的合成(Scheme 1B)。以硅氧基呋喃10与甲基烯丙基乙酸酯为底物,在Pd2(dba)3/L1/K2CO3/NH4OAc条件下经不对称烯丙基烷基化反应(AAA),可以75%的收率以及95% ee得到中间体17。通过对反应条件的优化后发现,中间体17与BsNHOBn在DBU条件下经aza-Michael反应以及在Zn0/NH4Cl条件下经N-O键断裂,可以71%的收率以及71% ee得到中间体18。中间体18通过进一步的重结晶,可将对映选择性提高至97%以上,收率为50%。通过对反应条件的优化,中间体18在KOtBu/I2条件下经6-endo-trig环化反应,可以51%的收率得到中间体19,dr为10:1。中间体19在AIBN/Bu3SnH经脱卤反应,可以71%的收率得到中间体20,是单一的非对映体。中间体20在LHMDS/MeI/HMPA条件下经甲基化反应,可以95%的收率得到中间体21,是单一的非对映体。中间体21与异丙烯基锂进行加成,并使用TESCl进行二级羟基的保护,可以65%的收率得到中间体8。 (图片来源:J. Am. Chem. Soc.) Cyclopamine(1)的全合成(Scheme 2)。砌块7与砌块8在tBuLi/ LaCl3·2LiCl条件下经1,2-区域选择性加成反应,可以71%的收率得到中间体22,是单一的非对映体。通过对反应条件的优化后发现,中间体22在KHMDS/Boc2O以及HF·pyr条件下分别进行羟基的保护基调整,可以两步58%的总收率得到中间体23。中间体23在Pd(OAc)2/PPh3条件下经Tsuji-Trost环化反应,可以73%的收率得到中间体24,是单一的非对映体。通过对反应条件的优化后发现,中间体24在Ru-3/F8-MePh条件下经RCM反应,可以85%的收率得到中间体25。中间体25在LiDBB(Lithium 4,4′-Di-tert-butylbiphenylide,Freeman试剂)条件下经脱保护反应,可以78%的收率得到Cyclopamine(1)。值得注意的是,化合物1在使用CD2Cl2进行NMR检测时,化合物1的不同浓度对于1H NMR和13CNMR的化学位移有显著影响。 (图片来源:J. Am. Chem. Soc.) 总结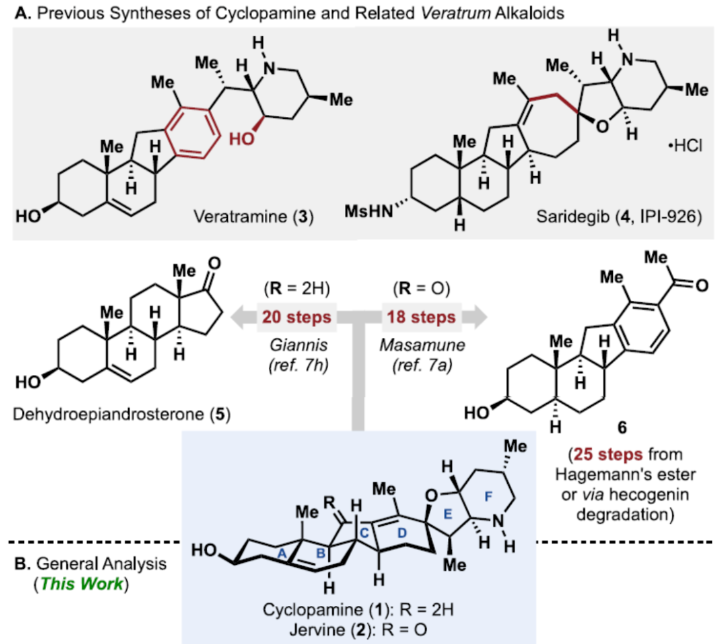
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn