

病毒蛋白酶是抗病毒药物研发的重要靶标,在新冠病毒出现之前,已有数十个HCV、HIV蛋白酶抑制剂先后获批上市,用于病毒感染治疗。因此,寻找新冠病毒3CL蛋白酶小分子抑制剂是抗新冠病毒药物研发的一个重要途径。新冠疫情初期,研究团队发现已上市可口服HCV蛋白酶抑制剂博赛泼维(boceprevir)能够抑制新冠病毒3CL蛋白酶活性(IC50 = 8596 nM),于是根据它与新冠病毒3CL蛋白酶的复合物晶体结构,对其P1’-P4基团系统开展了药物设计与优化工作(图1)。
根据博赛泼维与新冠病毒3CL蛋白酶的结合模式,研究人员以谷氨酰胺的常见模拟结构丁内酰胺替换疏水性的环丁烷,作为极性的P1基团以提高其与蛋白酶极性的S1位点的匹配度;为了与“氧阴离子空穴(oxyanion hole)”形成氢键相互作用,针对P1’基团探索了尺寸较小的α,β-不饱和酮、醛和氰基等包含N或O原子的共价弹头时的活性情况(图1)。GSH反应性测定发现以氰基为弹头的化合物2的共价反应活性最低(t1/2 = 962 min),且该化合物在Vero E6细胞上对新冠病毒复制的抑制活性(EC50)可高达319 nM。
随后,研究团队通过解析化合物2与新冠病毒3CL蛋白酶的复合物晶体结构,发现其P2基团未能充分占据疏水的S2位点,因而针对此位点尝试了更大的疏水基团,结果发现P2基团为二硫戊烷螺环取代的脯氨酸(dithiaspiro-proline)时,化合物7与蛋白酶的亲和力和抗病毒活性均有所提高(图1)。P3基团朝向溶剂区,与蛋白酶无明显相互作用,因而未对该基团进行结构优化(图1)。针对P4基团开展优化的过程中,最终发现引入三氟乙酰基的化合物9(SIM0417/SSD8432/simnotrelvir/先诺特韦)具有更强的3CL蛋白酶抑制活性(IC50 = 9 nM)及细胞水平对新冠病毒WIV04、Delta及Omicron毒株复制的抑制活性(EC50 = 26 nM、34 nM及43 nM)。
由于3CL蛋白酶在冠状病毒尤其是新冠病毒中高度保守,先诺特韦对目前已知的多个新冠病毒变异株的3CL蛋白酶,保持相同水平的抑制活性,提示其对新冠病毒的不同突变株具有广谱的抗病毒活性。先诺特韦对SARS-CoV和MERS-CoV等其它6种可感染人的冠状病毒3CL蛋白酶也有强抑制活性,提示其作为广谱的抗冠状病毒药物使用的潜力。进一步研究发现,先诺特韦联合利托那韦在小鼠和食蟹猴体内具有良好的口服药代性质,口服先诺特韦(200 mg/kg,BID)和利托那韦(50 mg/kg,BID)可有效抑制Delta毒株感染的转基因小鼠肺部和脑部的病毒复制,显著减轻病毒感染引起的肺部损伤,在损伤保护方面显著优于奈玛特韦(图2)。
先诺特韦具有良好的安全性。先诺特韦对6种人体蛋白酶、413种激酶、7个CYP酶及47个药品不良反应潜在靶点等均具有很好的选择性;体内外安全性评价试验中,未发现遗传学毒性。实验表明,先诺特韦在酶和细胞水平,以及动物体内抗病毒药效方面均与奈玛特韦相当,但先诺特韦显示了较好的血脑屏障穿透能力,在更低的给药剂量下(50 mg/kg)即可完全清除小鼠脑部病毒。已有大量研究表明,新冠病毒会造成海马体损伤,引起味觉、嗅觉障碍等中枢神经损伤,先诺特韦在脑部病毒清除的优势,提示其可在人体上实现更好的脑部损伤保护作用。
值得一提的是,这是第一次将含有二硫戊烷螺环取代的脯氨酸基团(即P2基团)用于蛋白酶抑制剂的研发,且该基团在上市药物中非常罕见,因此先诺特韦的研发为该结构片段用于新药创制提供了一个成功范例。复合物晶体结构显示,相比于奈玛特韦的P2基团,先诺特韦的P2基团体积更大,与3CL蛋白酶形成了更多的相互作用,热力学研究也发现先诺特韦与新冠病毒3CL蛋白酶的结合焓优于奈玛特韦(图3)
2021年11月,上海药物所、武汉病毒所与先声药业达成合作,全速推进先诺特韦的后续研发工作。2023年1月29日,先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)获得国家药监局附条件批准上市,用于轻中度成年患者新冠病毒感染的治疗,成为国内首款上市的口服3CL蛋白酶抑制剂(图4)。目前,先诺欣®已覆盖全国32个省、306个市及超2500家医疗机构,以每月数百万人份的药品的可及能力,为新冠病毒常态化防控提供重要保障。
上海药物所许叶春研究员、沈敬山研究员、武汉病毒所张磊砢研究员以及先声药业唐任宏博士为本研究论文的共同通讯作者。上海药物所蒋翔锐研究员、苏海霞副研究员、张岩助理研究员、赵文峰博士、武汉病毒所尚卫娟实验师及先声药业周峰博士为本研究论文的共同第一作者。该研究工作得到了上海药物所药物安全评价研究中心和药物代谢研究中心、上海同步辐射光源的支持及国家自然基金、上海市科委、上海药物所、武汉病毒所和临港实验室的经费资助。
全文链接:https://doi.org/10.1038/s41467-023-42102-y
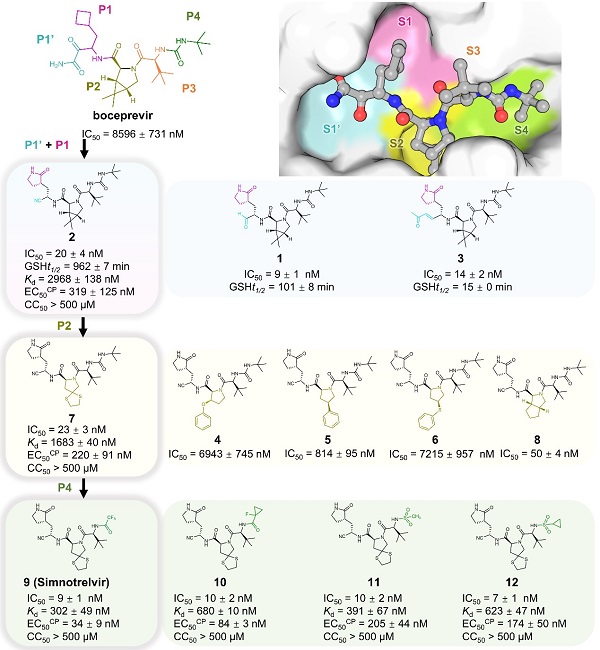
图1. 先诺特韦的理性设计与优化过程
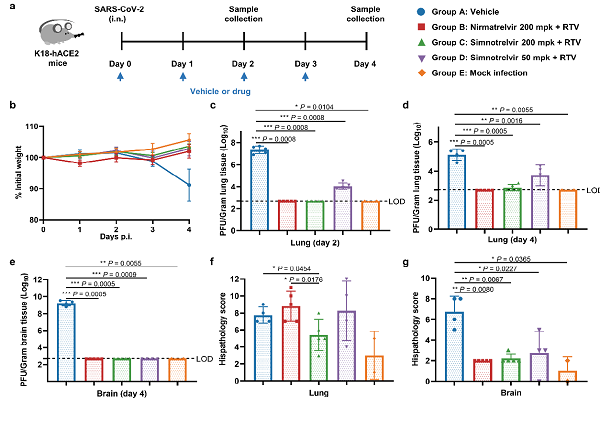
图2. 先诺特韦的小鼠体内药效评价

图3. 先诺特韦(a)和奈玛特韦(b)的P2基团与新冠病毒3CL蛋白酶的相互作用和结合热力学参数(c)

图4. 抗新冠病毒感染口服新药——先诺欣®
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn