

(图片来源:Angew. Chem. Int. Ed.)
正文
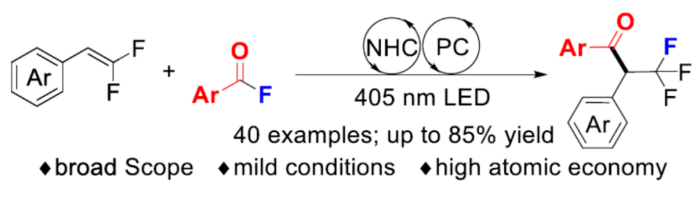
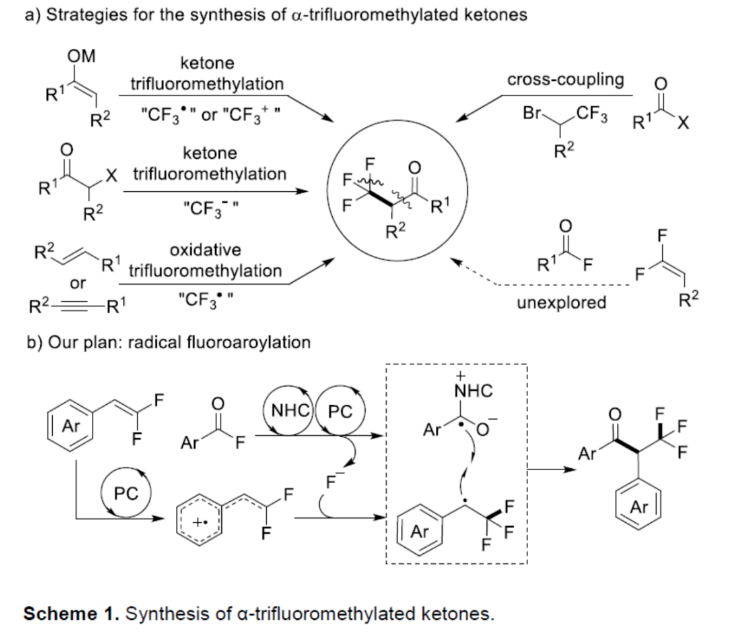
众所周知,与相应的非氟同源物相比,在有机化合物中引入三氟甲基可以显著改善其药代动力学特征。因此,化学家们一直致力于开发可持续和通用的合成含三氟甲基化合物的方法。近年来,α-CF3取代酮是含氟化合物的一个重要亚类,并得到了广泛的研究。目前,化学家们已开发多种合成α-CF3取代酮的方法(Scheme 1a)。传统上,通过预形成的硅基烯醇醚或衍生自相应酮的烯醇化物的亲电或自由基三氟甲基化反应是合成α-CF3取代酮的常用方法。作为一种替代的策略,Grushin课题组利用CuCF3试剂实现了α-卤代酮的亲核三氟甲基化反应。其次,烯烃或炔烃的氧化三氟甲基化反应已成功应用于α-CF3取代酮的合成。然而,大多数的合成方法都需要过量使用昂贵或敏感的三氟甲基试剂,导致产生大量废物。同时,利用含有CF3砌块构建三氟甲基化合物的自由基偶联方法是另一种互补性的方法。在这种情况下,CF3基团需预先引入至底物中,并且在此过程中不会形成C-F键。然而,含有CF3的单元的有限选择和高成本,从而限制了该方法的通用性。近年来,偕-二氟烯烃可与外部氟化物源进行1,2-双官能团化反应,实现三氟甲基化合物的合成,涉及自由基、阴离子或阳离子途径。同时,基于Armido Studer课题组对于NHC催化芳酰基氟化物的反应以及NHC/光氧化还原催化自由基-自由基交叉偶联反应的启发,近日,德国明斯特大学Armido Studer课题组报道了一种利用芳酰基氟化物作为双官能团化试剂,通过协同光氧化还原和NHC催化实现了α-CF3羰基化合物的合成(Scheme 1b)。下载化学加APP到你手机,更加方便,更多收获。
(图片来源:Angew. Chem. Int. Ed.)
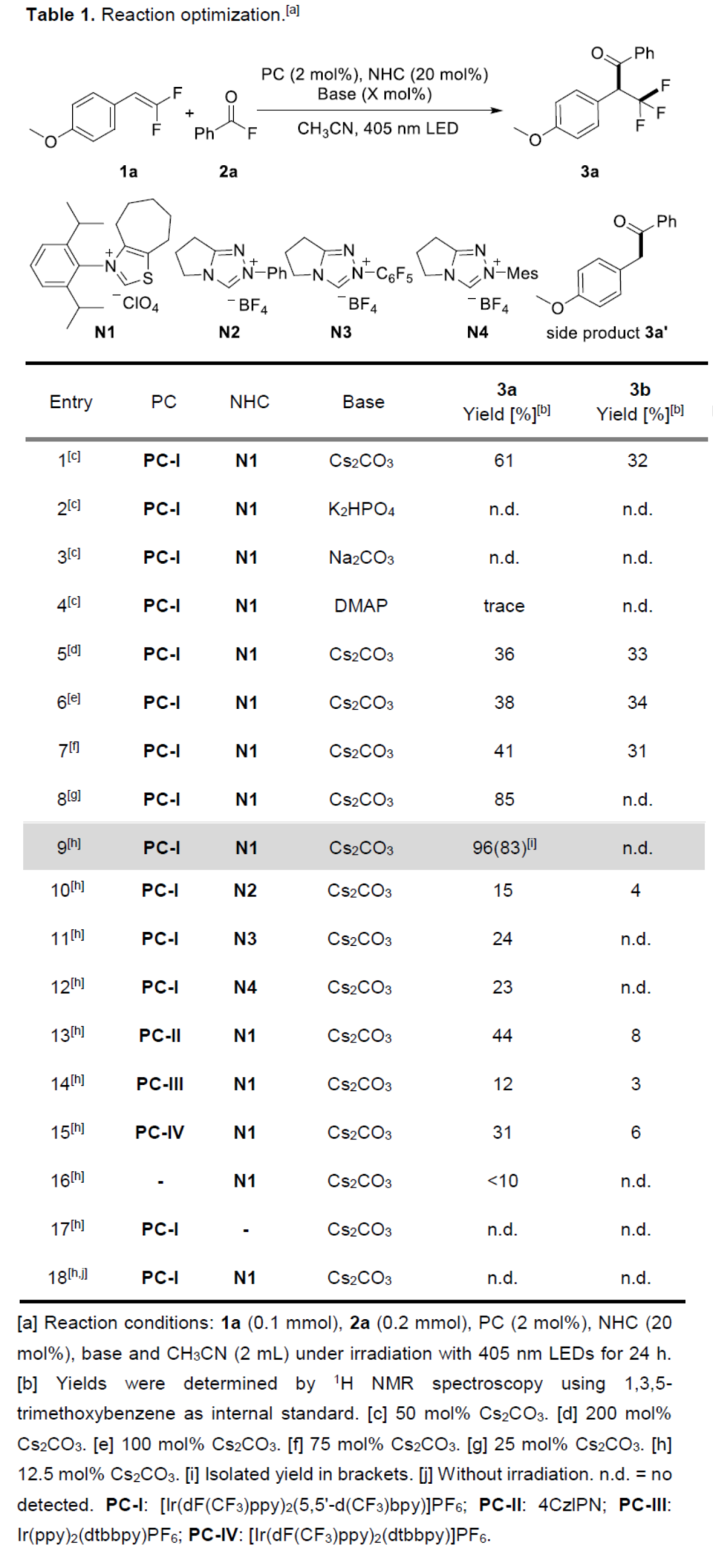
首先,作者以偕-二氟烯烃1a与苯甲酰氟2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以[Ir(dF(CF3)ppy)2(5,5'-d(CF3)bpy)]PF6 PC-I(2 mol %)作为光催化剂,NHC N1(20 mol %)作为NHC催化剂,Cs2CO3(12.5 mol%)作为碱,405 nm LEDs作为光源,在CH3CN溶剂中反应,可以83%的分离收率得到产物3a。
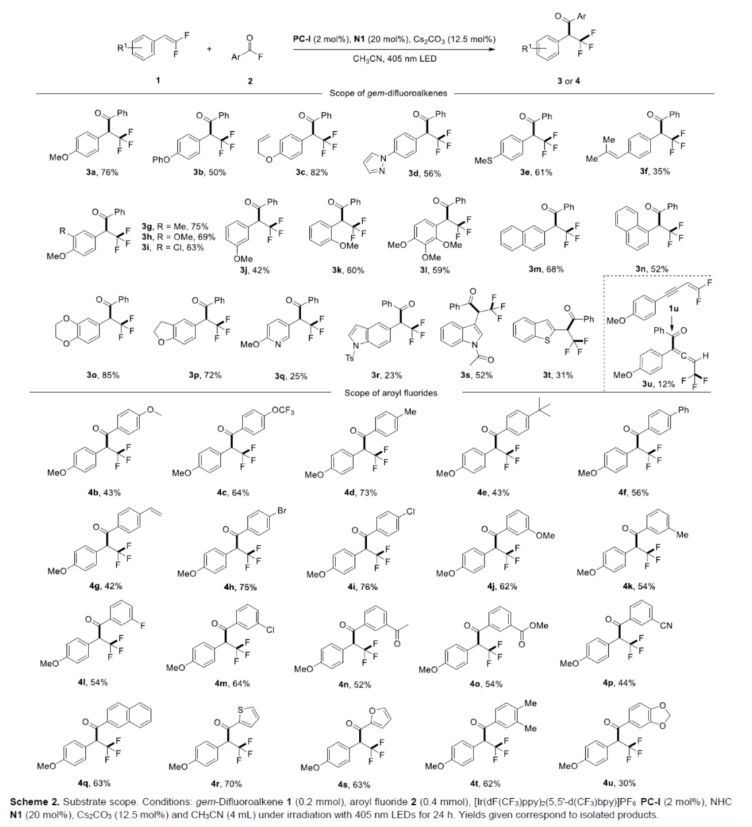
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。首先,当二氟烯烃底物中的芳基上含有烷氧基、吡唑基、烷基硫基、烯基等时,均可顺利反应,获得相应的产物3a-3l,收率为35-82%。然而,在芳环的对位带有吸电子基团(如氰基、硝基和酰基)的二氟烯烃在该转化中是不活泼的,因为它们在标准条件下不被氧化。其次,二氟烯烃底物中含有萘基与杂芳基时,也与体系兼容,获得相应的产物3m-3t,收率为23-85%。同时,烯炔衍生的二氟烯烃1u也是合适的底物,可以12%的收率得到产物3u。此外,甲酰氟底物中含有不同电性取代的芳基、萘基以及杂芳基时,均可顺利反应,获得相应的产物4b-4u,收率为30-73%。然而,脂肪族酰基氟化物,未能有效的进行反应。
(图片来源:Angew. Chem. Int. Ed.)
紧接着,作者对反应的实用性进行了研究(Scheme 3)。首先,将反应规模放大至1 mmol时,同样能够以75%收率得到产物3a(Scheme 3a)。其次,3a与PhB(OH)2在Pd(PPh)3Cl2/K3PO4条件下通过脱氟/芳基化串联反应,可以76%的收率得到氟化的-α,β-不饱和酮5,E/Z为1:6(Scheme 3b)。3a在KHMDS/THF以及Ts2O/CH2Cl2条件下反应,可以64%的收率得到氰基取代的烯醇甲苯磺酸酯6,E/Z为1:0.6(Scheme 3c)。此外,简单的苯乙烯以及α-氟苯乙烯衍生物,也能够与2a顺利进行氟代芳酰化反应,获得相应的产物8a-8d,收率为30-44%(Scheme 3d)。
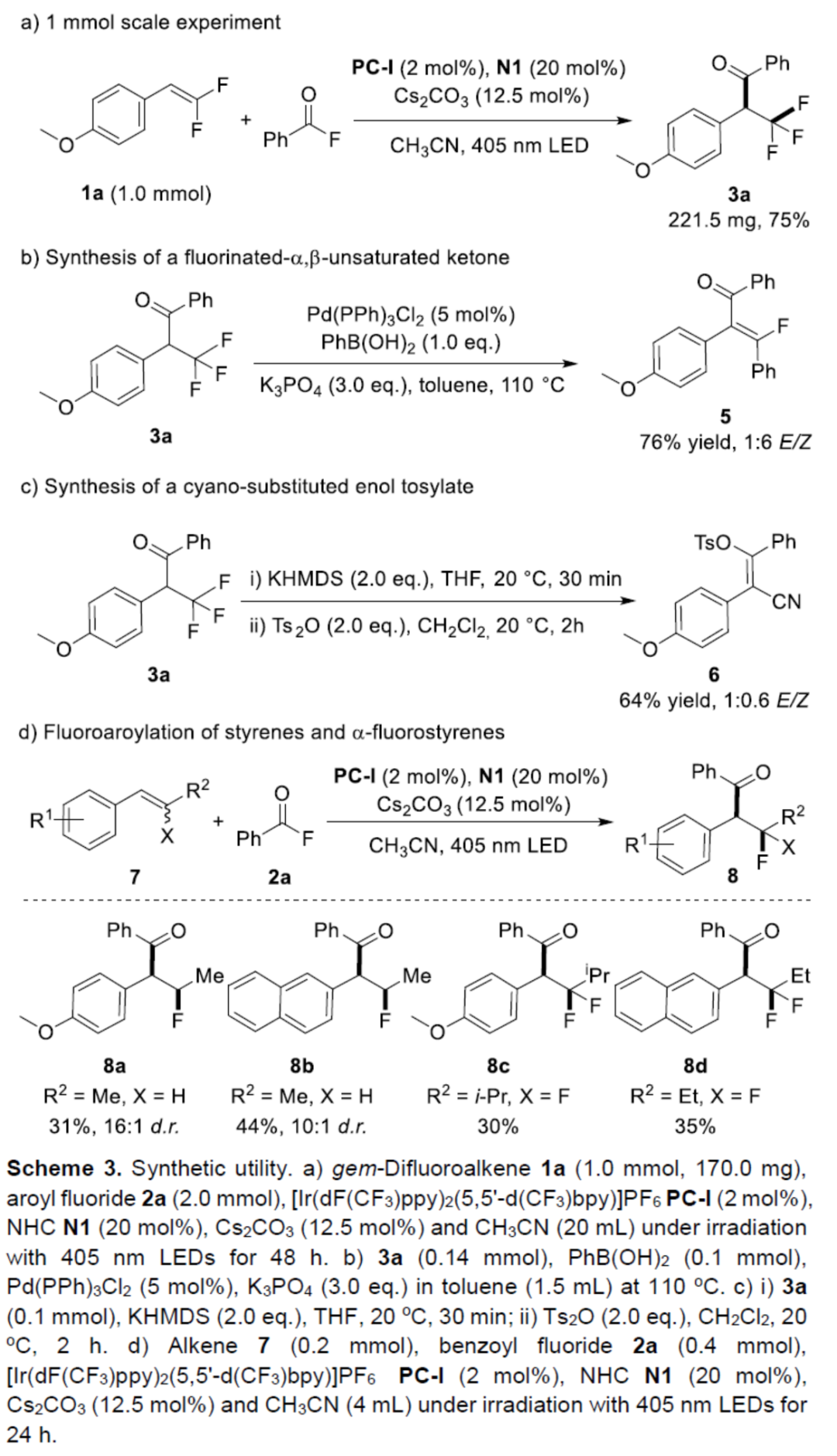
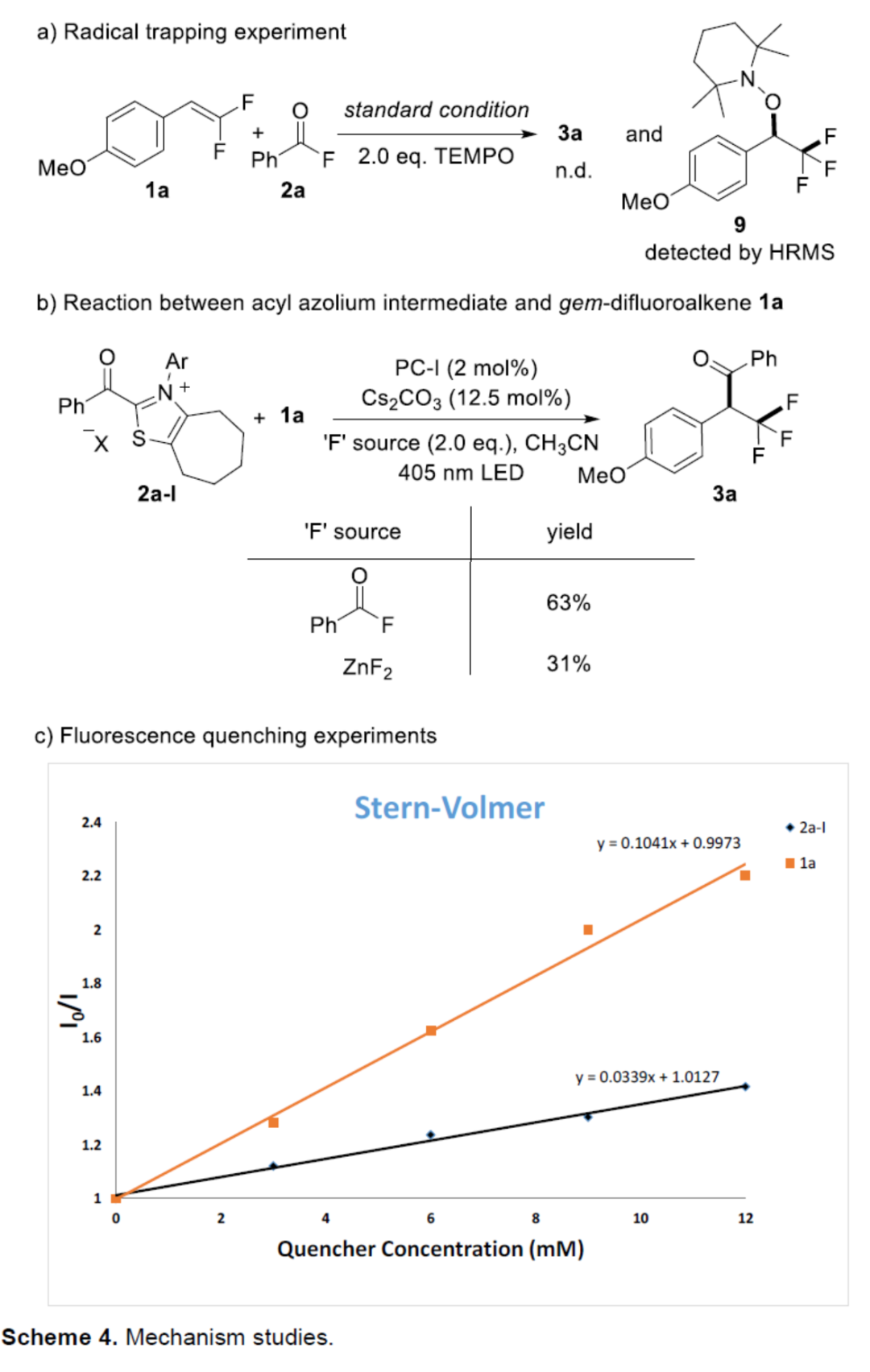
随后,作者还对反应机理进行了进一步的研究(Scheme 4)。首先,自由基捕获实验结果表明,α-三氟甲基苄基自由基作为中间体参与了反应(Scheme 4a)。其次,酰基唑鎓离子中间体2a-l与偕-二氟烯烃1a的对照实验结果表明,酰基唑鎓离子2a-l是反应的有效中间体(Scheme 4b)。此外,Stern-Volmer荧光淬灭实验结果表明,底物1a和酰基唑鎓离子2a-I可以淬灭光催化剂PC-I的激发态。然而,发现1a的淬灭效率明显高于2a-I(Scheme 4c)。
(图片来源:Angew. Chem. Int. Ed.)
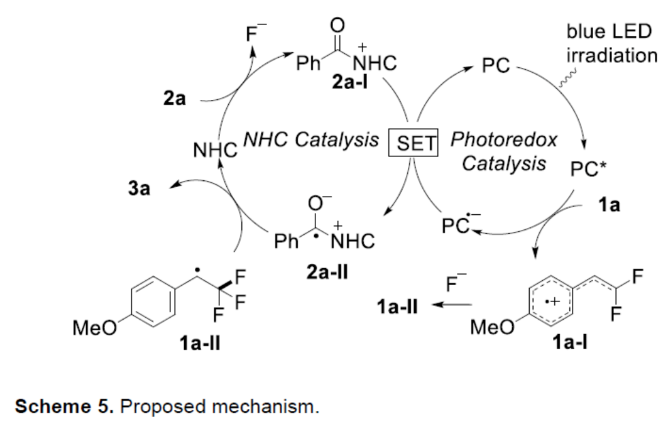
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Scheme 5)。首先,光激发的Ir(III)*催化剂可对偕-二氟烯烃1a进行可见光诱导的SET氧化,生成相应的自由基阳离子1a-I以及还原的Ir(II)-配合物。然后,中间体1a-I可被氟阴离子区域选择性地捕获,生成苄基自由基1a-II。考虑到两个氟原子的诱导作用和苄基自由基的稳定性,可以解释反应的区域选择性。同时,芳酰基氟化物2a与NHC催化剂的反应生成酰基唑鎓离子2a-I,其用还原的光氧化还原催化剂Ir(II)进行SET还原以再生基态Ir(III),并形成烯酮型自由基2a-II。最后,由持续自由基效应控制的烯酮基自由基2a-II与苄基自由基1a-II的交叉偶联以及随后是NHC断裂,从而生成目标产物3a,并关闭NHC催化循环。
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn