- 首页
- 资讯
Angew:双重催化光氧化还原交叉偶联多样性合成1,2,3,4-四取代环丁烯
来源:化学加原创 2023-10-30
导读:近日,加拿大阿尔伯塔大学Dennis G. Hall课题组报道了一种发散性合成策略,可将单一的光学活性骨架转化为一系列具有不同取代模式的各种衍生物。其中,前手性1,2-二溴环丁烯酰亚胺的对映选择性去对称化是通过双重Ir/Ni-催化的光氧化还原C(sp2)-C(sp3)交叉偶联实现的,并以良好的收率和>90% ee引入了可转换的碳单元。此外,该策略具有独特的单偶联选择性,得到的手性溴环丁烯作为一种常见的骨架,可以发散性的方式转化为几种有价值的1,2,3,4-四碳取代的环丁烷产物,同时保持光学纯度。文章链接DOI:10.1002/anie.202313503
(图片来源:Angew. Chem. Int. Ed.)
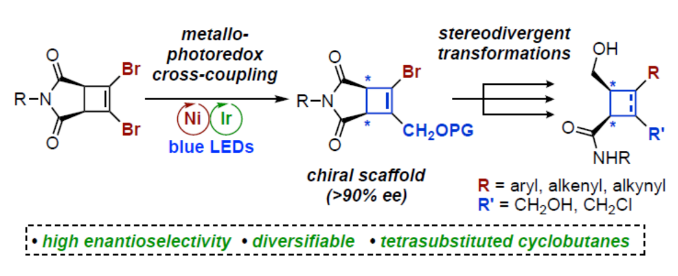
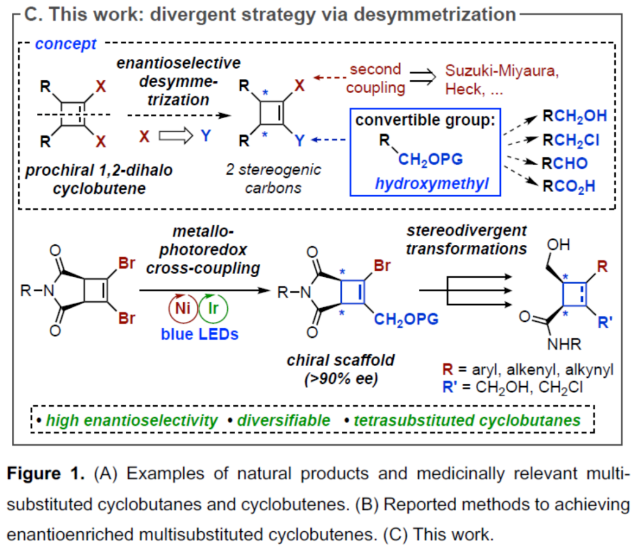
手性环丁烷和环丁烯是一种独特的结构单元,广泛存在于各种天然产物和药物中(Figure 1A)。虽然化学家们已开发了多种对映选择性合成环丁烷的方法,但对于手性环丁烯(尤其是三/四取代的环丁烯)的合成方法目前却较少有相关的研究报道(Figure 1B)。同时,环丁烯作为中间体是非常有利的,因为烯基能够为随后的多样化提供更大的合成自由度。因此,迫切需要开发一种新型合成手性环丁烯的方法,特别是1,2,3,4-四取代骨架的合成。受到单一通用中间体发散性合成策略、通过去对称化合成光学富集的有机分子以及过渡金属催化交叉偶联反应的启发,近日,加拿大阿尔伯塔大学Dennis G. Hall课题组开发了一种新型的1,2-二溴环丁烯前体的对映选择性金属光氧化还原催化单交叉偶联为中心的去对称化策略。利用该策略合成的光学富集骨架及其多功能的羟甲基可多样化转换为1,2,3,4-四取代的4-元碳环骨架(Figure 1C)。下载化学加APP到你手机,更加方便,更多收获。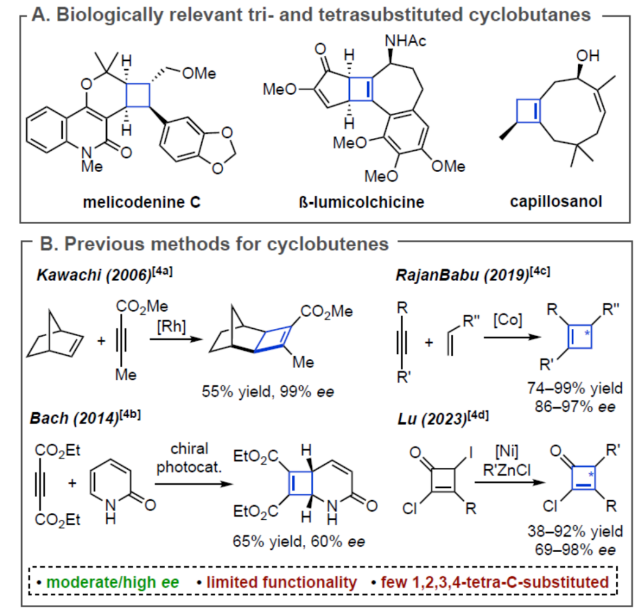
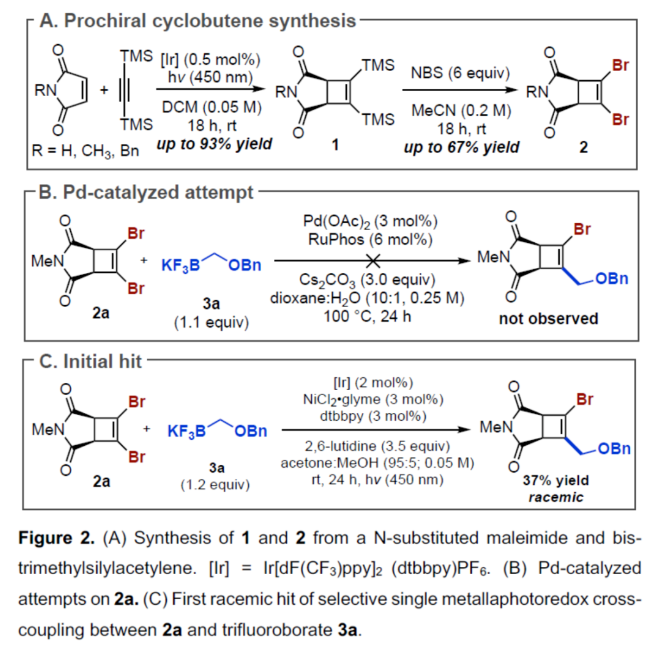
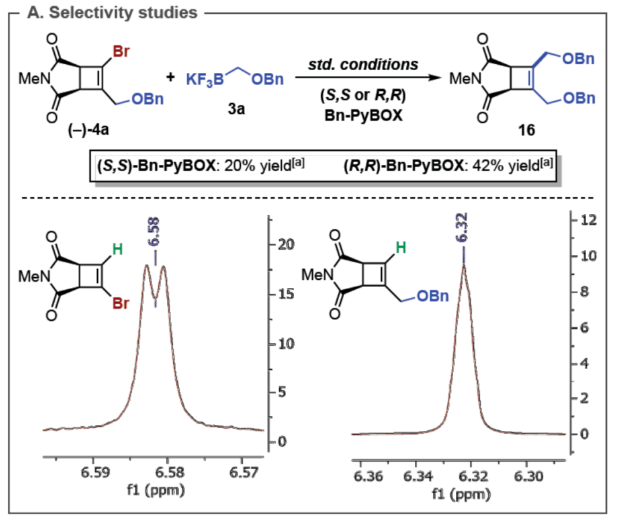
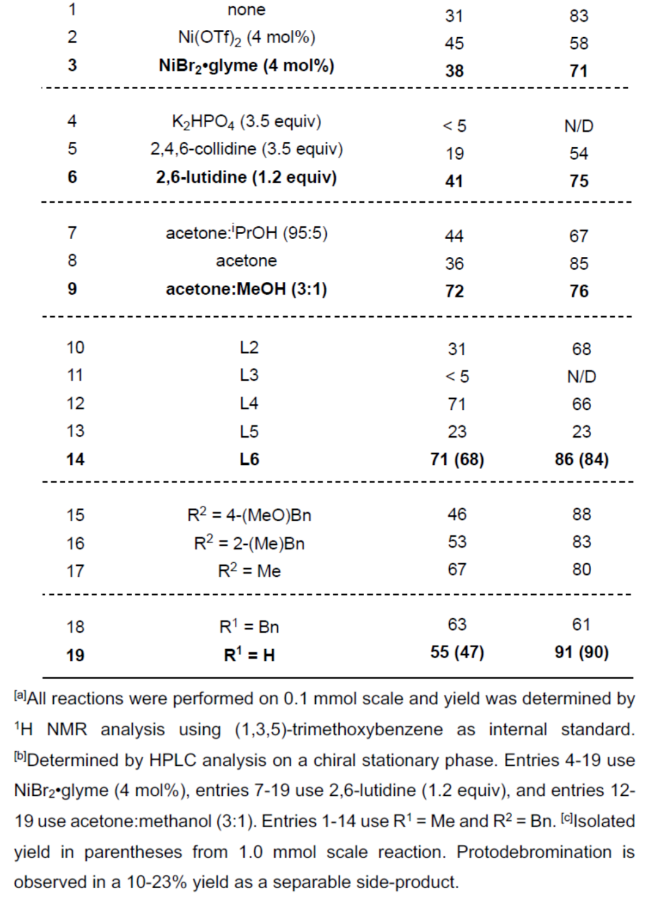
(图片来源:Angew. Chem. Int. Ed.)首先,作者利用N-取代的马来酰亚胺与双三甲基硅基乙炔为底物,通过[2+2]-环加成反应后,可以93%的收率得到环丁烯中间体(1)。然后,中间体(1)与NBS通过双重亲电溴代去硅基化反应,可以67%的收率得到1,2-二溴环丁烯化合物(2)(Figure 2A)。然而,在典型的钯催化体系下,二溴环丁烯化合物(2)与苄氧基甲基三氟硼酸钾3a反应,未能获得所需的单偶联产物(Figure 2B)。近年来,金属光氧化还原促进的交叉偶联反应是一种在温和的条件下构建C(sp2)–C(sp3)和C(sp3)–C(sp3)的有效策略。同时,作者以2a与3a作为底物,在Molander课题组(Science 2014, 345, 433.)所开发的条件下反应,可以37%的收率得到单选择性的C(sp2)–C(sp3)交叉偶联产物(Figure 2C)。因此,仍需对反应条件进行进一步的优化。(图片来源:Angew. Chem. Int. Ed.)其次,作者以1,2-二溴环丁烯衍生物2与三氟硼酸钾衍生物3a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以Ir[dF(CF3)ppy]2(dtbbpy)PF6(2 mol %)作为光催化剂,NiBr2•glyme(4 mol %)作为催化剂,2,6-二甲基吡啶(1.2 equiv)作为碱,L6(8 mol %)作为配体,在丙酮:甲醇(3:1)混合溶剂于450 nm照射下反应,可以68%的分离收率得到产物(-)-4,ee为84%。同时,在上述最佳反应条件下,当底物2的R1为-Bn或-H时,可获得相应的产物,收率为55-63%,ee为61-91%。当底物1的R2为- 4-(MeO)Bn、-2-(Me)Bn或-Me时,可获得相应的产物,收率为46-67%,ee为80-88%。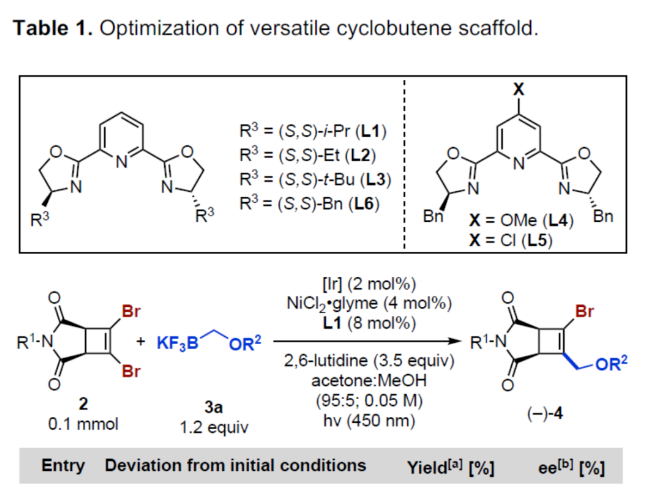
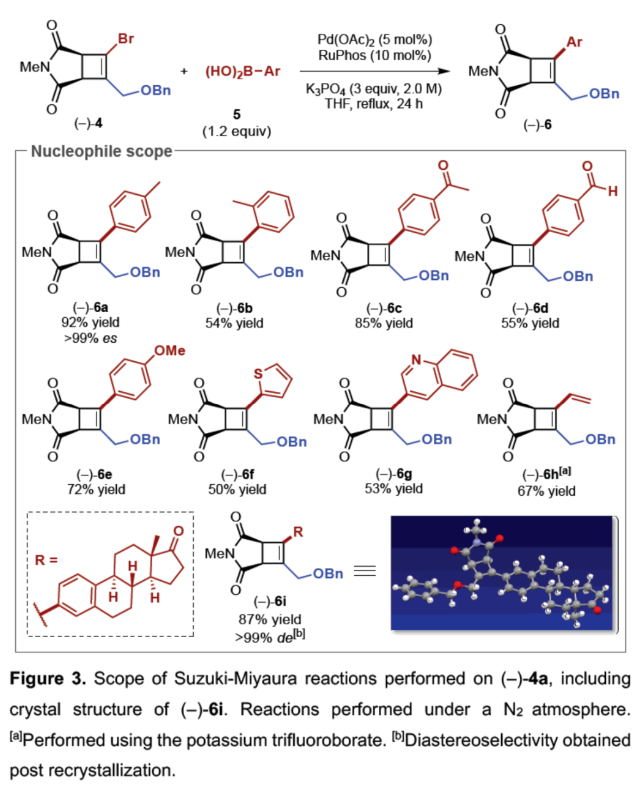
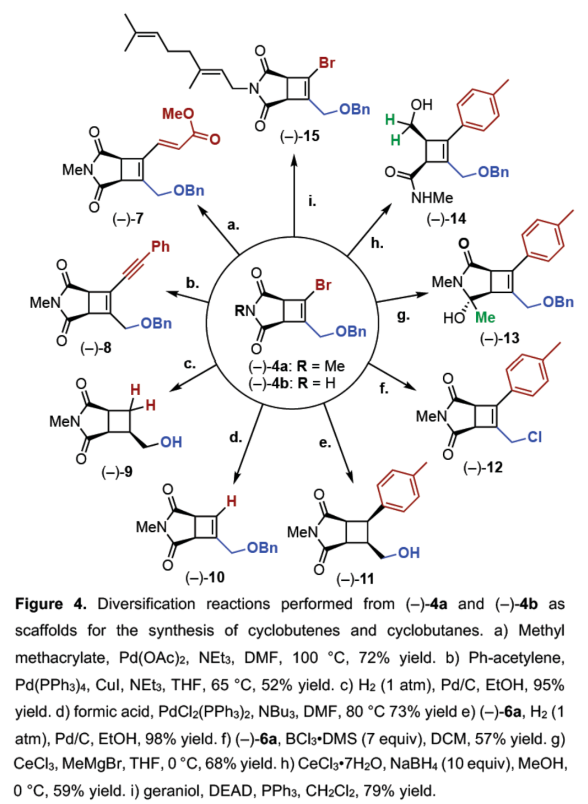
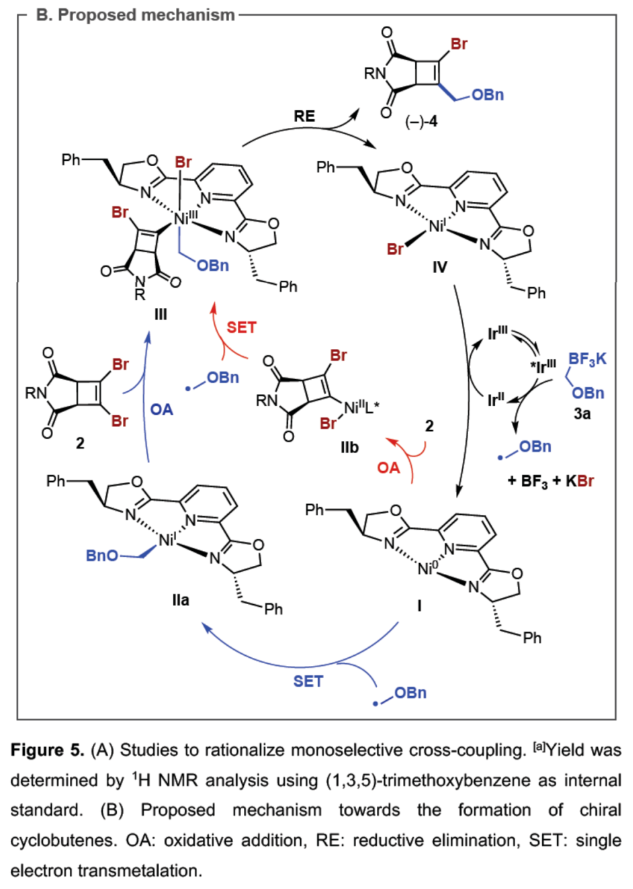
(图片来源:Angew. Chem. Int. Ed.)紧接着,作者以上述合成的(–)-4为底物,对钯催化Suzuki-Miyaura反应的底物范围进行了扩展(Figure 3)。研究结果表明,一系列不同电性取代的芳基硼酸、杂芳基取代的硼酸、烯基硼酸等,均可顺利反应,获得相应的产物(-)-6a-6i,收率为50-92%。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者对反应的后期衍生化进行了研究(Figure 4)。首先,(-)-4a通过钯催化的Heck与Sonogashira偶联反应,可获得相应的产物(-)-7(收率为72%)和(-)-8(收率为52%)。(-)-4a在H2/Pd/C条件下进行氢化反应,可以95%的收率得到三取代化合物(-)-9。(-)-4a在甲酸/PdCl2(PPh3)2/NBu3条件下进行选择性脱卤反应,可以73%的收率得到三取代化合物(-)-10。其次,(-)-6a在H2/Pd/C条件下进行氢化反应,可以98%的收率得到四取代化合物(-)-11。(-)-6a在BCl3•DMS条件下进行苄基醚键的断裂,可以57%的收率得到烯丙基氯化合物(-)-12。(-)-6a在CeCl3/MeMgBr/THF条件下进行区域选择性甲基化反应,可以68%的收率得到环状酰亚胺化合物(-)-13。(-)-6a在CeCl3•7H2O/NaBH4/MeOH条件下进行区域选择性开环反应,可以59%的收率得到四取代环丁烯衍生物(-)-14。此外,(-)-4b与香叶醇在DEAD/PPh3条件下进行Mitsunobu烷基化反应,可以79%的收率得到化合物(-)-15。(图片来源:Angew. Chem. Int. Ed.)此外,通过对单选择性交叉偶联研究表明,反应有利于氧化加成与动力学拆分过程,导致了反应具有单偶联选择性,并对去对称化过程也至关重要(Figure 5A)。同时,作者提出了一种合理的催化循环过程,涉及SET、OA与RE的过程(Figure 5B)。一般来说,金属光氧化还原促进的C(sp2)-C(sp3)交叉偶联反应通过两种可接受的可能性发生,这两种可能性因OA和SET步骤的相对顺序而不同。计算分析表明,该过程的决速步骤可能因所选途径而异。然而,由于这种去对称化的性质,氧化加成可作为对映选择性决定步骤,而与所选择的途径无关(即i至IIb或IIa至III)。值得注意的是,三齿配体在镍光氧化还原催化中是前所未有的。此外,不同配体、三氟硼酸酯和酰亚胺N-取代基的对映选择性比的变化可能是由空间相互作用的微妙平衡引起的,空间相互作用影响氧化加成过渡态的相对能量,从而导致两种对映体。(图片来源:Angew. Chem. Int. Ed.)加拿大阿尔伯塔大学Dennis G. Hall课题组报道了一种对映选择性和独特的单选择性双重催化金属光氧化还原C(sp2)-C(sp3) 交叉偶联反应,可将可转化基团引入至新型的1,2-二溴环丁烯上,提供了一种可以广泛衍生成饱和与不饱和4-元碳环的去对称化骨架。这一罕见的对映选择性金属光氧化还原催化实例为制备具有四个不同碳取代基的生物相关手性1,2,3,4-取代环丁烷提供了一条有效途径。
文献详情:
Dawson J. Konowalchuk, Prof. Dennis G. Hall*. Divergent Synthesis of 1,2,3,4-Tetrasubstituted Cyclobutenes from a Common Scaffold: Enantioselective Desymmetrization via Dual-Catalyzed Photoredox Cross-Coupling. Angew. Chem. Int. Ed. 2023, https://doi.org/10.1002/anie.202313503
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn