在温和条件下,光催化甲烷转化为高附加值化学品是利用天然气和可再生能源的有前途的方法。近年来,使用分子氧作为氧化剂的光催化甲烷氧化反应引起了广泛关注,因为它在热力学上是有利的,并且可以生成各种活性氧物种,从而将甲烷转化为许多附加值产品,如甲醇、甲醛、乙烷和乙烯。
近日,国家纳米科学中心唐智勇研究员、范晓宇博士在Nano Research上发表题为“Recent advances on aerobic photocatalytic methane conversion under mild conditions”的综述性文章(图1)。在本综述中,我们将有氧光催化甲烷转化分类为有氧光催化甲烷部分氧化(APPOM)和有氧光催化甲烷偶联(APCM)。我们特别介绍了这些转化反应中氧气活化和甲烷反应的机理。最后,我们对当前有氧光催化甲烷转化面临的挑战和未来的研究方向进行了展望。
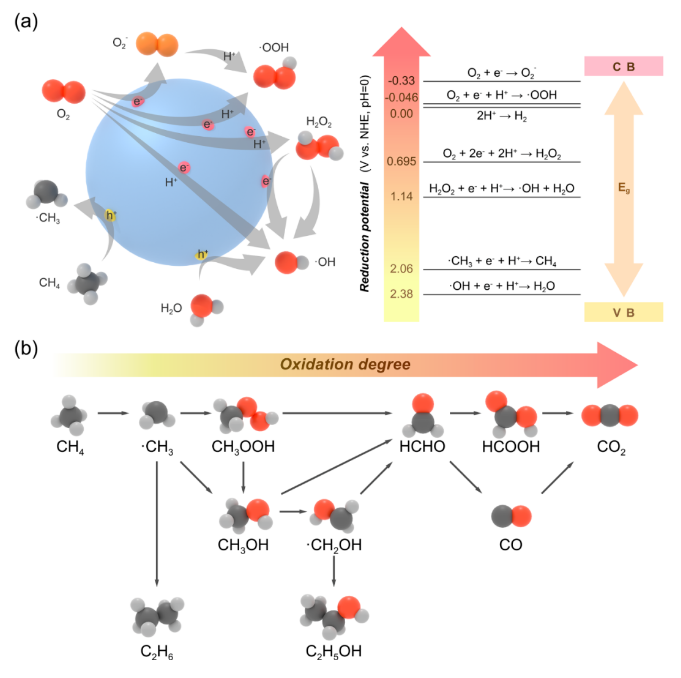
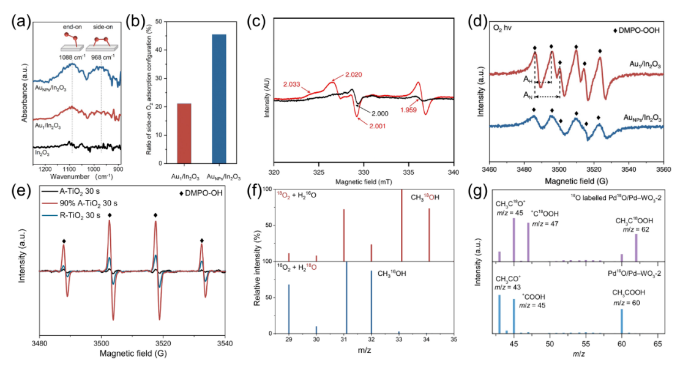
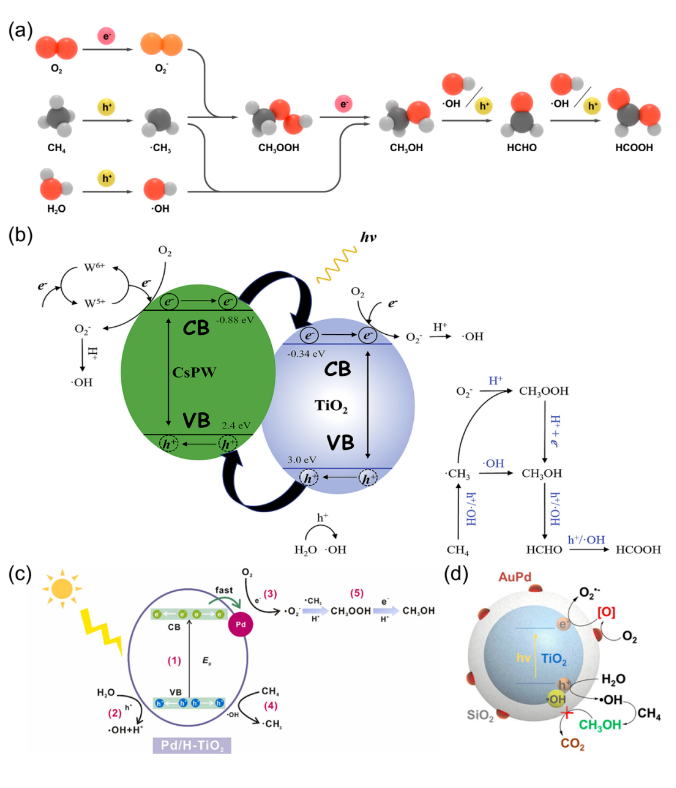
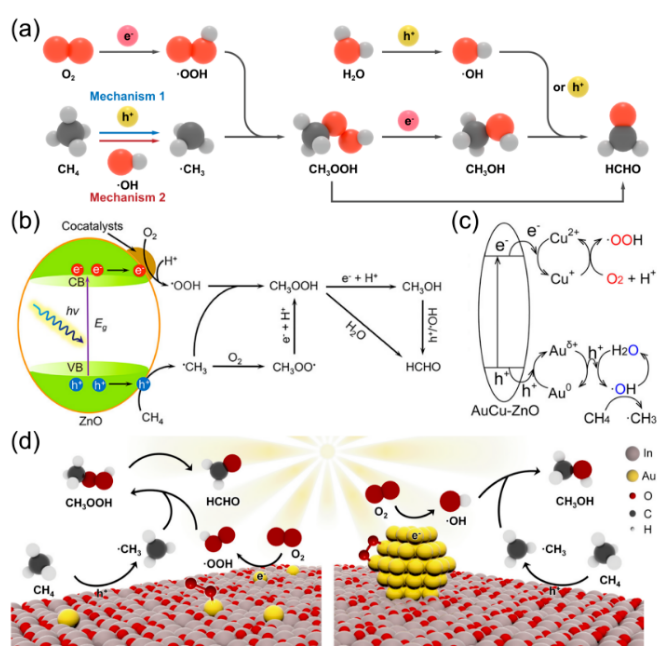
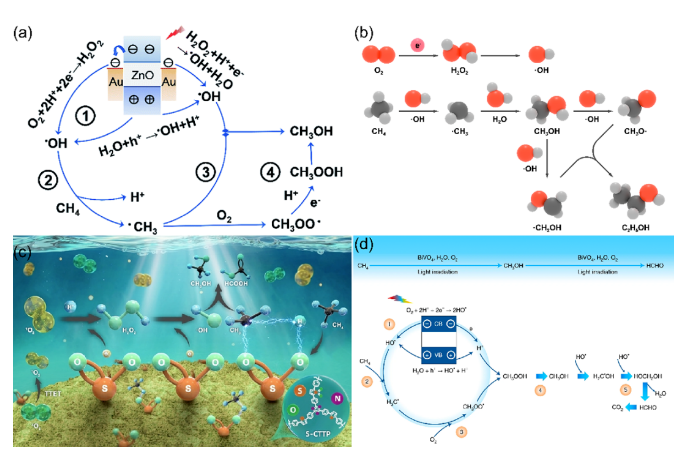
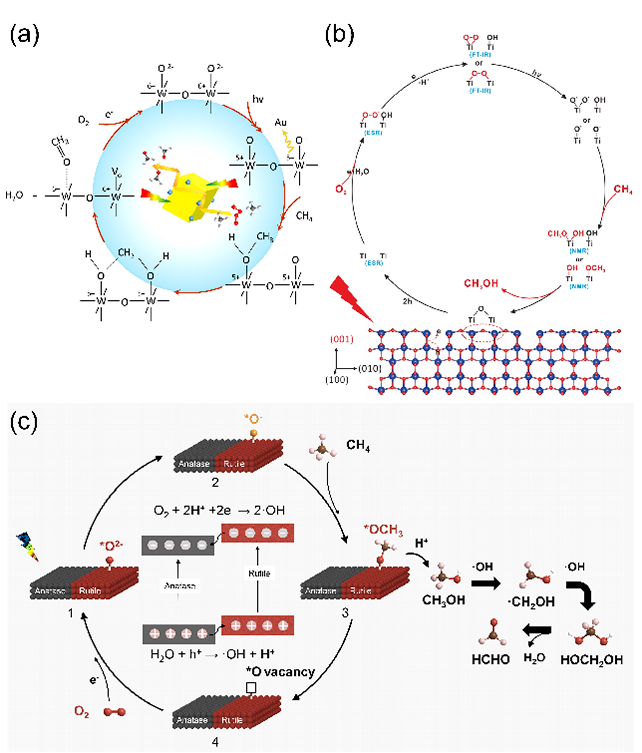
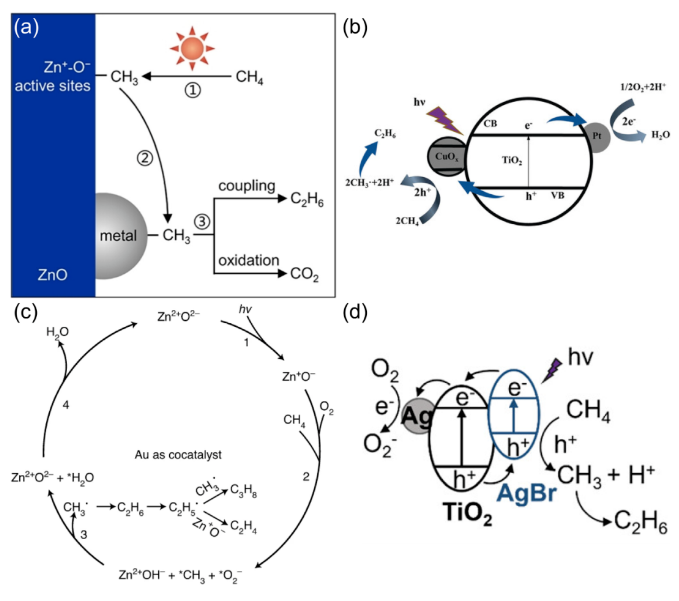
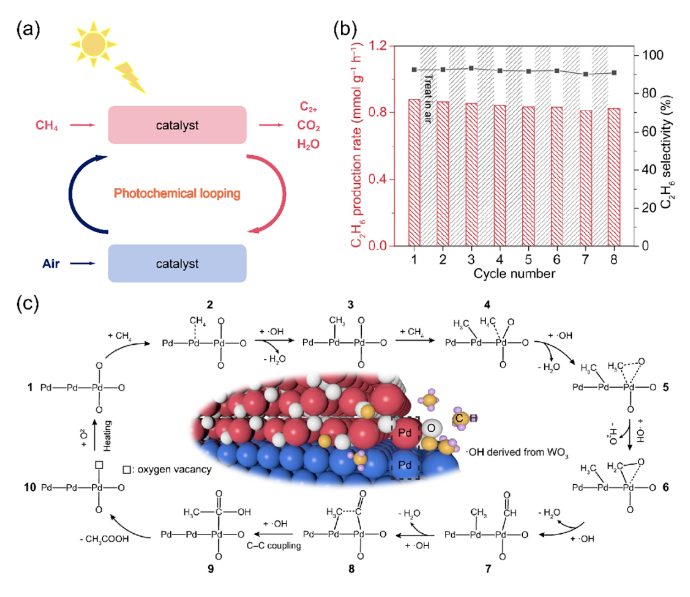
甲烷(CH4)是一种储量丰富且价格低廉的化石燃料,但是大部分CH4储存于偏远地区,而CH4的长途运输是一个非常昂贵的过程,运输过程中的泄漏可能会造成各种环境问题。因此,开发将CH4转化为可运输和高附加值化学品技术引起了研究人员的兴趣。然而,稳定的四面体结构和稳定的C-H键(键能为439.3 kJ mol-1)使得CH4活化非常困难,CH4转化被认为是化学中的“圣杯”。在工业中,CH4主要通过蒸汽-甲烷重整(SMR)和费托合成(FTS)等间接过程转化为化学品,但通常在700-1000 ℃的高温下运行,如此高的温度和复杂的流程导致巨大的能源消耗。研究人员期望在相对较低的温度下直接将CH4转化为化学品。一般来说,引入H2O2或O2等氧化剂有利于克服热力学障碍,提高CH4的转化率。然而,H2O2比含氧产物更昂贵。首选便宜和更容易获得的O2作为氧化剂,但由于不可控的O2活化过程和热催化过程中不可避免的产物过度氧化,仅使用O2选择性地直接将CH4转化为含氧化合物很难实现。研究表明,热催化直接转化CH4的工业应用仍然受到反应条件苛刻、氧化剂昂贵、产率低和选择性低等问题的阻碍。光催化可以将可再生太阳能转移到高能载体上,并在温和的条件下驱动选择性CH4转化,从而避免过度氧化,提高催化剂的稳定性。特别是,对于有氧光催化CH4转化,已经报道了许多令人印象深刻的结果。这些结果主要由于有氧光催化CH4转化的热力学有利的特性以及O2还原产生的一系列活性氧(ROS)的存在。这些ROS有利于CH4的活化和产物的形成。因此,迫切需要总结有氧光催化CH4转化的研究进展。在本综述中,我们总结了对于有氧光催化CH4转化的理解,包括氧气活化机制和CH4转化途径,以及用于有氧光催化CH4转化的原位表征技术。随后,根据产品类型,我们将有氧光催化CH4转化分类为有氧光催化CH4部分氧化(APPOM)和有氧光催化CH4偶联(APCM)。然后,我们描述了有氧光催化CH4转化的最新进展,旨在为高效催化剂的设计和反应机制的理解提供灵感。最后,我们展望未来研究的方向。在有氧光催化CH4转化中,当光照射到具有大于能带间隙的能量的光催化剂上时,导带(CB)中的电子被激发到价带(VB)中,同时留下空穴。随后,迁移到催化剂表面的电子和空穴会根据反应电位发生相应的氧化还原反应。如图2(a)所示,空穴可以裂解CH4的C-H键,形成•CH3(•CH3/CH4 = 2.06 V vs. NHE,正常氢电极),并将H2O氧化成•OH(•OH/H2O = 2.38 V vs. NHE)在水溶液中。与此同时,电子可以还原H+为H2(2H+/H2 = 0 V vs. NHE)。更重要的是,O2很容易与电子反应,形成O2−(O2/O2− = -0.33 V vs. NHE),过氧化氢自由基(•OOH)(O2/•OOH = -0.046 V vs. NHE),H2O2(O2, 2H+/H2O2 = 0.695 V vs. NHE),或•OH(H2O2, H+/•OH = 1.14 V vs. NHE)。接下来,通过自由基反应途径或表面反应(如图2(b)所示),会生成各种氧化物(CH3OOH、CH3OH、甲醛、甲酸和乙醇)、CO和C2H6。在有氧光催化CH4转化中,涉及多种自由基和表面反应中间体。因此,可以通过多种表征技术来绘制完整的反应途径,如原位反射红外傅立叶变换光谱(DRIFTS),原位电子自旋共振(ESR),原位X射线光电子能谱(XPS),CH4程序升温脱附(TPD),O2 TPD和自由基捕获实验等。由于与CH4吸附和活化相关的上述表征方法已在我们之前的综述中介绍,因此在这里我们重点关注O2吸附和活化的表征技术。此外,同位素实验可以用于证明产品中氧元素来源。O2 TPD用于研究催化剂的O2吸附能力。简而言之,在O2吸附在催化剂表面后,催化剂在惰性气体的携带下以线性速率加热。来自表面脱附气体的信号通过下游热导率检测器(TCD)进行监测。脱附峰的数量、峰温度和峰面积分别反映了吸附类型、吸附强度和吸附量。需要注意的是,O2 TPD不能提供有关特定O2吸附构型的信息,这可以由原位DRIFTS来补充。例如,通过低温DRIFTS可以区分O2吸附构型,其中1088和968 cm−1处的峰分别对应于端式和桥式O2吸附构型的振动(如图3(a)所示)。一旦O2被吸附和活化,可能会形成各种自由基。原位ESR是检测光照下产生的自由基的最强大方法。在气固体系统中,吸附在光催化剂表面的O2充当强电子受体,形成O2−。在气固体液体系统中,使用自由基捕获剂5,5-二甲基-1-吡咯烯-N-氧化物(DMPO),形成并通过ESR检测稳定的DMPO-OOH和DMPO-OH加合物。18O同位素实验是澄清产品中氧的来源并推断反应途径的重要方法。反应使用18O标记的反应物或光催化剂进行后,产品通过气相色谱-质谱联用(GC-MS)进行分析。与CH4的完全氧化不同,APPOM可能获得具有中间氧化状态的附加值氧化物(如CH3OH、HCHO、HCOOH、CO等),而不是低价值的温室气体CO2。有可用的O2作为氧化剂可以提高CH4转化的环境兼容性和原子经济性,而且将O2还原与CH4氧化相结合使反应在热力学上有利。需要指出的是,O2活化通常受到迟缓的动力学和从O2活化中生成的多样性活性氧物种对氧化物产品选择性的控制提出了巨大挑战。同时,产品中的C-H键比CH4中更活跃,导致不可避免的过氧化为CO2。因此,O2还原的迟缓动力学和氧化物产品的过氧化是APPOM中需要克服的两个障碍。基于反应系统中存在的不同相,APPOM可以分为气固体和气液固体系统。在气固体系统中,光诱导的O-被视为活性物种来活化CH4。1988年,Grätzel的研究团队首次利用TiO2负载的钼氧化物(TiO2/MoO3)作为光催化剂将CH4转化为CO。随后,一些研究采用基于钼和钒的光催化剂,以在升温条件下选择性催化CH4生成CH3OH。然而,该催化剂容易被失活,CH3OH产量非常低。气固体系统中产物的解吸附也是一个关键问题。需要相对较高的温度来辅助CH3OH的解吸附,这极大地限制了产量的增加,容易导致过氧化反应的发生。因此,气固体系统中的APPOM不适用于液体氧化物(如CH3OH或HCHO)的形成。气固体系统更适合选择性生成CO等气态部分氧化产物。设计具有高光生电荷分离能力的复合催化剂来控制CH4和O2的活化是实现高效稳定CO生成的关键。与已经研究几十年的气固体系统不同,气液固体系统在APPOM中的应用于2019年出现。此后,过去几年中已发表了大量高质量的研究。典型地,APPOM系统中存在的溶剂H2O有助于及时从催化剂表面去除部分氧化产物,从而防止过氧化并提高反应的选择性。此外,H2O可以充当ROS的来源,在CH4活化和氧化产物形成中发挥重要作用。此外,在H2O存在的情况下,O2还原的电位会发生改变,使O2更容易活化成ROS。然而,引入H2O无疑增加了反应系统的复杂性。水溶液中的分子间相互作用比气固体系统复杂,导致不同的表面性质和化学行为。如前所述,O2和H2O都可以被活化为ROS。在气液固体系统中确定ROS的来源需要更多基于实验和表征的验证。同时,在水溶液中对O2的活化通常会导致多样化的化学物种。为了使其更易理解,我们将文献分为以下四个类别(O2−、•OOH、•OH和晶格氧)。与气固体系统类似,气液固体系统中的O2也被激活为超氧自由基阴离子(O2−)。一般来说,光生电子主导O2的还原,而光生空穴氧化CH4生成•CH3和H2O生成•OH(图4(a))。然后,O2−与•CH3和H+反应形成CH3OOH。CH3OH的形成来源于•CH3和•OH的偶联或CH3OOH的还原。然后,CH3OH经历连续的氧化途径,导致产生HCHO、HCOOH和CO2。过氧羟基自由基(•OOH),作为O2−的共轭酸,也是O2活化的可能产物。在许多研究中,•OOH被认为是在水溶液中O2还原产生的主要ROS [13, 33]。有两种主流的反应机制。一种机制认为CH4是由光生空穴激活的(图5(a)中的机制1)。另一种观点认为•OH,起源于H2O氧化,负责CH4的激活(图5(a)中的机制2)。这两种机制的其余部分是相同的:•CH3和•OOH的偶联导致CH3OOH的形成;CH3OH是通过还原CH3OOH或•CH3和•OH的偶联产生的;而HCHO的形成是由于CH3OOH的分解和CH3OH的氧化。在气液固体系统中,•OH对于APPOM是一个重要的自由基,因为它可以参与(1)CH4的激活,(2)CH3OH的生成,以及(3)中间产物的氧化。尽管具有这些作用,过多的•OH不可避免地会导致氧化物产品的过度氧化。除了对H2O的氧化之外,O2的还原是产生•OH的可行途径。因此,将O2激活为•OH将促进CH4的转化和产物的形成(图6)。至于金属氧化物半导体而言,空穴在被激发后会定位在O2−上形成O−。大多数情况下,O−能够直接提取CH4的氢原子以产生•CH3,然后通过自由基反应形成各种产物。在某些情况下,O−不仅激活CH4,还参与产物的形成,据报道这是选择性生成CH3OH或HCHO的有效途径。在产物解吸附后,光催化剂表面上的氧空位可以通过O2进行补充以维持其稳定性(图7)。光催化的CH4偶联反应引起了广泛关注,因为通过NOCM或OCM反应可以获得有用的C2+产物(如C2H6和C2H4)。通常,与NOCM相比,光催化的OCM更有望在氧气存在条件下稳定的生成C2+产物,因为该反应在热力学上是自发的,并且在气相条件下催化剂不会发生碳积聚。不幸的是,由O2还原产生的ROS容易导致过氧化产物的形成,从而降低了C2+产物的选择性。因此,平衡偶联和过氧化是实现高效OCM的关键。作为选择性生成C2+产物的替代方法,近年来已开发了光化学环策略,这是一个分步过程,包括无氧反应器和空气反应器。在本节中,将讨论光催化OCM和光化学环的最新进展。在典型的光催化OCM系统中,光生空穴具有将CH4氧化成不稳定的•CH3中间体的能力,而光生电子则被O2捕获形成O2−。两个•CH3的偶联导致C2H6的产生。如果C2H6进一步脱氢,将形成C2H4。值得注意的是,O2−可以与H+结合形成H2O,或者与•CH3反应形成CO2。早期使用原始的半导体光催化剂,如TiO2和ZnO,显示出较差的C2+产物选择性,因为过多的氧化能力和缺乏C-C偶联活性位点导致不可避免的氧化反应,生成了HCHO、CO和CO2。负载金属纳米颗粒作为一种提高C2+产物收率和选择性的有效方法已被广泛采用,Au/ZnO等催化体系被开发,相应的反应机理也被研究(图8)。以上所有的例子都是在分批反应器中进行的,由于较长的停留时间,几乎无法避免过度氧化产物的生成。此外,使用分批反应器进行生产也很难进行规模化。相反,流动反应器克服了分批反应器的缺点,提高了对C2+产物的生产率和选择性。随后以Pt-CuOx/TiO2和Au-ZnO/TiO2作为光催化剂的流动体系被开发,C2H6 产生速率达到 5000 µmol·g−1·h−1同时选择性为90%。反应压力作为气相反应中的一个重要因素,可以调节光催化OCM的性能。加压流反应器的使用增强了反应物和产物的传质,提高了CH4转化率和C2+产物的选择性。基于上述结果,反应系统和光催化剂在光催化OCM性能中都起着重要作用。在反应系统方面,O2/CH4比例和流速强烈影响CH4的转化和C2+选择性。同时,选择适合的反应器和反应压力也至关重要。从催化剂的角度来看,高效的载体分离能力是光催化的基础。引入具有温和CH4氧化能力和有效O2还原能力的活性位点有助于提高光催化活性并减少副反应。然而,C2H4和C3+产物的产率相当低,而且底层机制尚未完全揭示。因此,有必要开发新型光催化剂来调控CH4激活和含碳中间体转化的过程。光化学循环过程包括无氧CH4转化和分离的光催化剂再生(图9(a))。首先,在无氧条件下有选择性地生成C2+产物,以有效抑制过度氧化的发生。然后,在分开的有氧环境中再生催化剂,以保持稳定性。因此,光催化循环策略结合了NOCM高C2+选择性的优点和OCM高催化剂稳定性的优势,以实现多碳产物的选择性生成。这一策略已成功应用于许多光催化系统,并取得了许多有价值的成果。目前报道的光化学循环策略都是在封闭系统中进行的,未解决无氧反应器和空气反应器之间的连接问题。因此,未来将深化光催化循环策略在光催化CH4转化中的应用,包括开发高效的光催化剂和反应器设计,特别是针对流动反应系统。有氧光催化CH4转化为高附加值的燃料和化学品(如C2+烃和氧化物)已经引起了学术界和工业界的广泛关注。氧气被认为是工业过程的最佳氧化剂,引入氧气不仅使CH4转化反应在热力学上有利,还引发了多种活性氧种的生成。这些氧物种在CH4的活化和随后的产物形成中起着关键作用。同时,有氧环境有助于保持催化剂的稳定性。本综述提供了有关有氧光催化CH4转化的发展概况,重点关注了O2的活化和反应途径。首先,讨论了有氧光催化CH4转化的一般反应路径以及表征方法。接下来,详细介绍了APPOM和APCM的最新进展。尽管在有氧光催化CH4转化中取得了显着的结果,但在其实际应用之前仍然需要解决许多挑战。尽管已经开发了各种方法来抑制CH4氧化为CO2,但通常由于不受控制的连续CH4脱氢反应,通常会获得混合的氧化物或烃类产物。对于APPOM反应,由于反应系统中存在丰富的活性氧种和各种产物形成途径,因此控制反应系统中形成的自由基的类型和各种含碳中间体在催化剂表面上的吸附是关键。对于APCM反应,表面偶联位点和脱氢位点的精确设计对于实现单一产物的选择性生成至关重要。例如,由于在金表面上的强烈d-σ相互作用促进了*CH3的偶联以产生C2H6,而Pd具有强大的脱氢能力,因此这种组合有助于形成C2H4。与非选择性自由基反应途径相比,表面反应途径更有希望实现高选择性的单一产物。因此,迫切需要设计新的光催化剂并探索新的机制,以实现有氧光催化CH4转化中目标产物的有选择性生成。除了催化剂的设计,有氧光催化CH4转化的性能还强烈依赖于反应条件,包括反应器、反应压力、温度、光源、反应时间等。研究人员应更加关注根据反应特性寻找合适的反应器,并优化反应条件以实现最佳的催化性能。目前,大多数有氧光催化CH4转化反应都导致了C1氧化物或C2H6的产生。有选择性地将CH4转化为C2+氧化物(如C2H5OH或CH3COOH)、C2H4和C3+烃类的报道很少,报道的产量仍然非常低。氧化和偶联的竞争反应阻碍了多碳产物的形成。因此,创建具有活化CH4、促进中间体偶联和防止过氧化的多功能催化剂是至关重要的。同时,多碳产物的生成代表了更复杂的反应途径,这需要开发各种原位表征。范晓宇,国家纳米科学中心特别研究助理,在站博士后,合作导师唐智勇研究员,主持国家自然科学基金青年项目。范晓宇博士研究方向主要是纳米材料的合成及其在能源与环境领域的应用,迄今,发表SCI论文7余篇。唐智勇,国家纳米科学中心研究员,博士生导师,科技部973(纳米重大研究计划)首席科学家,国家自然科学基金委杰出青年基金获得者,中国科学院“百人计划”入选者。曾获“Scopus寻找青年科学之星”材料科学青年科学之星成就奖、英国皇家化学会无机化学前沿杰出青年科学家奖、英国皇家化学会编委奖、第八届中国化学会-巴斯夫公司青年知识创新奖,并入选科技部中青年科技创新领军人才、第二批国家“万人计划”科技创新领军人才、英国皇家化学会会士。唐智勇课题组研究工作主要集中于功能无机纳米粒子组装体的设计、构筑、功能调控及其在能源、催化中的应用研究,已在Nature、Science、Nat. Mater.、Nat. Nanotech.、Nat. Chem.、Nat. Energy、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Mater.等国际顶尖刊物上发表论文200余篇,总引用次数超过37000次。文献详情:
Jiang, Y.; Li, S.; Fan, X.; Tang, Z., Recent advances on aerobic photocatalytic methane conversion under mild conditions. Nano Research 2023