

(图片来源:J. Am. Chem. Soc.)
正文
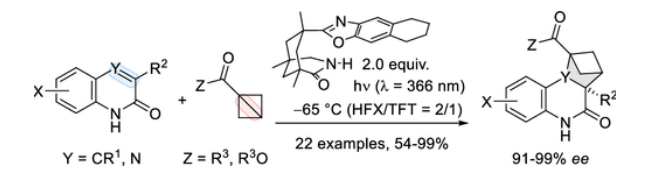
环丙烷的高环张力使得它们在与烯烃的环加成反应中可以充当C3组分。近些年来,化学家们已经发展了几种形式的环加成,它们主要依靠三元环的C-C键断裂。当两个环丙烷成环时,三元碳环的反应活性可以进一步增强,且形成的双环[1.1.0]丁烷(BCB)的环张力高达268 kJ mol−1。到目前为止,烯烃的热环加成反应已经被化学家们研究了一段时间,它可以生成外消旋双环[2.1.1]己烷,如rac-1(Scheme 1)。下载化学加APP到你手机,更加方便,更多收获。
近期,化学家们通过光化学方法解锁了BCBs的反应性。Glorius课题组利用烯烃,如香豆素2,在各自的三线态下来促进[π2+σ2]光环加成反应。此外,Brown课题组设计了BCB 3,它具有一个相邻的发色团,可以通过直接照射或敏化来激发。在这两种情况下,反应可能都是通过中心C-C键的断裂进行的,并涉及到作为中间产物的1,4-三线态双自由基的形成。这一发现引发了化学家们对BCBs环加成反应的广泛研究,然而到目前为止该反应的对映选择性版本尚未有报道。最近,德国慕尼黑工业大学Thorsten Bach课题组发展了在光催化(λ = 366 nm)下,利用手性络合物试剂实现2(1H)-喹诺酮与双环[1.1.0]丁烷的对映选择性[π2+σ2]环加成反应,构建了一系列手性双环[2.1.1]己烷类化合物。
(图片来源:J. Am. Chem. Soc.)
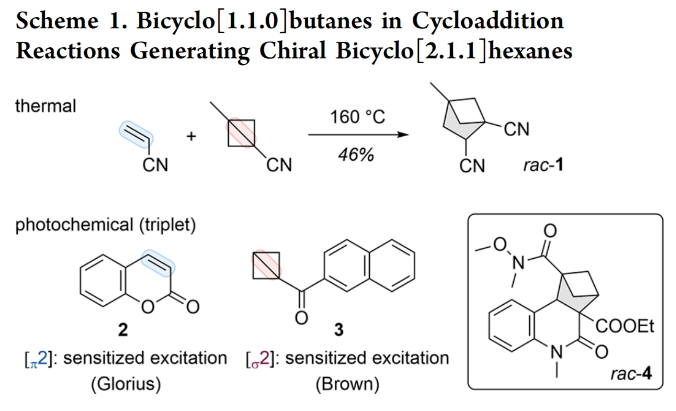
首先,作者选用喹诺酮5a和BCB 6a作为模板底物对此转化进行了探索(Scheme 2)。通过一系列条件筛选,作者发现当使用5a(1.0 equiv),6a(3.0 equiv), 8b(2.0 equiv),在HFX/TFT中,在光照(λ = 366 nm)下-65 °C反应,可以以以82%的产率,99%的ee得到目标产物7a。在条件优化过程中,作者发现低温和非极性溶剂的使用可以有效促进喹诺酮5a和手性络合物试剂8b之间形成氢键。
(图片来源:J. Am. Chem. Soc.)
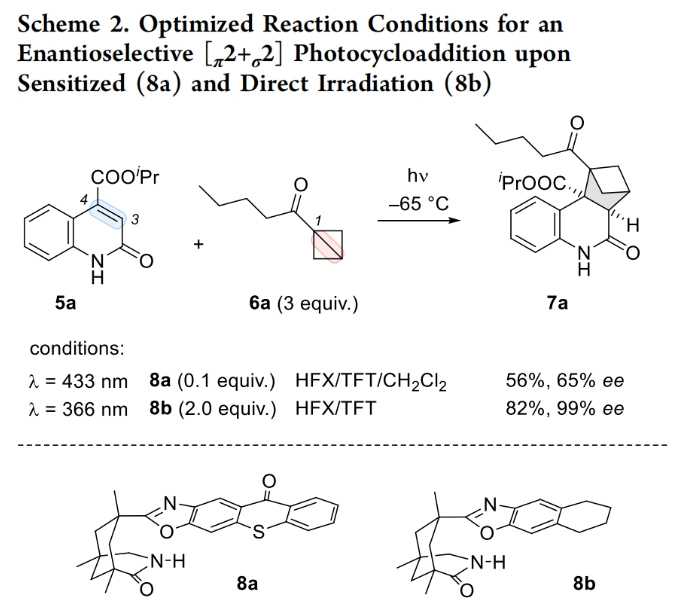
在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Scheme 3)。实验结果表明此转化对于一系列不同取代的喹诺酮5和BCB 6均具有良好的兼容性,以52-99%的产率,91-99%的ee得到相应的产物7a-7t。其中包括三氟甲基、卤素、烷基等一系列官能团均具有良好的兼容性。值得注意的是,此反应可以放大至1.0 mmol规模而产率和对映选择性基本不受影响(7a, 70%, 96% ee)。
(图片来源:J. Am. Chem. Soc.)
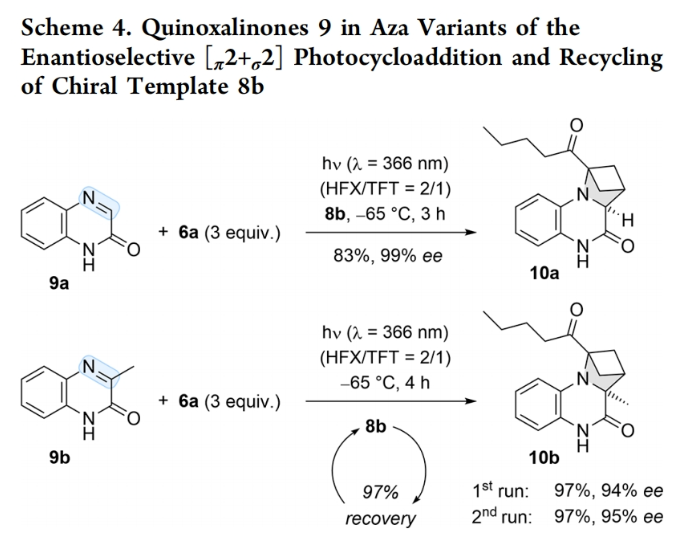
接下来,作者将该方法进一步扩展到使用含有C=N而不是C=C双键的杂环底物作为发色团(Scheme 4)。在366 nm光的直接激发下,作者使用喹啉酮9a与BCB 6a,在8b存在下实现了氮杂型[π2+σ2]光环加成反应,以83%的产率,99%的ee得到目标氮杂环丁烷产物10a。此外,当使用其3-甲基类似物9b反应时,也可以以97%的产率,94%的ee得到相应的产物10b。值得注意的是,反应中的手性络合物试剂8b可以回收再次使用且反应效率不会有所减弱。
(图片来源:J. Am. Chem. Soc.)
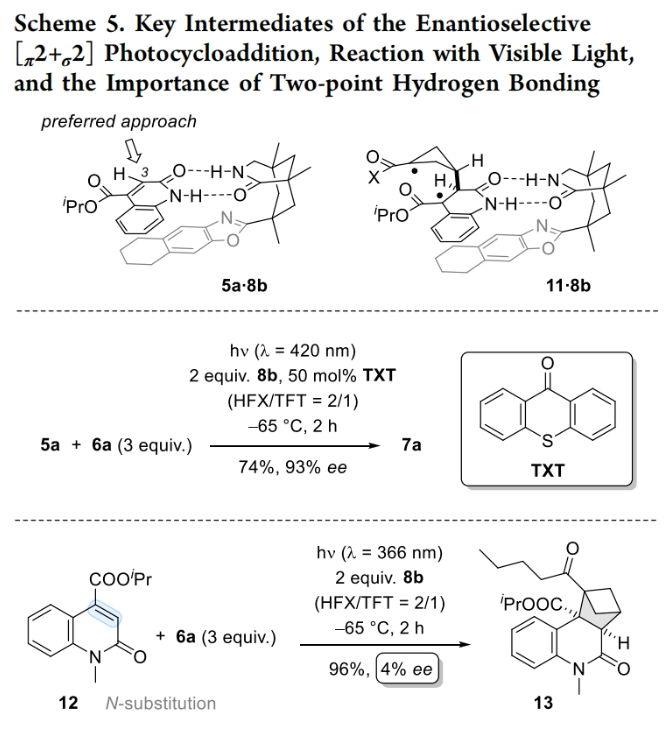
接下来,作者通过VCD(vibrational circular dichroism)波谱对对映体纯化合物7a(96% ee)进行了研究。实验结果表明,它的VCD光谱与作者所展示的两个立体中心的绝对构型为(R)-构型相匹配。并且所有其它产物的绝对构型都是通过类比来确定的。事实上,在与手性络合剂配位后,四氢萘部分很可能屏蔽了底物的一个对映异构面。该配合物的推测结构5a.8b表明,当BCB接近时,只有相对于碳中心C3的Re面可以接近BCB(Scheme 5)。由于喹诺酮类化合物可以在亚纳秒的时间尺度上通过直接照射获得高量子产率,因此作者认为反应发生在喹诺酮类化合物的三线态。此外,反应均经历一致的区域选择性表明BCB首先进攻C3碳原子,从而建立第一个立体中心,并形成双自由基11。随后经体系间交叉(ISC)后,环戊烷关环生成产物7a。为了进一步证实三线态中间体的作用,作者尝试在合适的敏化剂存在下进行对映选择性反应。当使用TXT(9-thioxanthenone)作光敏剂时,生成的产物7a与在366 nm光激发下得到的产物7a在产率和对映选择性上并没有很大的差异(74%的产率,93%的ee)。
最后,作者通过将N-甲基喹诺酮12与非取代的2(1H)-喹诺酮5a在相同的反应条件下反应,来探索两点氢键的重要性。当使用N-甲基喹诺酮12反应时,以96%的产率得到产物13,但ee仅为4%。这一实验结果强调了一个事实,即喹诺酮的Lewis碱性氧原子与酸性位点(无论是Brønsted酸还是Lewis酸)之间的非共价键周围的旋转必须被锁定,从而实现高对映选择性的面区分。
(图片来源:J. Am. Chem. Soc.)
总结
Thorsten Bach课题组发展了首例光催化2(1H)-喹诺酮与双环[1.1.0]丁烷的对映选择性[π2+σ2]环加成反应,实现了一系列手性双环[2.1.1]己烷类化合物的合成。反应中喹诺酮通过与手性络合物试剂之间的两点氢键来实现整个反应的立体控制,且手性络合物试剂可以以几乎定量的产率回收并应用于下一反应。此外,该手性络合物试剂有利于提升底物在低温下和在非极性溶剂混合物中的溶解度。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn