

正文
Peniciketal A-C(1-3)于2014年首次从真菌Penicillium raistrickii中分离获得。这些化合物具有共同的苯环、苯并环化的6,6-或6,5-螺缩酮环系统和2,8-二氧杂双环[3.3.1]壬烷部分,其绝对构型通过单晶X-射线衍射分析确定(图1)。这些结构在天然产物中并不常见,具有挑战性的骨架。Peniciketals对A549、HL-60和 K562癌细胞系表现出潜在的细胞毒性(IC50值分别为0.31、0.085和0.23 μM)。下载化学加APP到你手机,更加方便,更多收获。
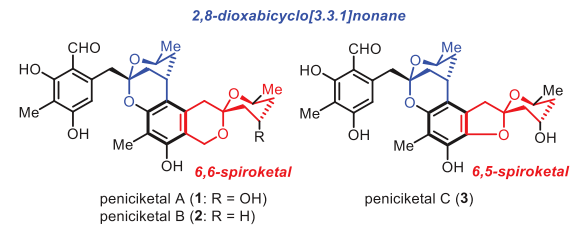
图1. Peniciketals的结构
由于其有趣的结构和生物活性,Peniciketals引起了有机化学家和生物科学家的广泛关注。然而,直到2021年,Amos B. Smith III课题组才首次报道了(+)-Peniciketal A和B的全合成,作者应用了三组分I型阴离子接力化学策略构建苯并环[6,6]螺缩酮结构以及他们开发的光异构化/环化联合方案构建复杂的苯并稠合2,8-二氧杂双环[3.3.1]壬烷骨架。尽管取得了重大进展,但通过异头效应稳定的苯环化[6,6]螺缩酮片段在酸性条件下或多或少不稳定,这可能使后续合成更具挑战性。开发一种汇聚且有效的Peniciketal合成方法,包括螺缩酮的后期构建,对于加速合成和生物活性研究是非常必要的。
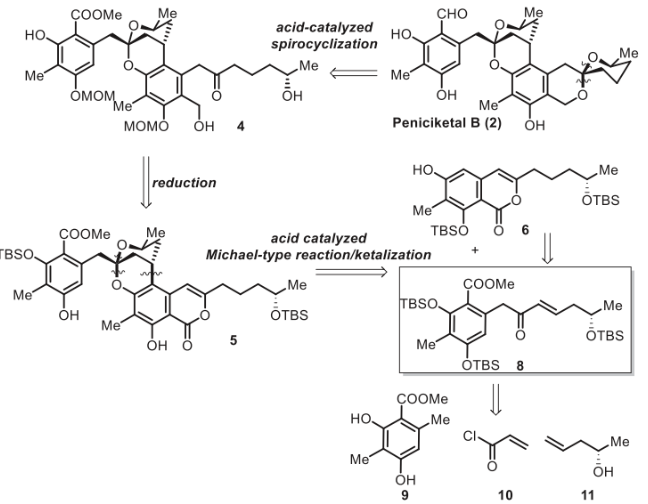
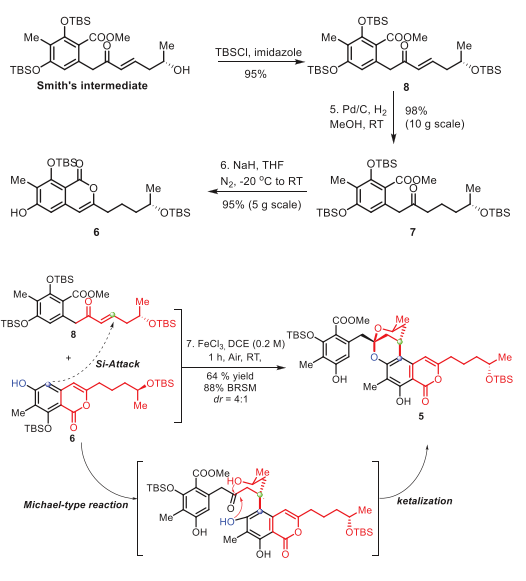
马爱军团队长期致力于高效合成结构独特的螺缩酮天然产物。在此,他们报道了(+)-Peniciketal B (2)的简明不对称全合成。逆合成分析如图2所示。首先,注意到(+)-Peniciketal B (2)的结构似乎包含了两分子化合物8的大部分结构。(+)-Peniciketal B (2)可由前体二羟基酮4通过酸催化螺环化反应生成。前体4可以通过5的内酯开环来构建。5中的苯并稠合2,8-二氧杂双环[3.3.1]壬烷结构可以通过8与6的串联分子间酸催化的连续Michael加成/双环化直接形成。然而,这种在天然产物合成中安装高度功能化片段的应用鲜有报道。这些因素使得6和8所需的串联反应极具挑战性。化合物8由手性起始原料(+)-高烯丙醇制备。
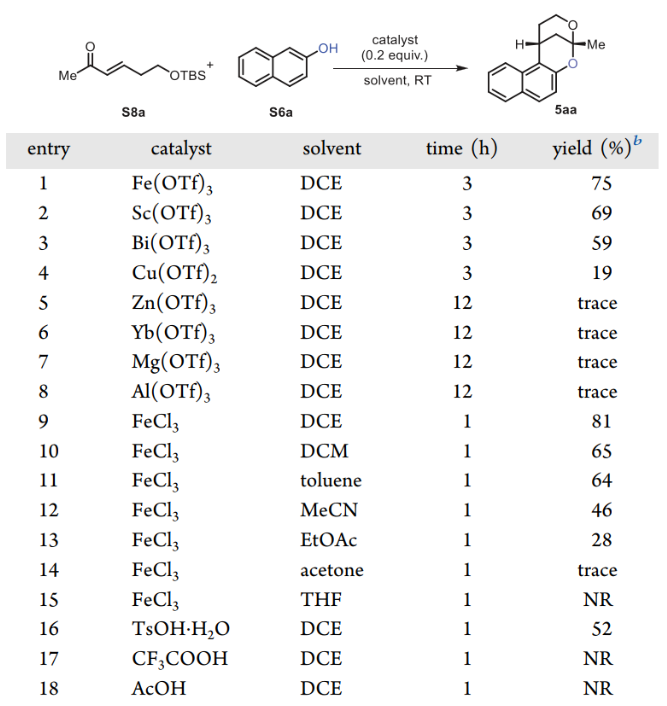
有了前体6和8,作者探索了关键的分子间催化剂控制的串联Michael-型反应/双环化过程。从模拟底物 2-萘酚S6a和S8a 开始,考虑到关键过程包括三个步骤(Michael-型反应、脱硅基化和缩酮化),首先筛选了一系列Lewis酸以找到有前景的催化剂。当使用Fe(OTf)3作为催化剂,DCE作为溶剂,成功获得了所需的产物5aa,收率75%。其他Lewis酸导致产率较低或仅得到痕量的产物。FeCl3 的产率最高,为81%,同时反应时间更短。在对不同的Brønsted酸进行简单筛选后,只有TsOH·H2O能以52%的产率得到所需的产物5aa。这一关键串联过程是在室温空气下完成的。
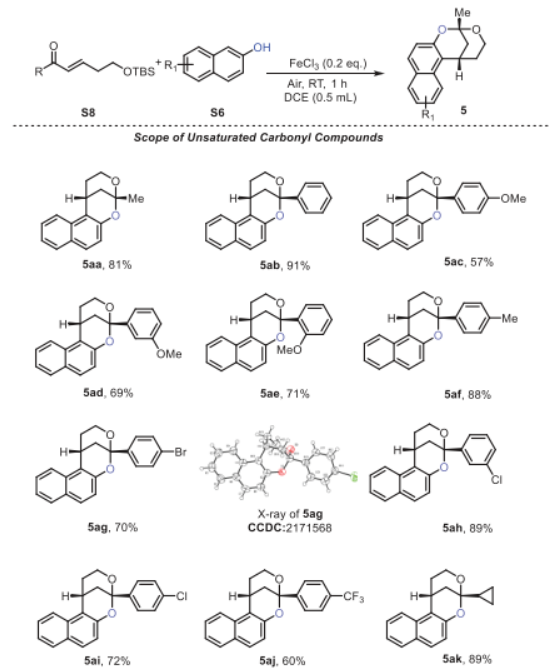
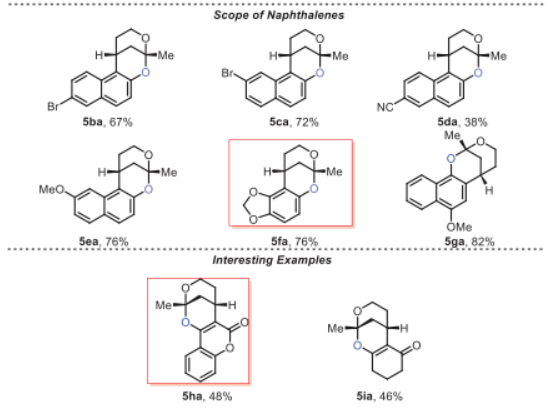
有了最佳反应条件,作者通过使用不同的底物形成各种苯并稠合2,8-二氧杂双环[3.3.1]壬烷结构来考察该策略的通用性,如图4中总结的,取代的α, β-不饱和羰基化合物和萘,在苯环上的不同位置上具有给电子基(5aa-5af和5ea-5ga)和吸电子基(5ag-5aj和5ba-5da),得到所需的苯并-稠合2,8-二氧杂双环[3.3.1]壬烷产物,产率中等至良好。通过单晶确证了5ag的相对构型。还可以耐受环丙烷取代的不饱和羰基,得到相应的产物,产率为89% (5ak)。此外,4-羟基香豆素和1,3-环己二酮也具有耐受性,并分别以48%和46%的产率提供了所需的化合物5ha和5ia。
受到这些结果的鼓舞,特别是5fa和5ha的成功合成,作者将该反应扩展到更具挑战性的化合物5的合成,该化合物具有苯并稠合的2,8-二氧杂双环[3.3.1]壬烷部分。首先,从中间体8的不对称合成开始。化合物8是由Smith中间体通过TBS保护制备的。通过氢化8得到酮7,产率98%。然后,用氢化钠的THF溶液处理化合物7,得到取代的异香豆素6,产率95%。在标准条件下,6和8反应,以 4:1 dr获得了5,分离收率为64%(基于回收的6为88%)。8的高烯丙基OTBS基团导致si-面进攻是有利的方式。值得一提的是,在此步骤中同时脱除了两个TBS基。
图片来源:Org. Lett.
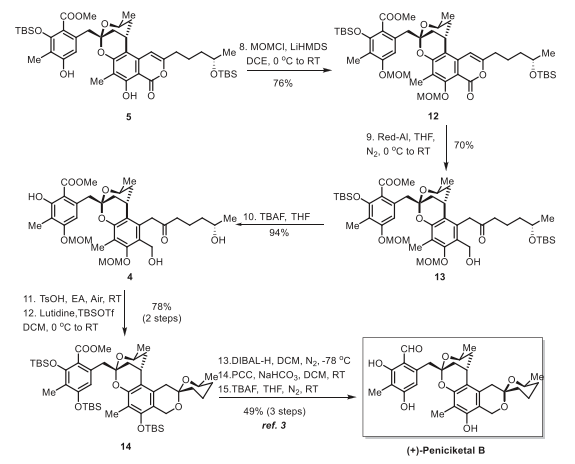
完成关键的串联反应后,继续完成(+)-Peniciketal B (2)的合成(图6)。从中间体 5开始,最初的努力旨在还原内酯羰基以得到苯并吡喃。然而,在尝试许多还原条件后都没有顺利得到期望的产物。作者将注意力转向内酯的还原开环。发现苯酚的保护在这种转变中是必要的。因此,5的酚羟基的用MOM保护以76%的产率得到化合物12,当在0 °C的THF中使用Red-Al时,内酯环迅速还原为所需的酮13,产率为70%。因此,脱去13的TBS基团得到前体4,收率94%。获得关键前体4后,接下来就是苯并环化[6,6]螺缩酮的构建。在考察了一系列酸后,发现在乙酸乙酯中用对甲苯磺酸处理4生成了苯并环化的[6,6]螺缩酮,直接TBS保护,通过两步获得了Smith中间体14,产率为78%。最后,根据文献报道,通过三步将螺酮缩醛14轻松转化为(+)-Peniciketal B (2),合成样品的所有数据与文献报道一致。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn