

(图片来源:J. Am. Chem. Soc.)
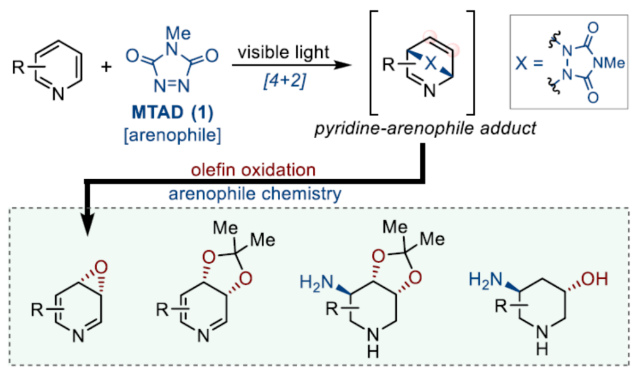
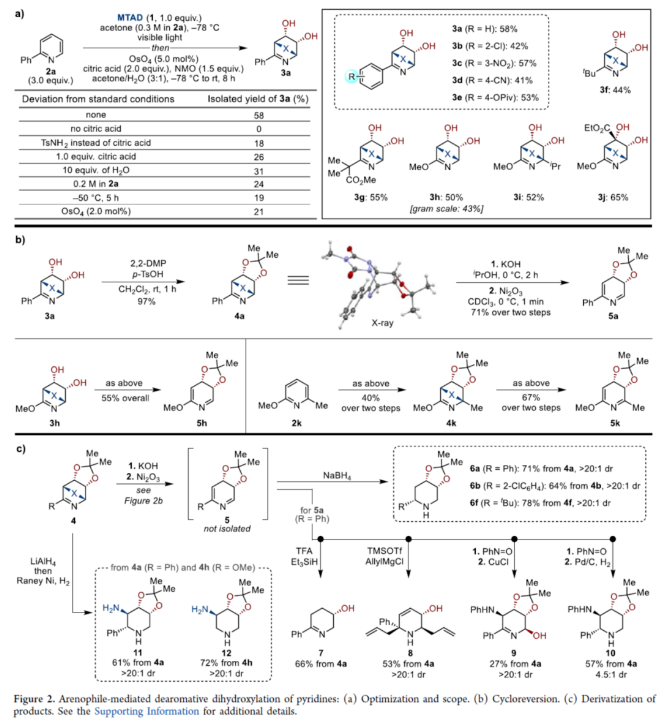
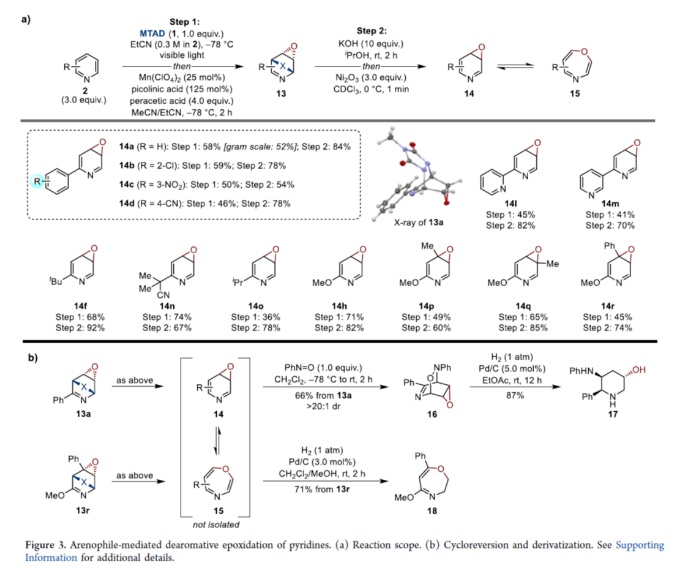
正文 在FDA批准的药物和天然产物中,含有丰富的吡啶和哌啶单元,这也推动了相关合成方法的广泛研究。同时,吡啶去芳构化是获得官能团化哌啶和相关前体的最有利策略之一,如吡啶的氢化(Figure 1a)与将亲核试剂加成至活化的吡啶鎓盐中(Figure 1b)。催化加氢的重大进展提高了化学选择性、区域选择性和立体选择性,而受阻Lewis对(frustrated Lewis pairs)的出现为传统的金属催化过程提供了一种互补的方法。目前,对于此类方法仅限于引入氢原子或形成C−C键。同时,化学酶法可进一步弥补上述的方法。在吡啶的酶促去芳构化反应中,由于二氢吡啶cis-二醇的固有不稳定性,导致芳烃双加氧酶转化为吡啶类是不成功的,从而自发地进行芳构化(Figure 1C)。此外,去芳构化环加成是一种互补的反应性,并开辟了多样化的新途径。近年来,化学家们还报道了一系列基于非活化芳烃和亲芳烃体之间的环加成的去芳构化策略,这些去芳构化策略提供了获得官能团化环己二烯的途径。近日,美国UIUC的David Sarlah课题组报道了一种亲芳烃体介导吡啶类化合物的氧化去芳构化反应,合成了一系列二氢吡啶cis-二醇和环氧化物(Figure 1D)。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:J. Am. Chem. Soc.) 首先,作者以2-苯基吡啶2a作为模型底物,进行了相关反应条件的筛选(Figure 2a)。2a与N-甲基-1,2,4-三唑啉-3,5-二酮1(MTAD,1.0 equiv)在可见光照射下,在丙酮溶剂中-78 oC反应12 h。随后,以OsO4(5.0 mol %)作为氧化剂,柠檬酸(2.0 equiv)作为添加剂,NMO(1.5 equiv)作为氧化剂,在丙酮/水(比例为3:1)的混合溶剂中反应8 h,可以58%的收率得到二醇产物3a。 其次,采用上述的一锅两步法,作者对底物范围进行了扩展(Figure 2a)。当吡啶的2-位含有不同电性取代的芳基、烷基、烷氧基时,也能够顺利进行反应,获得相应的产物3a-3h,收率为41-58%。同时,2,6-和2,4-二取代吡啶,也与体系兼容,获得相应的产物3i(收率为52%)和3j(收率为65%)。 同时,作者还对环翻转反应(cycloreversion)进行了研究(Figure 2b)。由于二氢吡啶cis-二醇的异常不稳定性,其自发地经历了消除和芳构化。因此,3a在2,2-DMP/p-TsOH条件下进行二羟基的保护,可以97%的收率得到化合物4a。4a在KOH/iPrOH以及Ni2O3/CDCl3条件下分别进行水解与环翻转反应,可以两步71%的收率得到二氢吡啶cis-二醇缩丙酮化合物5a。该策略还可应用于其他具有代表性的二醇底物,如5h和5k。 紧接着,作者对反应的实用性进行了研究(Figure 2c)。首先,化合物4在NaBH4条件下进行还原反应,可获得相应的二羟基哌啶衍生物6a、6b和6f,收率为64-78%,dr > 20:1。其次,4a在TFA/Et3SiH条件下进行离子还原反应,可以66%的收率得到单羟基亚胺化合物7。4a在TMSOTf/AllylMgCl条件下进行离子取代反应,可以53%的收率得到双加合物8。同时,5a以高度非对映和区域选择性的方式与亚硝苯反应,相应的环加合物用CuCl进行N−O键断裂或氢解,可获得官能团化的哌啶衍生物9(收率为27%)和10(收率为57%)。此外,化合物4在LiAlH4以及Raney-Ni条件下还原,可获得相应的氨基羟基哌啶衍生物11(收率为61%)和12(收率为72%)。 (图片来源:J. Am. Chem. Soc.) 随后,通过对反应条件的优化后发现,仅需两步反应即实现吡啶氧化物的合成(2→13→14,Figure 3a)。同时,吡啶氧化物14很容易互变异构化为1,4-oxazapine(15)。并且,作者还对底物范围进行了扩展。研究结果表明,当吡啶底物中的2-位含有不同取代的芳基、杂芳基、烷基与烷氧基时,均可顺利反应,获得相应的吡啶氧化物14a-14r,第一步收率为36-74%,第二步收率为54-92%。值得注意的是,上述的环氧化策略简化了吡啶氧化物的制备,与先前使用吡啶和2-吡啶酮的电环化或断裂的5步和6步方法相比,具有显著进步。此外,作者还对环翻转反应与衍生化进行了研究(Figure 3b)。首先,由双环化合物13a制备的6-苯基吡啶3,4-氧化物(14a)在PhN=O/CH2Cl2条件下反应,可以66%的收率得到双环羟胺衍生物16。其次,化合物16在H2/Pd/C条件下进行还原反应,可以87%的收率得到氨基羟基哌啶衍生物17。此外,化合物15r在在H2/Pd/C条件下进行氢解反应,可以71%的收率得到二氢-1,4- oxazepine衍生物18。 (图片来源:J. Am. Chem. Soc.) 总结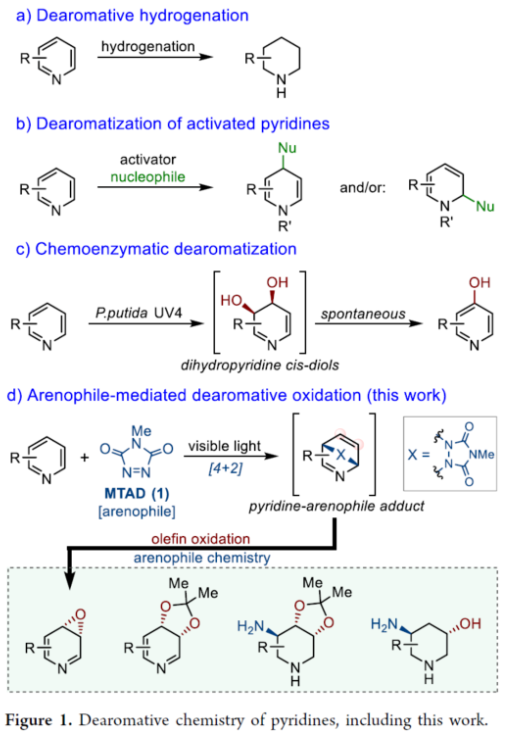
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn