- 首页
- 资讯
兰大陈小明课题组JACS:五味子三萜 Rubriflordilactone A的全合成
来源:化学加 2024-03-10
导读:近日,兰州大学功能有机分子化学国家重点实验室陈小明课题组在天然产物合成领域取得新进展,完成了五味子三萜天然产物 Rubriflordilactone A 的全合成,该策略的创新性包括:1) 基于从中心苯环出发的策略设计先后实现ABC环和FG环的构筑;2) 首次实现呋喃内酯作为亲电受体的Prins环化,完成七元C环合成;3) Mukaiyama hydration/oxa-Michael串联反应合成B环;4) 发展了o-QM (邻亚甲基醌) 型[4+2]环加成方法学,通过远程立体控制实现F环的非对映选择性合成。相关研究近期在线发表于J. Am. Chem. Soc. 2024, 146, DOI:https://doi.org/10.1021/jacs.4c01033
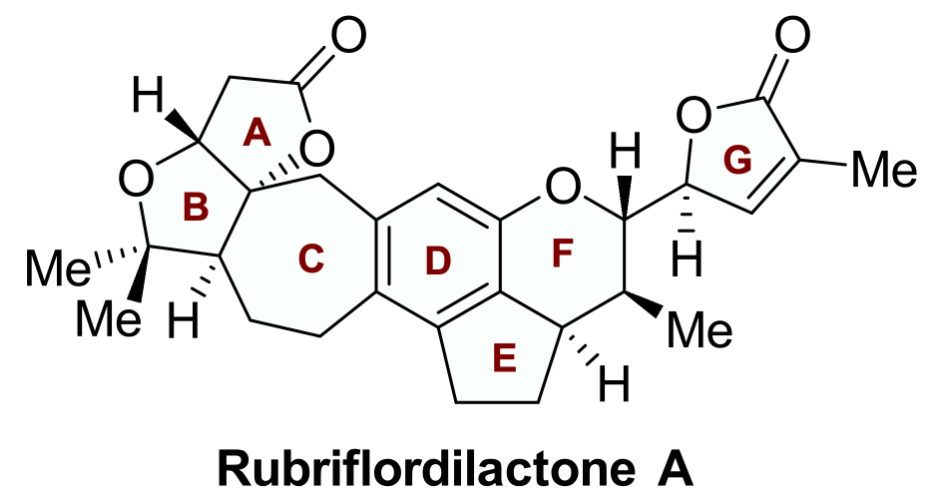
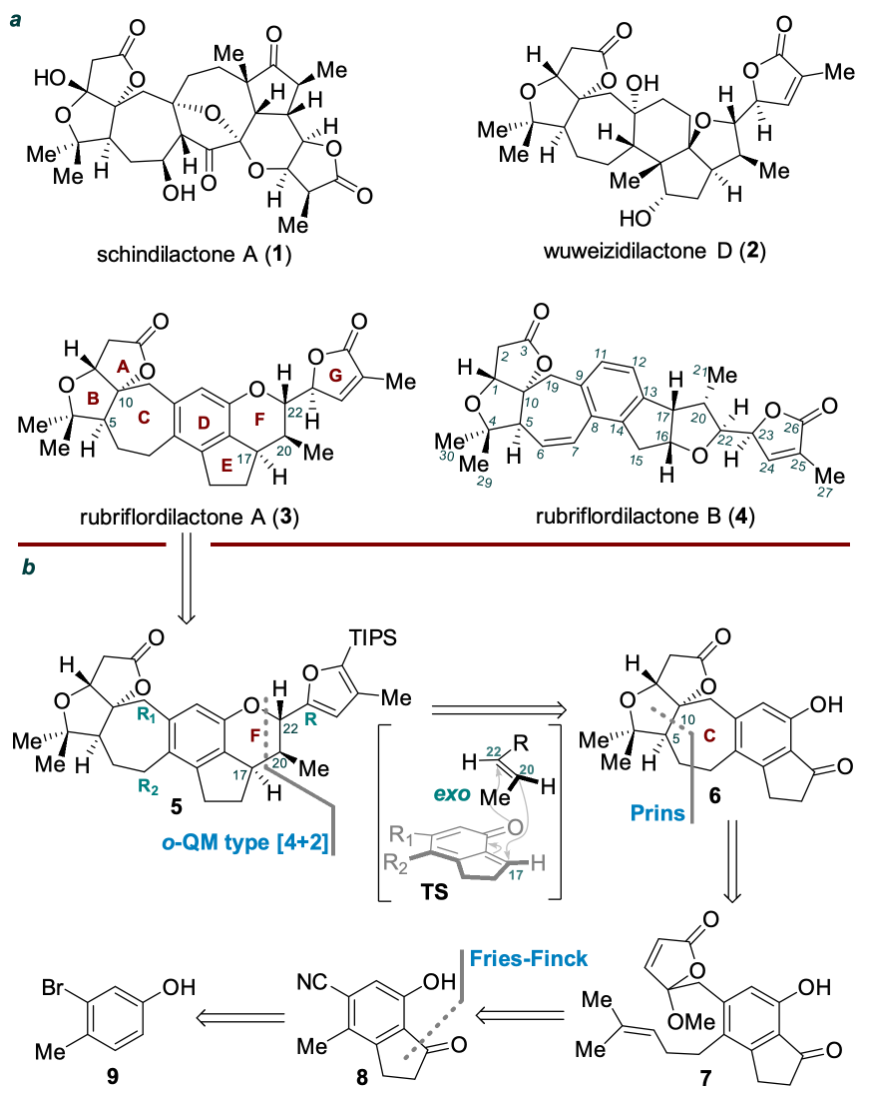
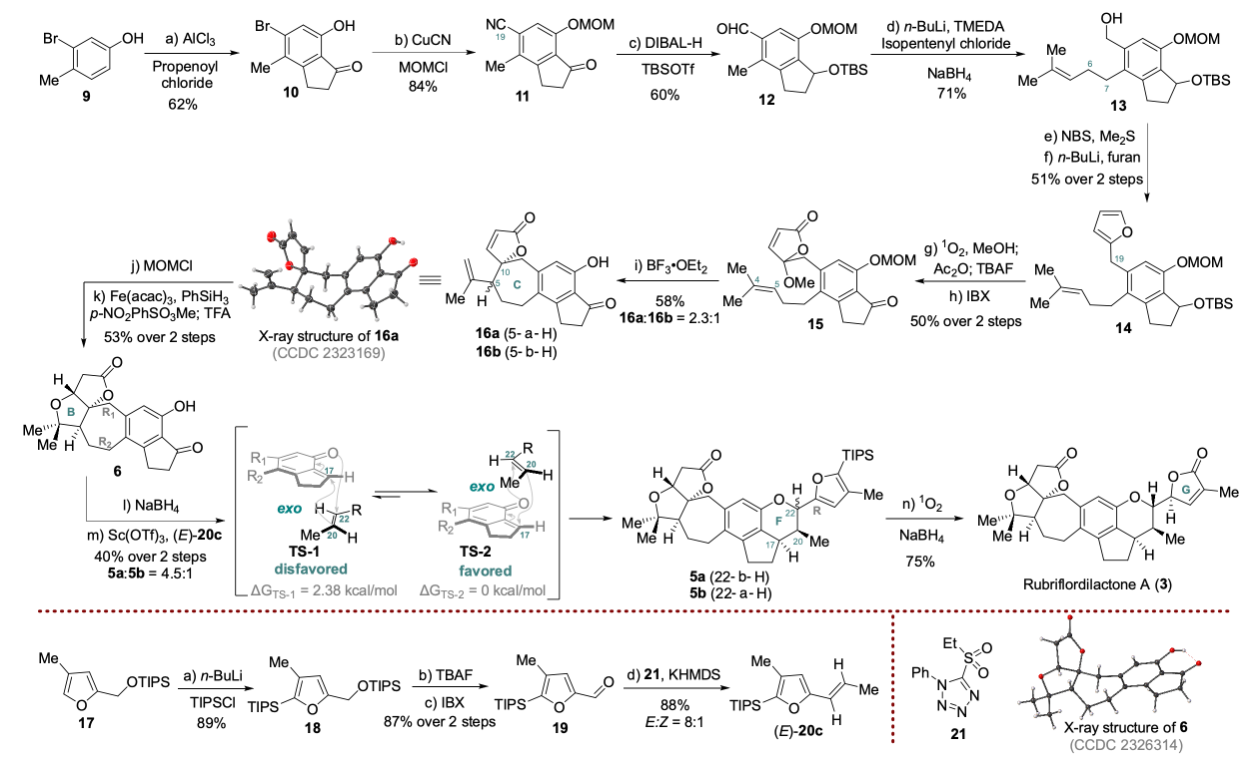
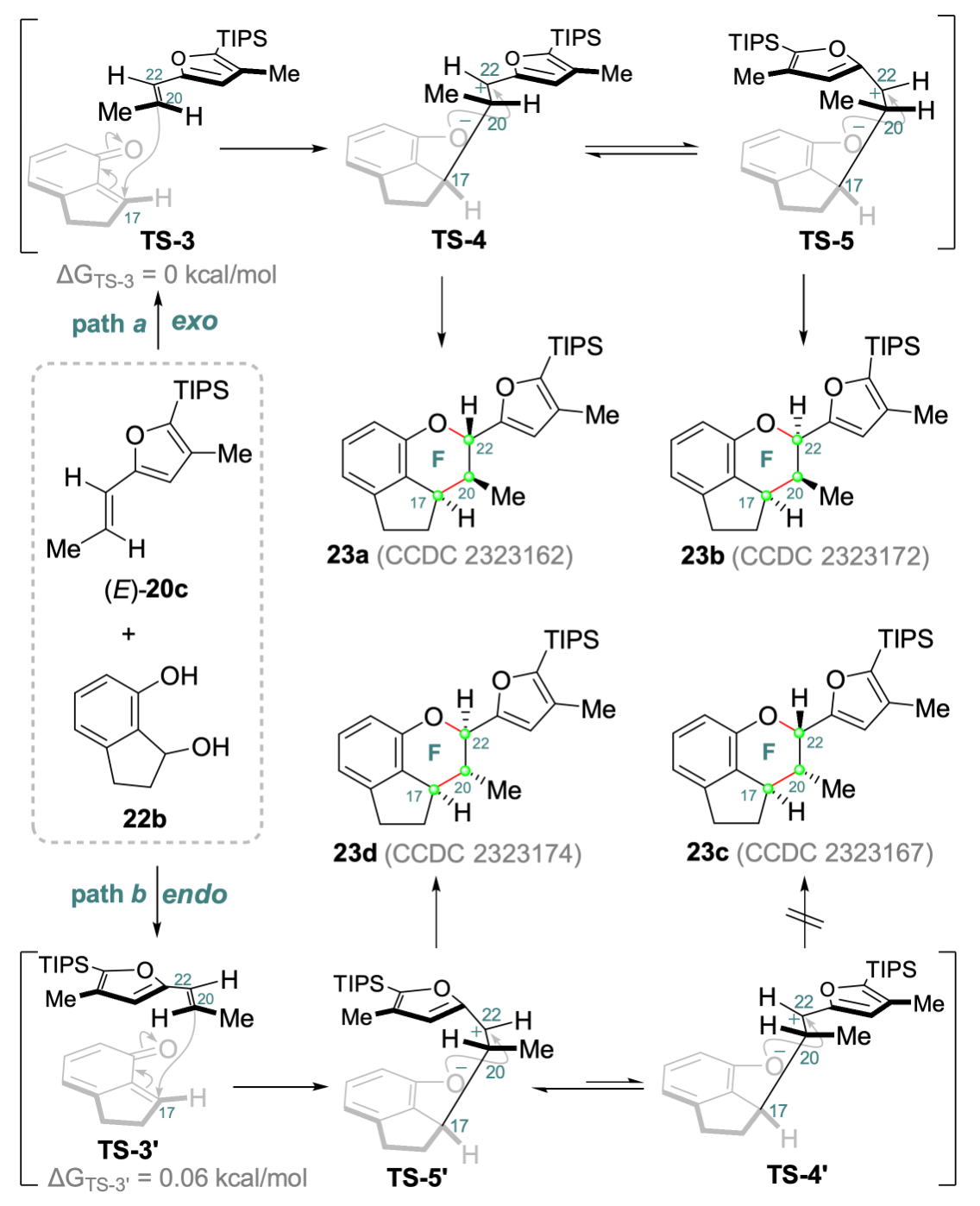
五味子是中国传统中药,其中蕴含大量活性天然产物,主要是三萜天然产物,迄今为止约有500个三萜天然产物被分离报道,超过180个含有相似的AB内酯环。Rubriflordilactone A是中国科学院昆明植物研究所孙汉董院士团队2006年从中药红花五味子 (Schisandra rubriflora) 中分离得到的含有AB内酯环和五取代苯环的三萜天然产物。五味子三萜因其结构多样、立体化学密集和良好的生物活性受到广泛关注。中国科学院上海有机化学研究所李昂课题组 (2014年) 和牛津大学Edward A. Anderson课题组 (2015年) 分别采用聚焦于苯环合成的汇聚式策略完成了Rubriflordilactone A的不对称全合成。陈小明课题组发展了基于从中心苯环出发的策略先后实现ABC环和FG环的构筑,最终完成Rubriflordilactone A的合成。图1. Rubriflordilactone A的结构(图片来源:J. Am. Chem. Soc.)Rubriflordilactone A的逆合成分析如图2所示,为完成该分子的高效合成,作者采用了模块化汇聚式策略。通过o-QM type [4+2]环加成从化合物6出发合成化合物5。化合物6可由化合物7通过呋喃内酯作为亲电受体的Prins环化得到。化合物7可以由茚酮8通过氰基还原及后续导向的邻位金属化烷基化获得,而多取代茚酮8可以从苯酚9出发通过Fries-Finck/Nazarov串联反应合成。 图2. 代表性的五味子降三萜及Rubriflordilactone A的逆合成分析(图片来源:J. Am. Chem. Soc.) 从商业可得的苯酚9出发 (图3),通过三氯化铝催化的Fries-Finck/Nazarov串联环化一锅法合成茚酮10;Rosenmund-von Braun氰基化和MOM保护酚羟基合成五取代茚酮11;接着DIBAL-H还原氰基和茚酮羰基,TBS保护羟基得到化合物12;通过醛基导向的邻位金属化 (Directed-ortho-Metalation) 烷基化实现侧链引入,随后还原醛基合成苄醇13;苄醇13在NBS-Me2S条件下溴代,直接与呋喃锂进行烷基化得到化合物14,通过光催化氧化构筑呋喃内酯环,脱除TBS保护基氧化得到化合物15。 图3. Rubriflordilactone A的全合成 (图片来源:J. Am. Chem. Soc.)对于C环的构筑是合成Rubriflordilactone A的关键,作者通过挑战性的呋喃内酯为亲电受体的Prins环化实现C环七元环的构建 (呋喃内酯作为亲电受体的Prins环化未见报道)。作者对Prins环化条件进行筛选,最终发现三氟化硼乙醚能够促使呋喃内酯化合物15进行Prins环化得到C环构筑产物16a与16b,但收率比较低,通过单晶结构发现化合物16a的相对构型与天然产物一致。进一步的条件优化筛选发现反应体系中加入2-甲基-2-丁烯和4 Å分子筛能够提高Prins环化的收率 (58%)。随后作者利用Studer课题组发展的Mukaiyama水合条件串联oxa-Michael加成合成化合物6,完成Rubriflordilactone A中A/B/C/D/E五环骨架的构筑。为实现F环立体选择性构筑,作者首先采取模板底物尝试。利用22b作为双烯体与亲双烯体 (E)-20c开展条件筛选,最终实现了o-QM type [4+2]环加成反应,获得具有D/E/F/G环体系的三个异构体23a, 23b和23d,并通过单晶进行了结构确证,发现化合物23a的相对构型与天然产物Rubriflordilactone A构型一致,但在反应过程中没有观察到异构体23c生成。作者对这种生成立体异构体多样性的o-QM type [4+2]环加成进行机理推测,认为该反应采取了分步过程(图4):化合物22b在Lewis acid催化下生成邻亚甲基醌,随后以Endo和Exo方式与 (E)-20c进行加成,生成C17–C20化学键并恢复苯环结构,随后酚氧负离子与C-22进行环化得到化合物23a和23d,由于苯环与呋喃环之间的π-π stacking作用使得TS-4过渡态中C20–C22键易于旋转而生成23b,但过渡态TS-5’ 中C20–C22键旋转时需较高的能量破坏已存在的π-π stacking作用,因此没有观察到23c生成。 图4. o-QM type [4+2]环加成反应机理的推测(图片来源:J. Am. Chem. Soc.) 在模拟反应成功的基础上,作者探索通过o-QM type [4+2]环加成从化合物6出发实现Rubriflordilactone A的合成。还原茚酮6后与化合物(E)-20c在Sc(OTf)3的催化下进行反应,作者成功合成了具有Rubriflordilactone A所有七环骨架的化合物5。但结果却非常意外和幸运,只得到了从顶面 (top-face,TS-2) 加成的产物,却未观测到底面 (bottom-face,TS-1) 加成产物。经构象分析及DFT计算,作者认为由于A/B/C三环体系构象对[4+2]环加成产生了远程立体控制效应,导致环加成反应具有面选择性,同时这种效应也一定程度上阻碍了π-π stacking作用从而降低了C-22位差向异构体5b的比例。最终,化合物5a经过光催化的氧化后还原最终以14步完成了 (±)-Rubriflordilactone A的全合成。综上所述,兰州大学陈小明课题组发展了基于中心苯环出发的策略先后实现ABC环和FG环构筑完成了五味子三萜天然产物Rubriflordilactone A的合成;首次实现以呋喃内酯作为亲电受体的分子内Prins环化,完成七元环 (C环) 的合成;Mukaiyama hydration/oxa-Michael串联反应合成B环;远程立体控制的分子间o-QM type [4+2]环加成立体选择性构筑F环,并实现Rubriflordilactone A骨架合成。最终以14步完成五味子三萜天然产物 Rubriflordilactone A的全合成。该论文的第一作者为兰州大学博士研究生郑旭东,相关工作得到国家自然科学基金、甘肃省基金和中央高校基金以及功能有机分子化学国家重点实验室的大力支持,成果发表于(J. Am. Chem. Soc. 2024, 146, DOI:https://doi.org/10.1021/jacs.4c01033)。
文献详情:
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn