

(图片来源:J. Am. Chem. Soc.)
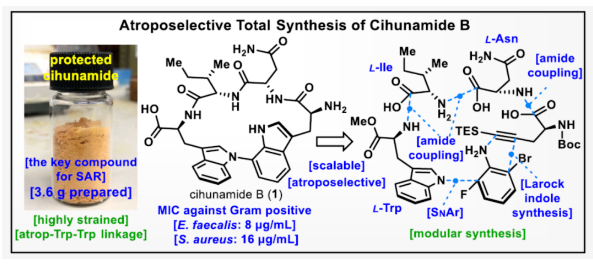
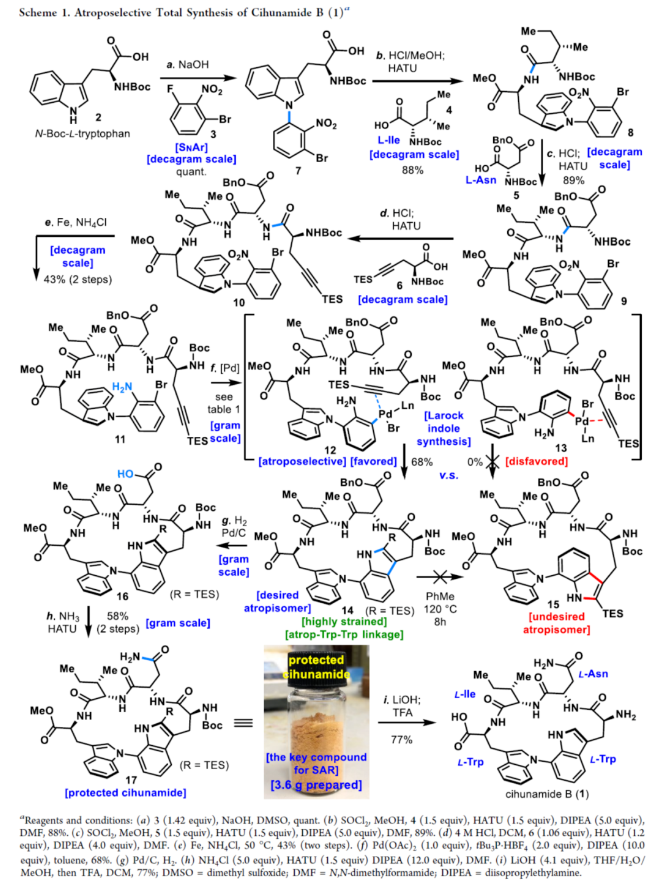
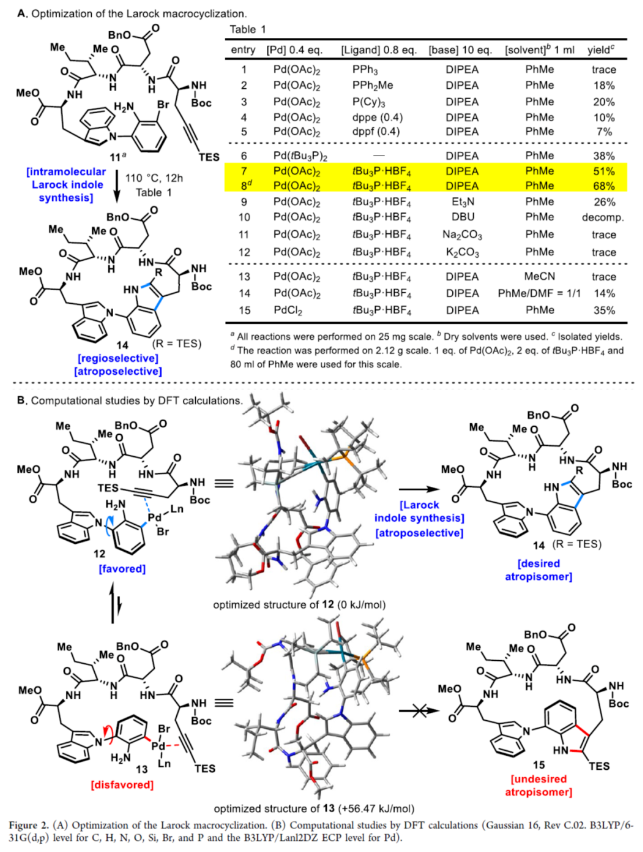
正文 具有阻转异构体骨架的分子广泛存在于人工催化剂、天然产物和药物中。近年来,化学家们开发了一系列阻转异构体的选择性合成方法。最近,Kim和Oh等人从韩国济州岛附近的深海海洋沉积物中分离出一种环状肽,即Cihunamide B(1)。在结构上,它具有前所未有的结构,在由四个天然氨基酸单元组成的高张力的稠合大环肽内具有阻转异构体Trp-Trp交联(Figure 1)。通过电子圆二色性(ECD)光谱和DFT计算确定了Cihunamides的阻转异构构型。在生物活性方面,它对革兰氏阳性病原体表现出抗菌活性,使其成为潜在的药物发现抗生素种子化合物。然而,由于仅从自然界中分离出1.2 mg的Cihunamide B(1),其参与生物活性研究的机制细节尚不清楚。1的生物合成途径涉及CYP450催化的两种色氨酸之间的C−N键的氧化形成。下载化学加APP到你手机,收获更多商业合作机会。 近年来,化学家们已报道了一系列具有抗菌活性的环状肽的全合成。2022年,Sarlah和Baran课题组分别报道了Darobactin A的全合成,这是一种双环肽,其特征是两个色氨酸残基之间存在前所未有的连接,每个残基都具有阻转异构体的特性。最近,Baran课题组还报道了Dynobactin A的首次全合成,这是另一种双环肽天然产物,对类似于Darobactin A的革兰氏阴性病原体表现出强大的抗菌活性。此外,环状肽内的二芳基键充当芳香族化合物之间的键,产生异常坚固的键,其稳定性和刚性超过传统环状肽,从而有助于保持其立体结构。同时,具有二芳基连接的环状肽表现出广泛的显著生物活性。然而,尽管Cihunamide B(1)具有结构和生物活性的吸引力,但该化合物的合成方法尚未报道。近日,香港科技大学Hugh Nakamura课题组报道了一种简短与阻转选择性合成Cihunamide B(1)的方法。 首先,作者进行了相关的逆合成分析(Figure 1)。以廉价易得的砌块L-色氨酸衍生物2、1-溴-3-氟-2-硝基苯3、L-异亮氨酸衍生物4、L-天冬氨酸衍生物5和炔烃衍生物6作为起始底物。通过3与色氨酸衍生物2的SNAr反应引入芳环,然后用6的炔烃单元进行分子内Larock吲哚合成,从而合成前所未有的独特的atrop-C−N键。 (图片来源:J. Am. Chem. Soc.) Cihunamide B(1)的全合成如下(Scheme 1):以1-溴-3-氟-2-硝基苯3和N-Boc-色氨酸衍生物2为初始底物,在NaOH/DMSO条件下进行SNAr反应,可以定量的收率得到中间体7。值得注意的是,SNAr反应在40 g的规模上进行,并且在没有任何副反应(例如外消旋化)的情况下,同样可以定量的收率得到中间体7。同时,游离的羧酸对于防止外消旋化是重要的。中间体7与L-异亮氨酸衍生物4在SOCl2/MeOH/HATU/DIPEA条件下分别进行脱Boc保护、甲基酯化反应与酰胺偶联反应,可以88%的收率得到中间体8。中间体8与L-天冬氨酸衍生物5在SOCl2/MeOH/HATU/DIPEA条件下分别进行脱Boc保护与酰胺偶联反应,可以89%的收率得到中间体9。中间体9与炔烃衍生物6(含有体积更大的TES基团)在4M HCl/DCM/HATU/DIPEA条件下进行脱Boc保护与酰胺偶联反应,可以89%的收率得到中间体10。中间体10在Fe/NH4Cl条件下进行还原反应,可以两步43%的收率得到环化前体11。 通过对环化前体11的Larock大环化反应的条件筛选后发现(Figure 2A),当以Pd(OAc)2(1.0 equiv)作为催化剂,tBu3P·HBF4(2.0 equiv)作为配体,DIPEA(10.0 equiv)作为碱,在甲苯溶剂中110 oC反应12 h,可以68%的收率得到具有atro-Trp-Trp键的高度张力的环肽14。值得注意的是,该环化过程具有完美的阻转选择性。首先,在环化前体11的Larock大环化中,Pd与Ar−Br键发生氧化加成,生成中间体12。然后,中间体12进行区域选择性迁移插入到相邻的三键上,避开TES基团,获得具有所需的atrop-Trp-Trp键的环肽14。同时,通过1H NMR实验发现,环肽14中的atrop-C−N键在热力学上是稳定的。此外,作者还通过相关的DFT计算对Larock大环化的阻转选择性进行了研究(Figure 2B)。计算结果表明,中间体12具有压倒性的稳定性。同时,由于炔烃和苯胺部分的手性相对排列,而不是简单的空间避免,12而不是13的形成导致具有较小张力的环。 随后,中间体14在Pd/C/H2条件下进行氢化反应,并在NH4Cl/HATU/DIPEA/DMF条件下进行酰胺化反应,可以两步58%的收率得到受保护的Cihunamide 17。受保护的Cihunamide 17在LiOH/THF/H2O/MeOH条件下进行酯的水解反应,并在TFA/DCM条件下进行Boc和TES的脱保护,可以77%的收率得到Cihunamide B(1)。 (图片来源:J. Am. Chem. Soc.) (图片来源:J. Am. Chem. Soc.) 总结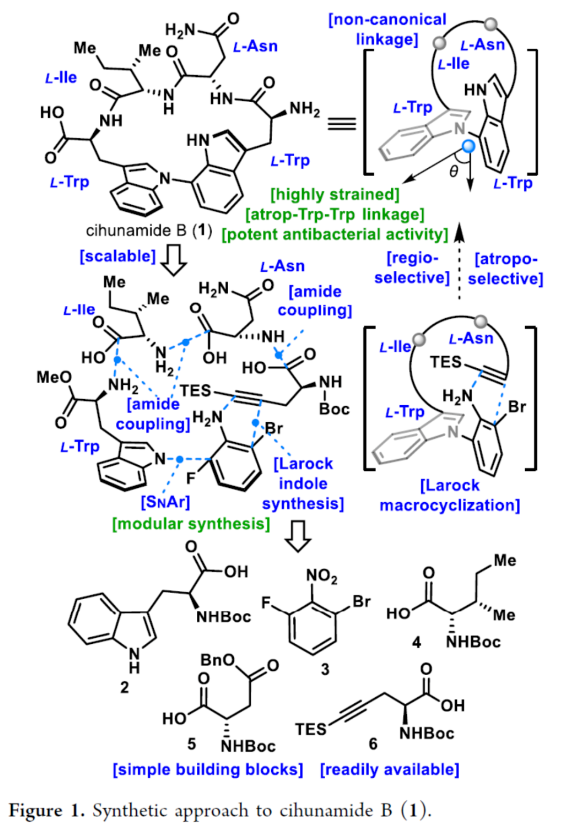
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn