- 首页
- 资讯
江智勇课题组Nat. Chem.:通过‘敏化启动电子转移’的光氧化还原策略实现不对称De Mayo类反应
来源:江智勇课题组 2024-04-02
导读:可见光驱动的光氧化还原催化是有机合成的强大工具。然而,光敏剂本身有限的氧化还原电位范围,将不可避免地限制它们的进一步的发展。江智勇课题组报道了一个以DPZ作为可见光光敏剂,含芘基的手性磷酸作为共敏剂的双催化剂平台,并证明了这种敏化启动电子转移(SenIET)策略在不对称De Mayo类反应中的适用性。该催化形式能使热力学上不利的电子转移过程发生,从而关闭氧化还原循环,并获得具有广泛底物范围的对映体富集的1,5-二酮类产物。
可见光介导的光氧化还原催化是现代自由基化学中一种温和,绿色,可持续的合成方法,在构建小分子和聚合物方面有着广泛的应用。然而,由于可见光光子能量有限(<300KJ/mol),同时被激发的可见光光敏剂会通过内转换(IC)、系间窜越(ISC)等过程损失掉一部分能量,使得光敏剂的氧化还原电位限定在较小的范围内。导致所能适用的底物及反应类型受到限制。针对上述科学挑战,König等发展了基于多光子激发的SenIET概念,通过利用可见光和光敏剂解决了光氧化还原循环中热力学限制带来的挑战(图1B)。该方案成功的关键在于使用了多环芳烃(PAHs)作为共敏化剂,以实现两个独立敏化剂之间的多光子能量转移。这种能量积累过程是通过激发光敏剂的三线态能量转移(EnT)实现的,它赋予了三重态多环芳烃(3PAHs)足够的氧化还原电位,使其成为更强的光氧化还原催化剂,从而允许热力学上不利的电子转移过程。虽然SenIET策略在概念上突破了传统的光氧化还原催化中瓶颈,但是在实际实践中,仅有为数不多例子,并且对其在不对称合成中的研究也未有报道,突出表明这项研究仍然处于起步阶段。下载化学加APP到你手机,收获更多商业合作机会。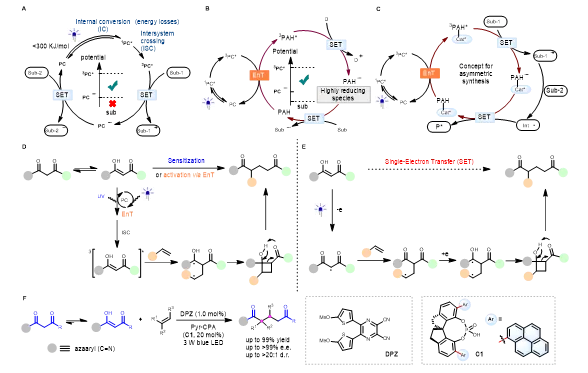
为此,作者基于SenIET的策略,猜想用还原性底物(Sub-1)取代以报道SenIET中的外部电子供体(D)(图1C)。由此产生的自由基阳离子(Sub-1•+)和另一底物(Sub-2)之间通过后续反应,将创建一个更加原子经济性的氧化还原中性催化平台。此外,作者设想在手性催化剂(Cat *-PAH)的框架上组装多环芳烃可能有望实现 不对称的SenIET过程。研究结果也表明,含PAH手性催化剂的激发态既可以作为氧化还原作用中心,又可以通过氢键作用形成溶剂笼效应,提供手性催化环境。在此,作者论证了这一试验性设想的可行性,并把该策略成功运用在De Mayo类反应中。 De Mayo反应于1962年被报道并广泛用于合成1,5-双羰基化合物,如萜烯、生物碱等天然产物的全合成。De Mayo反应是通过紫外光激发或者能量转移敏化使 1,3-二酮底物激发成三线态(图1D)。由于1,3-二酮底物在激发过程中并不需要手性催化剂参与,在不对成研究中会造成很强消旋背景反应,成为一项长期的科学难题。作者认为1,3-二酮的烯醇具有一定的还原性,可以看作一种潜在的电子供体,取代了外部电子供体(D),通过SenIET过程,单电子还原较低氧化能力的2-吡啶羰基类反应底物,完成了光氧化还原催化的De Mayo类反应(图1E)。因此,作者通过建立DPZ作为光敏剂,C1作为手性催化剂和共敏剂,实现了氮杂芳烃活化的1,3-二酮与各种无环烯烃和环烯烃有效地反应,以获得具有不同类型立体中心的对映体的1,5-二酮(图1F)。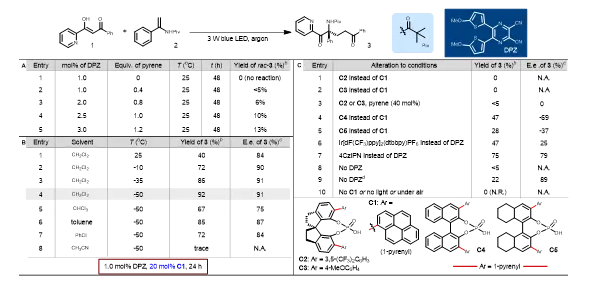
图2. 反应条件优化
作者起始选择1和2作为模型底物进行了研究。首先反应在仅用 DPZ 的条件下是无法进行(条目1,图2A)。随后作者使用C1与 DPZ 协同进行了不对称反应尝试。在25 °C时,以40%的收率和84% e.e.得到产物3(条目1,图2B)。发现降低温度可以提高转化率和对映体选择性(条目2-4,图2B),在-50 °C时,以92%的收率和91% e.e.得到产物3(条目4,图2B)。随后进行了一系列的对照实验。首先,当使用SPINOL-CPA(C2和C3)代替C1(条目1-2,图2C)时没有观察到反应,并且加入额外的40 mol%芘导致痕量3但没有e.e.(条目3,图2C)。使用BINOL- 和 H8-BINOL-CPA(C4和C5)分别导致-69%和-37% e.e.(条目4-5,图2C)。因此,CPA 的芘基对于转化的发生是必不可少的,并且 CPA 的手性骨架对于实现足够的对映体控制是至关重要的。当反应体系中未加DPZ ,在24小时内基本上没有检测到产品3(条目8,图2C)。最后,条目10的结果清楚地表明,手性催化剂、可见光和无氧环境对转化的发生是至关重要的。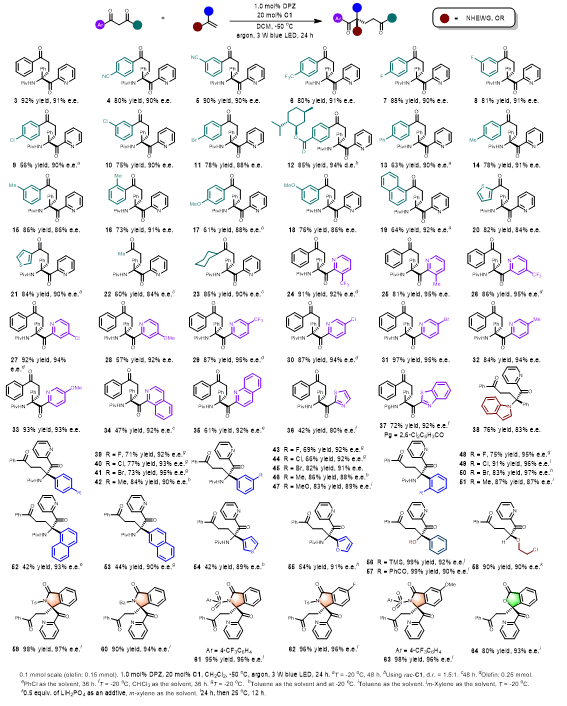
表格来源:Nat. Chem.
在最佳条件下,作者对反应的底物范围进行了拓展。如表1所示,对不同取代基的芳烃、稠环、杂环以及烷基的1,3-二酮有良好的耐受性。而且对于在2-吡啶环上具有不同取代基以及其它氮杂芳烃也被证明是有效的。对于富电子烯烃方面包括了各种非环状及环状烯胺、烯醚均可以获得了优异的对映体选择性。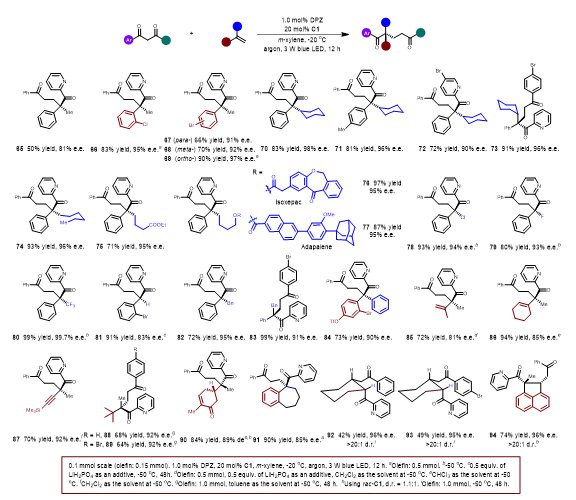
表2. 1,3-二酮与电子中性和弱缺电烯烃的转化。
随后拓展了电中性和弱缺电子烯烃(表2)。首先选择α-烷基芳基乙烯在稍微改进的反应条件下,作者得到了全碳四元立体中心的多种1,5-二酮。当α-烷基改为Cl,F 和 CF3时,这些弱缺电子烯烃的转化仍然以高产率产生所需的产物。满意的结果促使作者挑战1,1-二芳基乙烯实现了双芳基取代的季碳立体中心构建,作者对1,3-二烯烃和1,3-烯炔烃进行了测试,产物具有高产率和表观良好的区域和对映选择性。1,1-二烷基乙烯同样可以得到了具有优异对映选择性的产物。同时作者对外环末端烯烃和环内烯烃进行考察,产生具有高对映和非对映选择性的产物。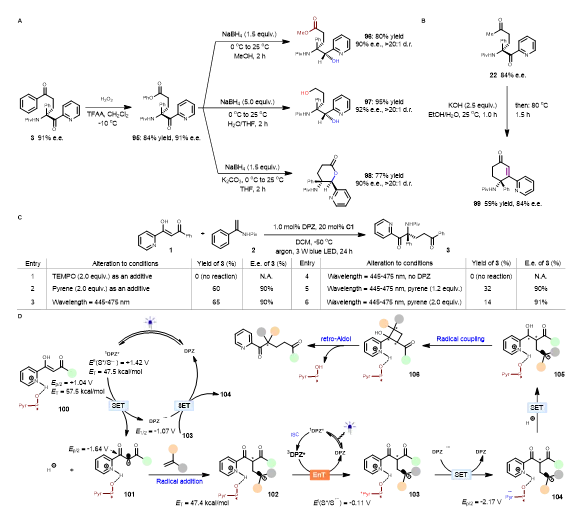
图片来源:Nat.Chem.
作者为了证明该反应实用性,首先选择产物3进行了化学修饰(图3A)。经过 Baeyer-Villiger氧化重排得到95。之后使用硼氢化钠对95进行还原得到三种不同的产品(96-98)。首先,使用甲醇作为溶剂可以还原酮并与甲醇发生酯交换反应,得到96。以 H2O/THF为混合溶剂,还原得到97。最后,THF作为溶剂并加入K2CO3,还原酮发生分子内酯交换得到98。所有的转换都保持了对映选择性并表现出良好的非对映选择性。作者还对22进行了羟醛缩合反应得到99。为了了解反应机理作者进行了一系列控制实验(图3C)。首先,在标准条件下加入TEMPO,发现反应被完全抑制,证明了自由基过程的存在(条目1,图3C)。此外,在标准条件下加入芘,反应被抑制,证明了能量转移过程的存在(条目2,图3C)。然而,* DPZ(47.5 kcal/mol)的激发态能量不足以通过EnT 使1(ET = 57.5 kcal/mol)被敏化。就氧化还原电位和Stern-Volmer实验(参见SI图5和6)而言,* DPZ 对1的单电子氧化作为反应的启动是合理的,但是DPZ•– (E1/2(S/S•–) = –1.07 V vs SCE in CH3CN) 不能进一步将质子化的吡啶取代的酮羰基 (Ep/2(S/S•–) = –1.64 V vs SCE in CH3CN) 还原以关闭氧化还原循环。考虑到 CPA的芘基不可或缺的作用(条目1-2,图2C)和游离芘(条目5-6,图3C)引起的梯度抑制效应,提出了* DPZ和C1的芘基 (3Pyr,ET = 47.4 kcal/mol) 之间的 SenIET途径:通过可见光激发的* DPZ ,通过能量转移产生激发3Pyr (Et(S*/S•–) = –0.11 V), 其很容易被体系中的DPZ•– (E1/2(S/S•–) = –1.07 V vs SCE in CH3CN)单电子还原,C1的芘自由基阴离子(Pyr •-,Ep/2(S/S • -)(S/S • -) = -2.17 V)具有足够的氧化还原电位。基于上述实验和前人的报道,作者提出了合理的反应机理(图3D)。首先*DPZ发生还原淬灭将100的单电子氧化,并且产生的自由基101,通过自由基加成产生中间体102。随后*DPZ与102发生三线态能量转移提供激发态化合物103,其使得DPZ•–通过氧化再生基态DPZ来关闭光氧化还原催化循环,其被还原为104。在此之后2-吡啶取代的酮羰基被104的 Pyr•–还原,产生105发生自由基偶联产生四元环中间体(106)。最终发生逆羟醛缩合反应得到对映体富集的1,5-二酮。江智勇课题组报道的‘敏化启动电子转移’策略,为不对称光氧化还原催化平台增加了一种新型的合成手段,从而为热力学不允许的反应进程提供了解决思路。这里描述的结果表明,以手性催化剂作为共敏剂可以解决一些本来热力学不利的过程,并且可以更好的参与立体中心的构建。这一方法可以促进不对称有机催化在可持续自由基化学领域的广泛应用,成为服务于医药、材料领域发展的有力工具。文献详情:
Xin Sun, Yilin Liu, Yanli Yin, Xu Ban, Xiaowei Zhao, Zhiyong Jiang*. Asymmetric photoredox catalytic formal de Mayo reaction enabled by sensitization-initiated electron transfer. Nat. Chem. 2024,https://doi.org/10.1038/s41557-024-01502-3
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn






