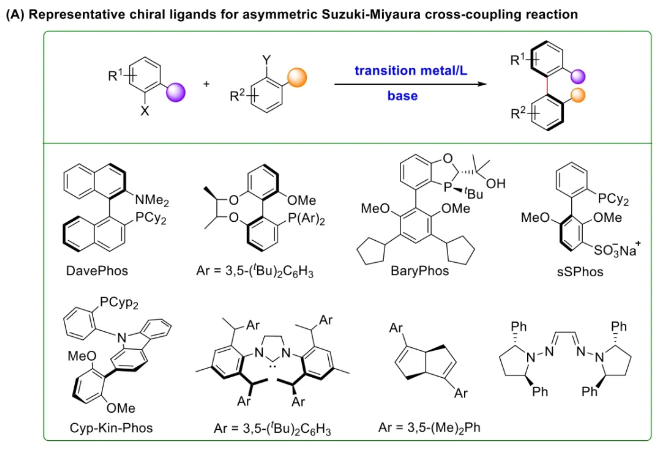
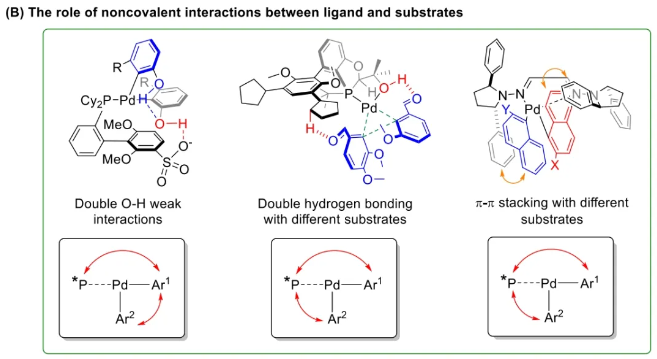
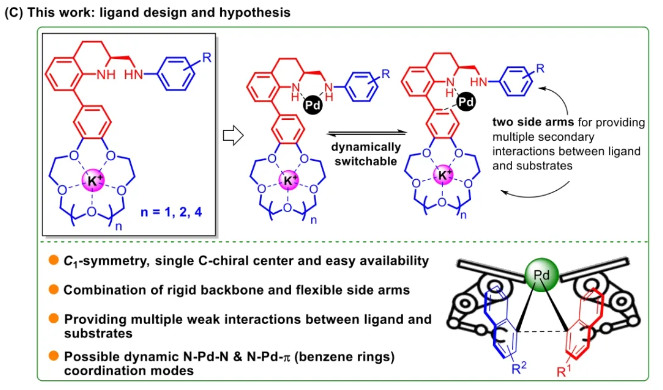
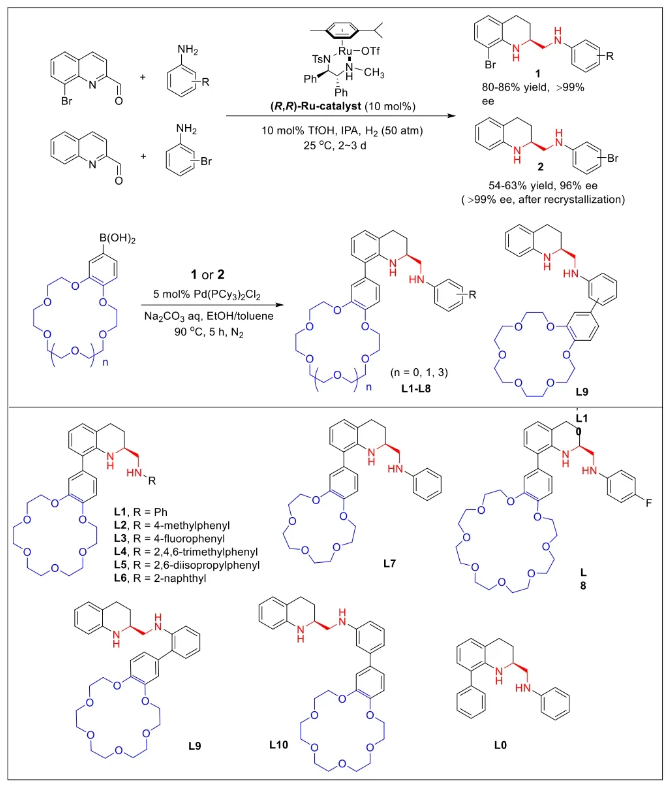
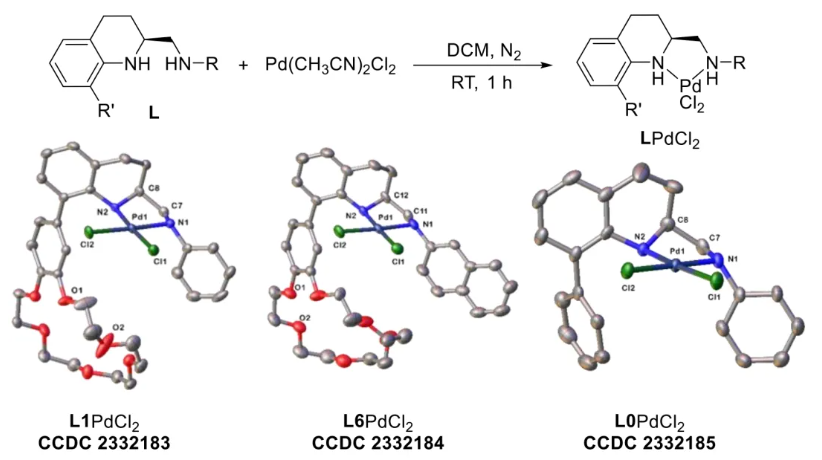
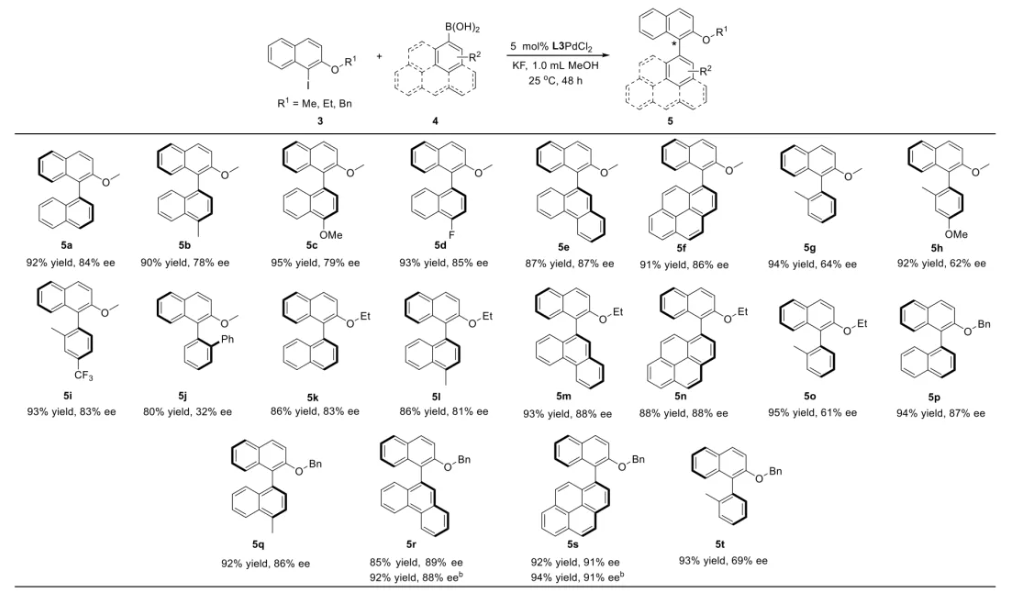
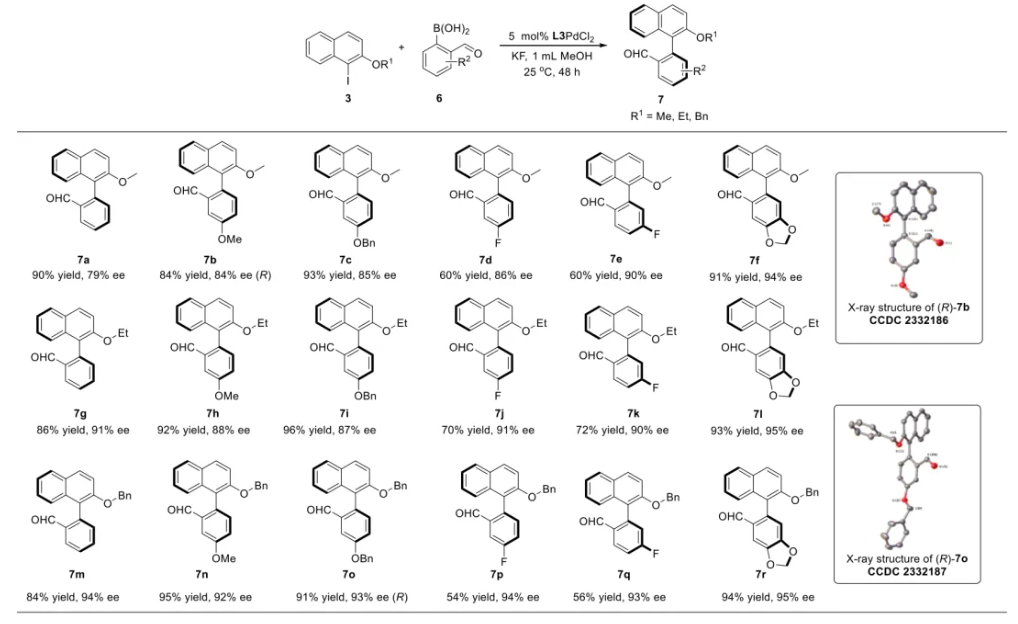
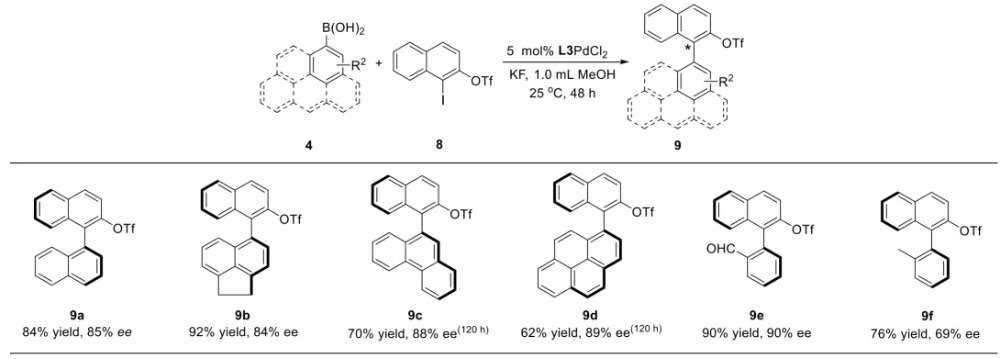
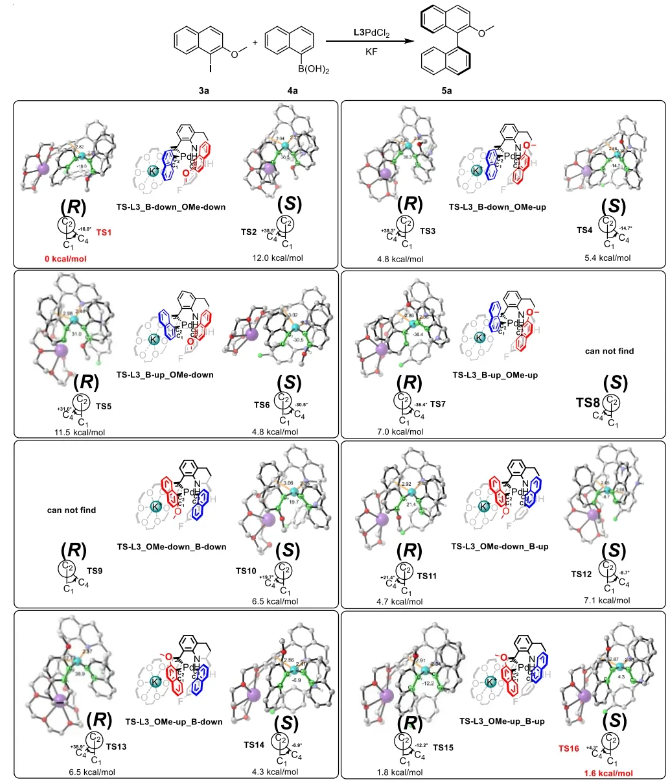
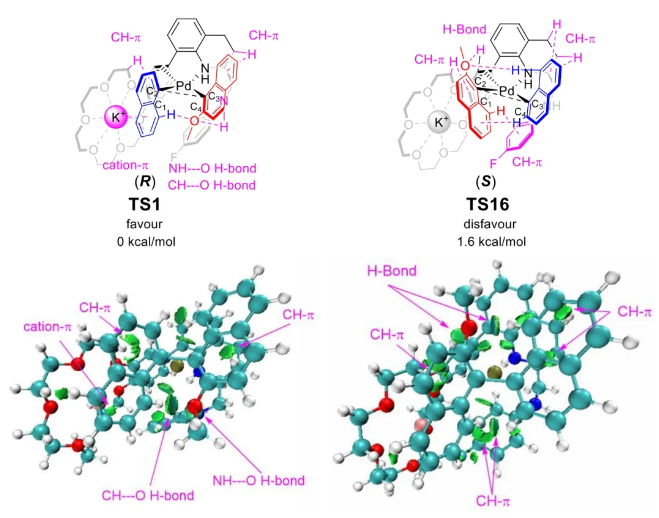
与膦配体相比,手性氮配体更稳定且易于获得,但在不对称Suzuki-Miyaura偶联反应中应用非常有限,仅有一例手性双腙配体的报道,且催化效果并不理想。最近,中国科学院化学研究所范青华团队通过钌催化2-喹啉醛衍生物与芳香胺的分子间还原胺化/不对称氢化串联反应,实现了一类新型含四氢喹啉骨架的手性邻二胺化合物的高效、高对映选择性合成,并发现该类手性配体可以应用于钯催化的不对称Suzuki-Miyaura偶联反应,但对映选择性有待提高。为此,作者设想在上述手性二胺骨架上引入冠醚侧基,通过促进配体与底物间的弱相互作用,进而提升Suzuki-Miyaura偶联反应中的手性诱导性能 (图1C)。该配体设计思想的优点在于:1) 配体刚性骨架与柔性侧基的结合有利于构筑可调的手性口袋;2) 冠醚、碱金属离子和底物间的多重弱相互作用有利于提高手性诱导能力 (超分子调控);3) 该类半稳定配体 (hemilabile ligand) 具有多种配位基团 (包括NH基和侧基苯环),有可能在催化过程中动态调控金属钯的配位方式 (智能催化)。图1. 不对称Suzuki-Miyaura偶联反应研究背景及本文中的配体设计理念基于上述设想,作者采用自己发展的手性邻二胺不对称催化合成新方法,设计并合成了一类C1对称的含有冠醚侧基的新型手性二胺配体 (图2)。该类配体可以从简单易得的原料出发,高效、高对映选择性地实现模块化的克级规模制备,并通过改变冠醚环大小及其取代位置,构建小型手性配体库。在完成含冠醚手性二胺配体大量制备的基础上,作者以冠醚手性二胺配体L1作为主体分子,K+离子作为客体,通过核磁共振氢谱滴定实验对该类配体与碱金属离子的主-客体识别进行了研究。Job Plot分析结果表明:L1与K+之间为1:1结合,且L1与K+之间的结合常数Ka为 (5.26 ± 1.38) ×103 M-1,这一数值与文献报道的苯并18-冠-6-醚与K+的结合常数接近,证明这类含冠醚侧基的手性二胺配体与碱金属阳离子之间存在主-客体相互作用。随后,制备了该类配体的钯(II)金属配合物,并通过X-射线衍射对其单晶结构进行了表征。单晶结构显示:该类配合物中手性二胺配体以N,N-双齿的配位模式与中心金属钯作用 (图3)。图3. 手性二胺-钯(II)配合物的合成及其单晶结构随后,作者详细研究了该类手性二胺配体在钯催化的不对称Suzuki-Miyaura偶联反应中的应用。通过条件优化和一系列对照实验,证明冠醚与手性二胺骨架的共价连接以及冠醚与碱金属离子间的主-客体识别对催化过程中的手性控制均起到了关键的作用。在此基础上,实现了系列烷氧基取代的轴手性联芳基化合物5的高效、高对映选择性合成 (图4)。官能化的手性联芳基化合物可以通过进一步的衍生化,制备更多种类的手性联芳基化合物。为此,作者进一步将该催化体系应用到轴手性官能化联芳基化合物的不对称合成中。首先,在单醛基取代联芳基轴手性化合物的合成中获得了高达95% ee的对映选择性及高达96%的分离收率 (图5),代表了这一单醛基取代轴手性产物迄今为止最好的结果。三氟甲磺酸酯是很好的离去基团,已广泛应用于有机反应中,但三氟甲磺酸酯取代的轴手性联芳基化合物的合成目前仅有一例报道。因此,作者尝试将该不对称催化体系应用到这类轴手性产物的合成中,取得了高达90% ee的对映选择性及92%的分离收率,并通过简单的衍生化反应制备了轴手性单膦配体 (图6)。图6. 三氟甲磺酸酯基取代的轴手性联芳基化合物的不对称合成为了进一步揭示轴手性产物的手性起源以及超分子弱相互作用在其中的影响,作者通过DFT理论计算对反应机理进行了研究。一般认为,小位阻轴手性化合物的手性控制仅由还原消除步骤决定,所以,作者使用最优配体L3对还原消除步可能的过渡态结构及其能量进行了计算。考虑到催化剂的C1对称性、两种底物的空间排列以及对映异构体的存在,独立分析了16种不同取向的过渡态,获得了14种优化的过渡态模型 (图7),均显示出N,η2-双齿配位结构,说明可能存在钯与配体间的摇摆交换配位。TS1和TS16分别是R构型和S构型产物最稳定的过渡态,它们的吉布斯自由能相差1.6 kcal/mol。进一步的分布分析计算得到25 °C时R构型对映体过量值为87%,与实验结果84% ee相符。随后,通过内禀反应坐标 (IRC) 对过渡态TS1前后中间体进行了几何优化计算,其结果进一步证明了摇摆交换配位机制的存在。随后,作者利用独立梯度模型 (IGM) 对TS1和TS16进行了弱相互作用分析 (图8)。结果显示:在TS1中,冠醚-K+组装体与硼酸底物萘环间存在双重弱相互作用,不仅有阳离子-π相互作用、冠醚环上的-CH2-与萘环间还有CH-π相互作用;并且,与钯解离的-NH-基与底物上的甲氧基可以形成NH∙∙∙O氢键,两个底物间也存在CH∙∙∙O氢键;同时,四氢喹啉的-CH2-基与碘代底物萘环间也存在CH-π相互作用。在TS1中,催化剂与底物的弱相互作用在空间上能够实现全方面覆盖,所以吉布斯自由能最低;反观TS16,虽然该过渡态中具有更多的CH-π相互作用,但是缺少关键的-NH-参与的氢键以及碱金属参与的阳离子-π相互作用。所以R构型是产物的优势绝对构型。这些计算结果进一步说明了冠醚环在手性诱导中的重要作用。综上所述,该研究工作报道了一类含有冠醚侧基的新型手性邻二胺配体的理性设计及其不对称合成。使用这些配体的钯配合物,实现了高效、高对映选择性的Suzuki-Miyaura交叉偶联反应,在温和的反应条件下,成功制备了一系列非官能化和官能化的轴手性联芳基化合物,包括2-烷氧基、2-烷氧基-2'-甲酰基和2-三氟甲磺酸酯基取代的轴手性联芳基化合物,对映选择性最高可达95% ee。控制实验表明,冠醚-K+超分子组装体的存在是实现优异对映选择性的关键因素。通过还原消除步16种可能过渡态的DFT计算,表明配体与钯金属可能发生独特的摇摆交换配位,从而增强两个底物与配体侧臂 (冠醚-K+和N-芳胺基团) 之间的多重次级弱相互作用,从而实现高水平的手性控制。所有这些研究结果证明了冠醚参与的超分子调控在此不对称催化反应中的关键作用,与作者最初的配体设计理念一致。文献详情:
Smart Palladium-Chiral Diamine Catalytic System with a Crown Ether Side Arm: Supramolecularly Controlled Asymmetric Suzuki-Miyaura Coupling Reactions
Bo-Wen Deng, Yi-Er Luo, Yu-Ping Tang, Ze-Yu Li, Yan-Mei He and Qing-Hua Fan*
CCS Chem., 2024,
https://doi.org/10.31635/ccschem.024.202404070