

正文
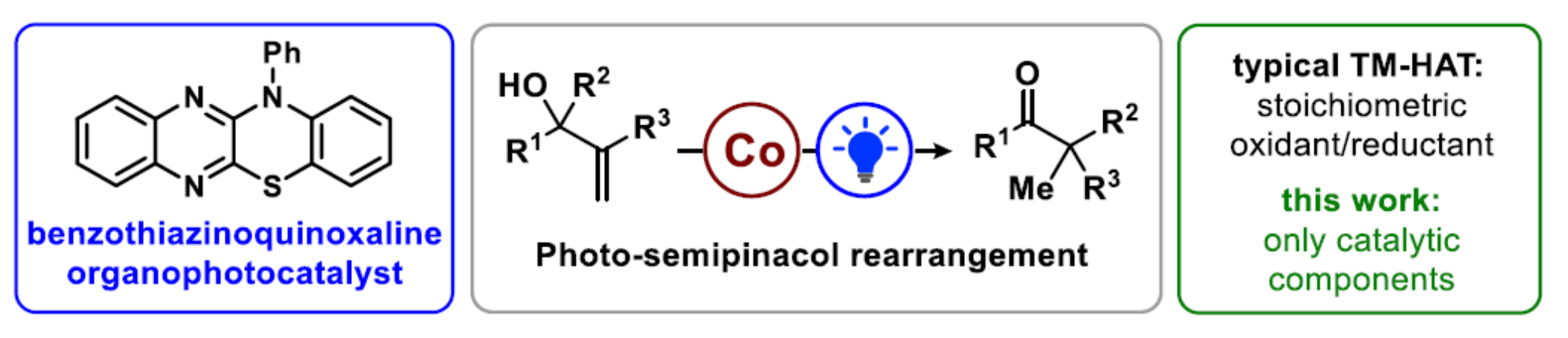
碳阳离子是有机合成中有价值的反应物种。它们是反应中的关键中间体,如SN1取代、Wagner-Meerwein迁移、Friedel-Crafts烷基化和多烯环化等。在温和条件下精确控制阳离子反应性有利于开发新的反应,特别是对映和非对映选择性的控制。例如,基于squaramides、硫脲以及手性磷酸和羧酸的催化剂的设计。最近,光氧化还原催化已成为一种生成自由基并影响其氧化为具有相应反应性阳离子的简便方法。近日,Erick M. Carreira课题组开发了一种光与钴催化非活化烯丙醇的半频哪醇重排反应(Figure 1)。其中,该反应以苯并噻嗪并喹喔啉作为光催化剂、Co-salen作为金属催化剂和Lut-HOTf作为碱,并与使用Brønsted酸的体系具有互补的反应性。同时,该反应无需使用化学计量的还原剂或氧化剂,具有高度的原子经济性。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
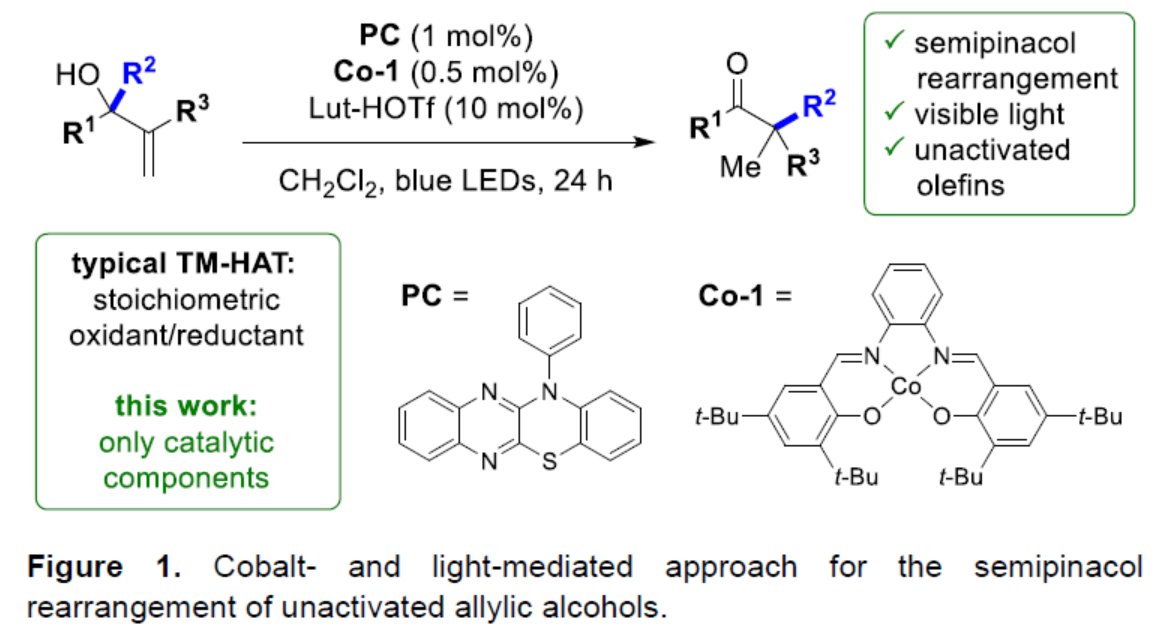
(图片来源:Angew. Chem. Int. Ed.)
传统上,阳离子半频哪醇重排常使用Brønsted或Lewis酸。1980年,Wasserman课题组(J. Org. Chem. 1980, 45, 2874.)开发了一种烯丙醇在HBr、H2SO4或HClO4条件下合成环丁酮的方法(Figure 2)。2023年,Jacobsen课题组(J. Am. Chem. Soc. 2023, 145, 15036.)使用手性脲和干燥的HCl来影响乙烯基环丙醇的转化,合成了对映体富集的α,α-二取代的环丁酮。此外,在一项关于HAT化学的研究中,Pronin课题组(J. Am. Chem. Soc. 2018, 140, 16982.)发现,在Co-salen以及过量的PhSiH2Me和N-fluorocollidinium triflate存在下,烯丙醇可以进行扩环,生成环烷酮衍生物。这些经典的HAT条件下,使用化学计量还原剂(硅烷)和氧化剂([F+]),可实现[Co]-催化剂在不同氧化态之间的穿梭。最近,Carreira(Angew. Chem. Int. Ed. 2024, 63, e202319515.)与Ohmiya课题组(J. Am. Chem. Soc. 2022, 144, 7953.)分别报道了非活化烯烃的环异构化和加氢醚化反应。此类反应通过对烯烃的氢加成,然后氧化成阳离子中间体来进行。并且,使用关键的光催化剂、钴催化剂和氢三氟甲磺酸盐(hydrotriflate salt),消除了对化学计量氧化剂/还原剂的需求。
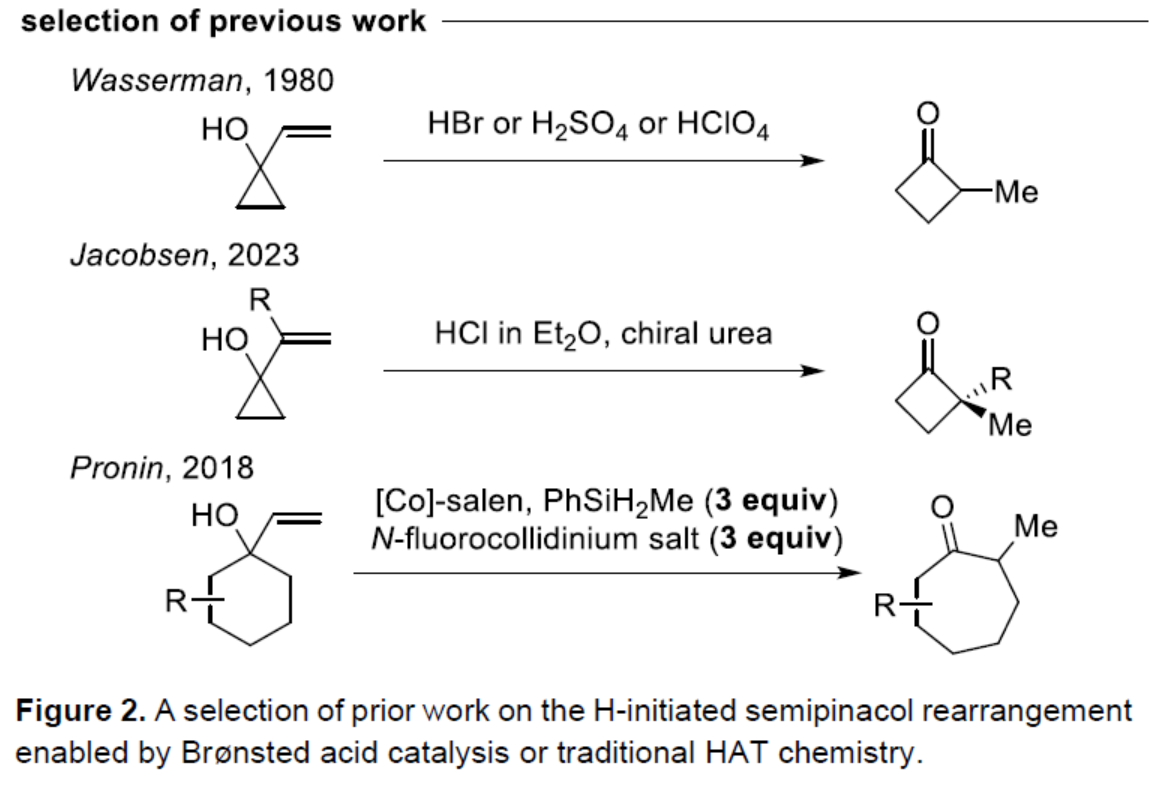
(图片来源:Angew. Chem. Int. Ed.)
首先,作者以烯丙醇衍生物1a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以PC(1 mol %)作为光催化剂,Co-1(0.5 mol %)作为金属催化剂,Lut-HOTf(10 mol %)作为添加剂,蓝色LEDs作为光源,在CH2Cl2溶剂中40 oC反应24 h,可以85%的收率得到α-甲基化酮产物2a。
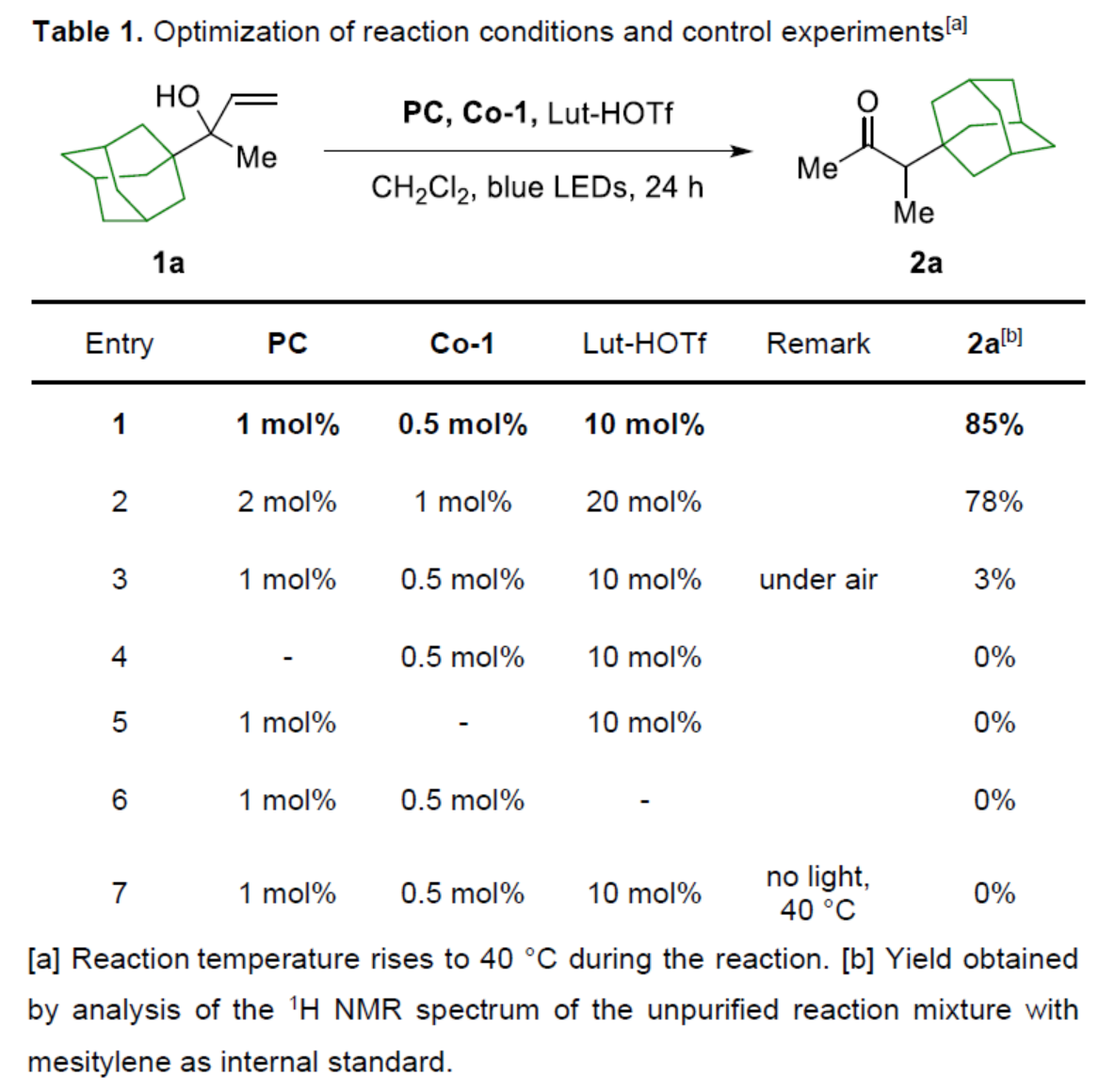
(图片来源:Angew. Chem. Int. Ed.)
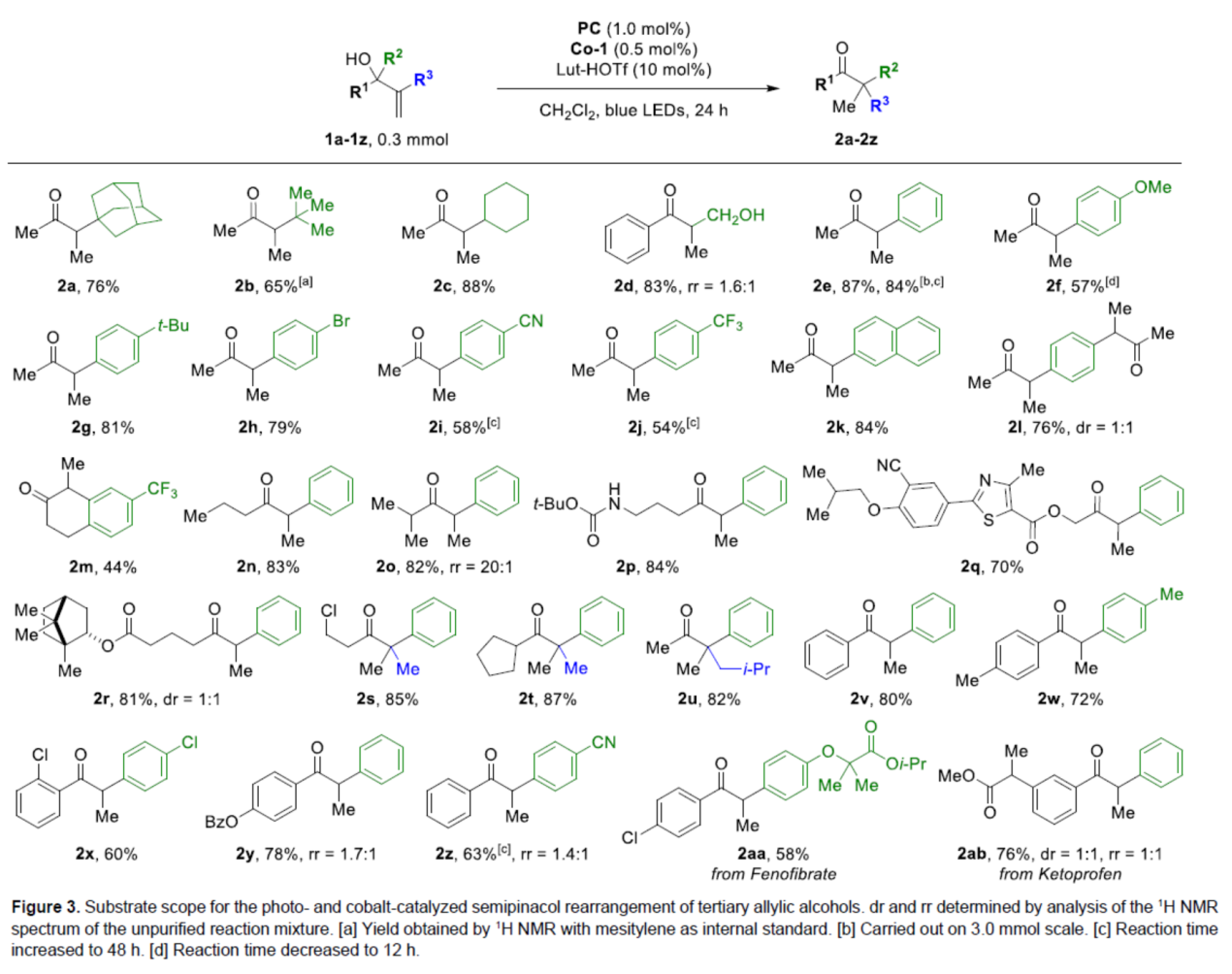
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。首先,当底物中的R2为金刚烷基、三甲基、环烷基、游离羟基、不同电性取代的芳基、萘基等时,均可顺利反应,获得相应的产物2a-2k,收率为54-87%。同时,该方法还可进行双重半频哪醇重排反应,可以76%的收率得到产物2l,dr为1:1。该反应还可用于扩环,可以44%的收率得到产物2m。其次,当底物中的R1为各种烷基、环烷基以及不同电性取代的芳基时,也能够顺利进行反应,获得相应的产物2n-2z,收率为60-87%。此外,该策略还可用于药物分子的后期衍生化,如酮洛芬和非诺贝特,获得相应的产物2aa(收率为68%)和2ab(收率为76%,dr为1:1,rr为1:1)。
(图片来源:Angew. Chem. Int. Ed.)
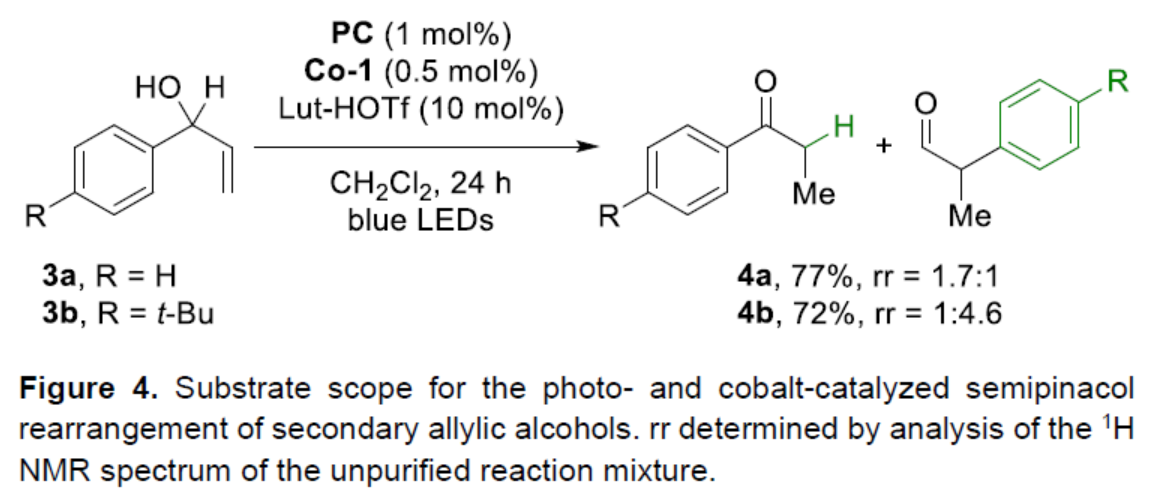
紧接着,作者对二级烯丙醇的底物范围进行了研究(Figure 4)。研究表明,当使用3a或3b作为底物,可获得两种不同重排产物且不可分离的混合物4a(收率为77%,rr为1.7:1)和4b(收率为72%,rr为1:4.6)。其中,1,2-氢转移优先于非取代芳烃的迁移(4a)。同时,迁移芳烃的电子差异影响其迁移能力(4b)。
(图片来源:Angew. Chem. Int. Ed.)
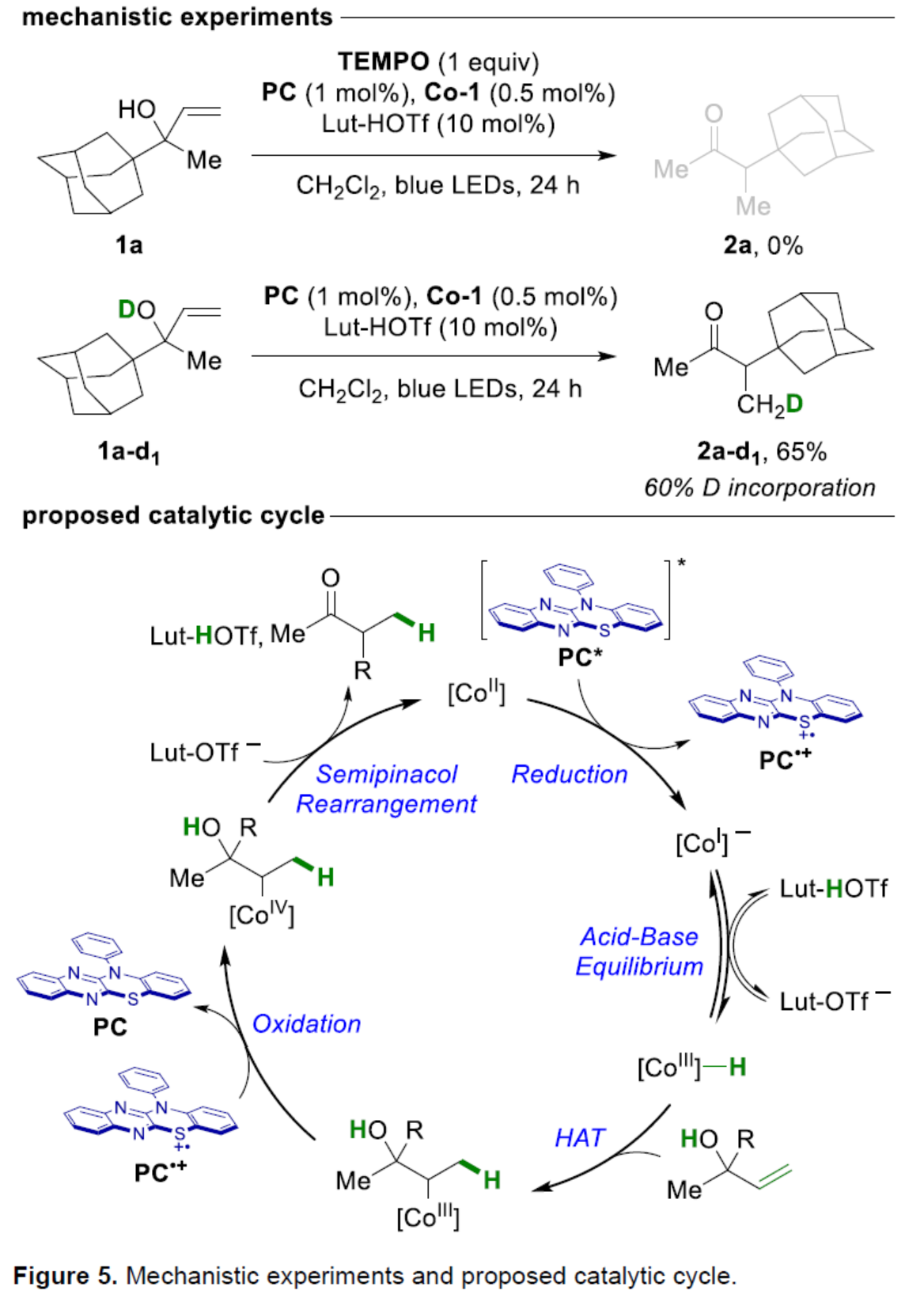
此外,作者还对反应机理进行了进一步的研究(Figure 5)。自由基抑制实验结果表明,反应涉及自由基的机理。氘代实验结果表明,醇是HAT步骤中转移的质子源。基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程。首先,[CoII]-salen催化剂Co-1被激发态光催化剂PC*还原,生成阴离子[CoI]-配合物,并且可逆质子化生成共轭酸[CoIII]-H。随后,[CoIII]-H与非活化的烯烃进行HAT,生成更稳定的二级[CoIII]-烷基配合物。二级[CoIII]-烷基配合物被PC·+氧化,生成[CoIV]-烷基配合物,该配合物与游离碳阳离子平衡。最后,在碱介导下,[CoIV]-烷基配合物进行半频哪醇重排,生成目标产物并再生[CoII]-salen催化剂Co-1,已完成催化循环的过程。
(图片来源:Angew. Chem. Int. Ed.)
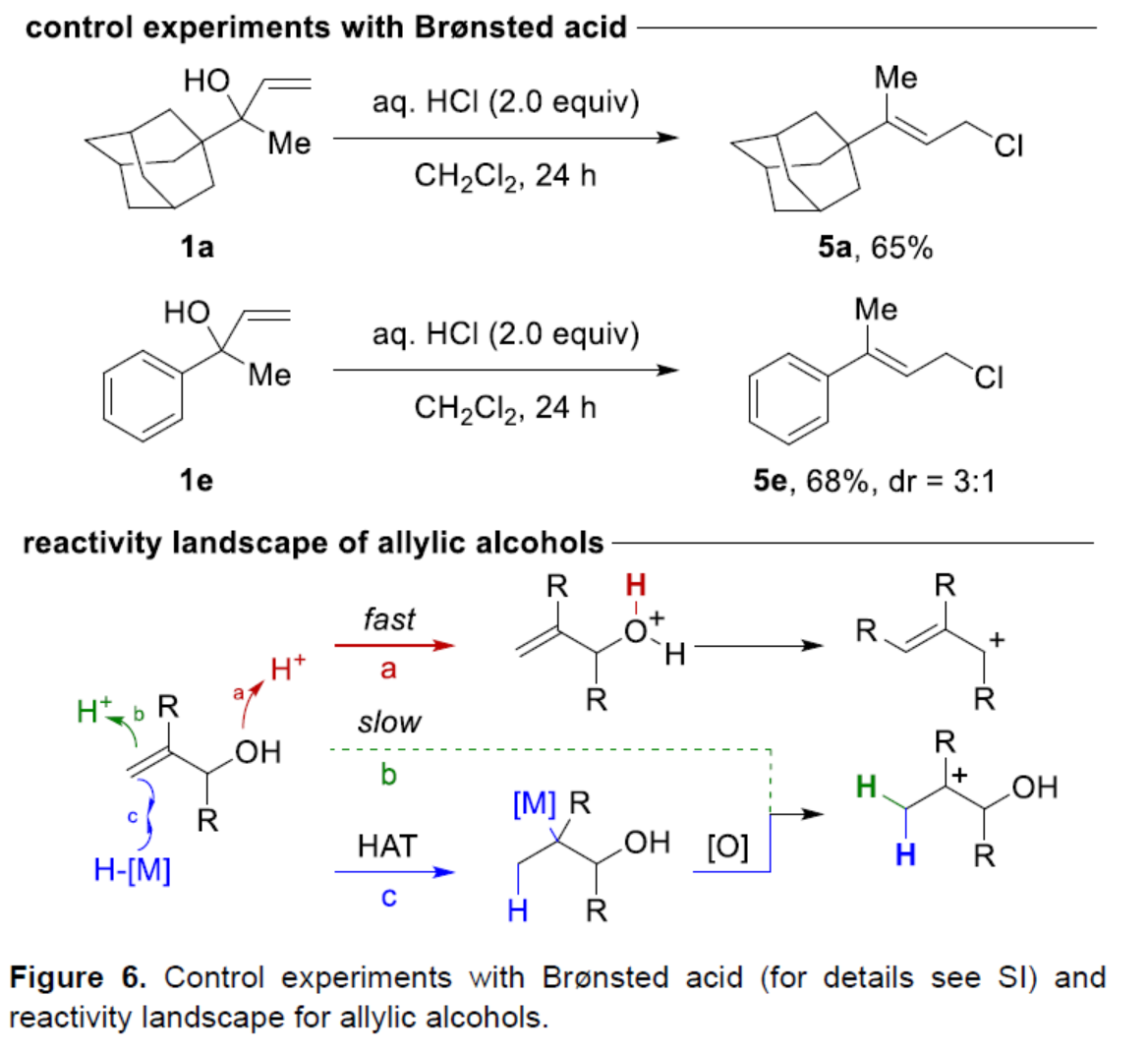
同时,作者还通过控制实验对Brønsted酸催化反应的差异性进行了研究(Figure 6)。研究结果表明,当使用Brønsted酸时,质子化有两种选择。当质子化发生在醇上时,反应是快速的,生成氧鎓离子,其经脱水后生成烯丙基阳离子(路径a)。当质子化发生在烯烃上时,反应速度慢,生成三级阳离子(路径b)。相反,HAT化学能够提供具有不同反应性的额外途径来产生碳阳离子(路径c)。
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn