

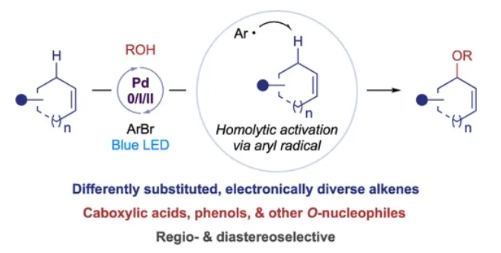
正文
烯丙基醚和羧酸酯是有机分子中重要的结构骨架。特别是,支链烯丙醚和羧酸酯经常出现在天然产物、生物活性分子和FDA批准的药物中(Scheme 1a)。因此,化学家们开发了各种方法来合成支链烯丙位氧官能团化的分子。在这其中,钯催化的Tsuji-Trost反应是最强大、最稳健的方法之一,在合成过程中具有高水平的区域控制和立体控制,且应用广泛(Scheme 1b, 左边)。然而,制备在烯丙位上连有离去基团的预官能团化烯烃通常需要额外的合成步骤,这限制此方法的应用范围。因此,实现烯烃的烯丙位直接C-H官能团化已成为一个广泛关注的话题。近些年来,化学家们已经发展了端烯与羧酸、醇和其它氧亲核试剂(如酮肟)的偶联,且通常会得到线性产物。然而,在更常见且更重要的内烯烃方面取得的进展要少得多(Scheme 1b, 右边)。虽然非官能团化的烯烃,例如环己烯,通常被用作底物参与反应。但更复杂的烯烃的转化则遇到很多挑战,如较差的官能团耐受性和产物分解等。此外,这些方法通常依赖于亲电的Pd(II)催化剂来活化烯丙位的C-H键,因此使缺乏电子底物的转化更具挑战性。对于亲核偶联配偶体,通常利用羧酸(如乙酸)以溶剂的形式来是实现烯丙位C-H氧化。然而,苛刻的反应条件降低了更复杂羧酸或其他亲核试剂的兼容性。除了底物范围局限以外,选择性问题也是阻碍该领域发展的关键。整体来讲,这些局限性限制了该方法的实用性。最近,美国德克萨斯大学达拉斯分校Vladimir Gevorgyan课题组发展了一个光催化的反应策略,可以有效的解决上述问题,使各种内烯烃与羧酸,醇和其他氧亲核试剂发生偶联,通常具有良好的区域选择性和非对映选择性(Scheme 1c)。 化学加——科学家创业合伙人,欢迎下载化学加APP关注。
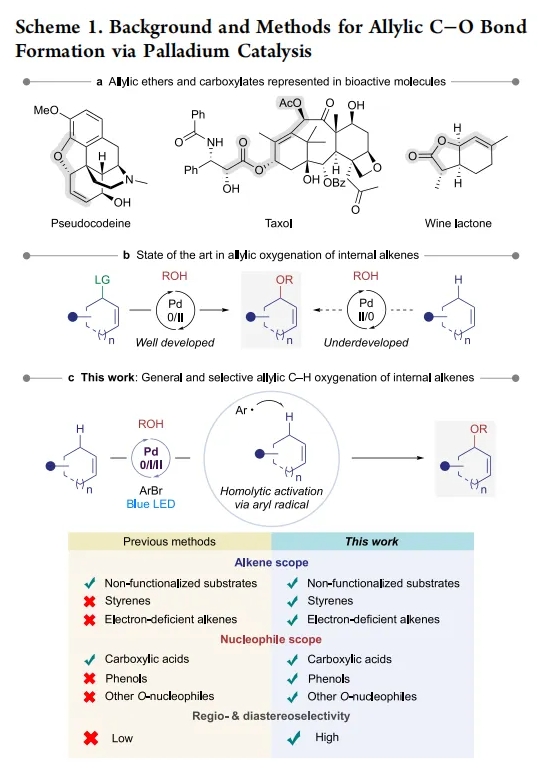
(图片来源:J. Am. Chem. Soc.)
首先,作者使用3-叔丁基环己烯1和苯酚2作为模板底物对此转化进行了探索,并对反应条件进行了优化(Table 1)。当使用1 (1.5 equiv), 2 (1.0 equiv), Pd(TFA)2 (10 mol%), PPh3 (40 mol%), Br2 (2.0 equiv), Cs2CO3 (2.0 equiv), 在PhCN (0.5 M)中, 蓝光照射下,室温反应16小时可以以82%的GC产率和74%的分离产率得到相应的烯丙位C-H氧化产物3,且dr为15:1(entry 7)。
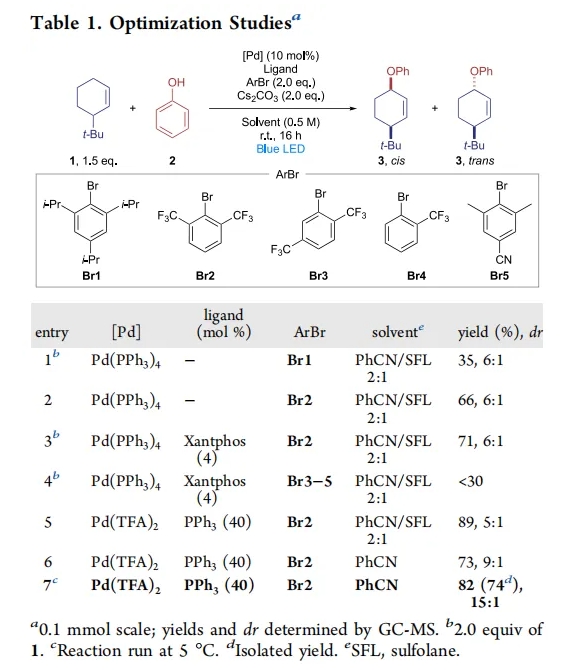
(图片来源:J. Am. Chem. Soc.)
在得到了最优反应条件后,作者对此转化的底物范围进行了考察。首先,作者对18类不同的药物相关氮亲核试剂的兼容性进行了考察(Scheme 2)。实验结果表明,包括具有不同环尺寸的环烯烃、苯乙烯、缺电子烯烃等均可实现转化,以31-78%的产率,良好的区域选择性和非对映选择性得到相应的烯丙位C-H氧化产物1-35。此外,一系列不同取代的酚类以及羧酸类(脂肪和芳香羧酸)氧亲核试剂均可兼容,以39-76%的产率得到产物36-55。值得注意的是,其它类型的氧亲核试剂,如脂肪醇、肟等也可参与转化,以44-75%的产率得到产物56-59。此外,此转化对分子内的版本同样可行,分别以40%和43%的产率得到多官能团化的双环内酯产物62和63。为了证明此转化的实用性,作者探索了复杂生物活性分子的兼容性。实验结果表明,包括Norquetiapine、Tryptamine、Estrone、Taxol、Indomethacin、Naproxen等均可兼容,以35-71%的产率得到产物64-71。
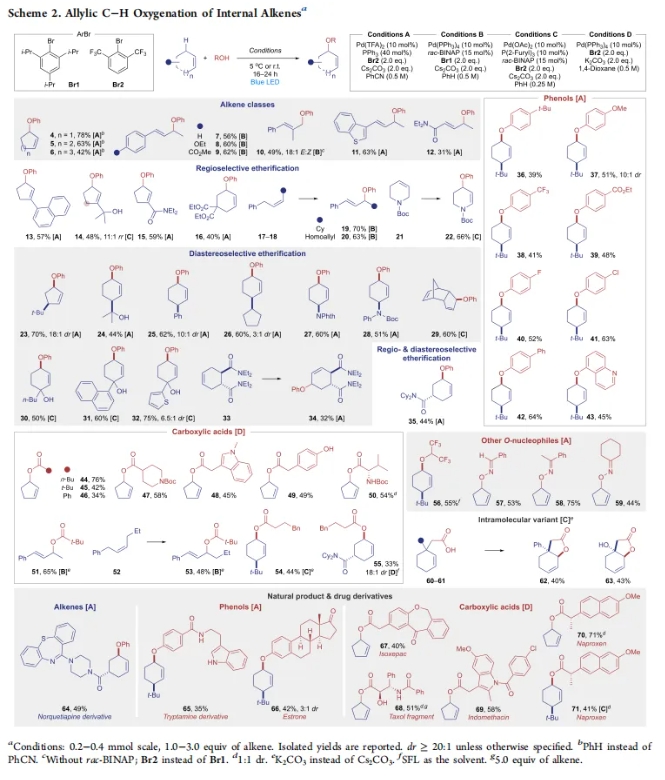
(图片来源:J. Am. Chem. Soc.)
为了深入理解反应机理,作者进行了一系列控制实验(Scheme 3)。芳基溴作为淬灭剂的作用被Stern–Volmer实验证实。有趣的是,与Br1相比,Br2是光激发Pd(0)的更好淬灭剂,这清楚地表明芳基溴的反应活性可以通过改变空间位阻和电性来进行调节。随后Br2形成的芳基自由基可以由乙烯基环丙烷72的自由基探针实验来证实,其在与芳基自由基加成后可以进行自由基开环得到73(Scheme 3a)。此外,当以THF-d8为溶剂时(Scheme 3b),作者通过氘标记实验(Br2→d-74)验证了芳基自由基的HAT过程。此外,TEMPO加合物75的形成支持了反应涉及自由基中间体的参与(Scheme 3c)。
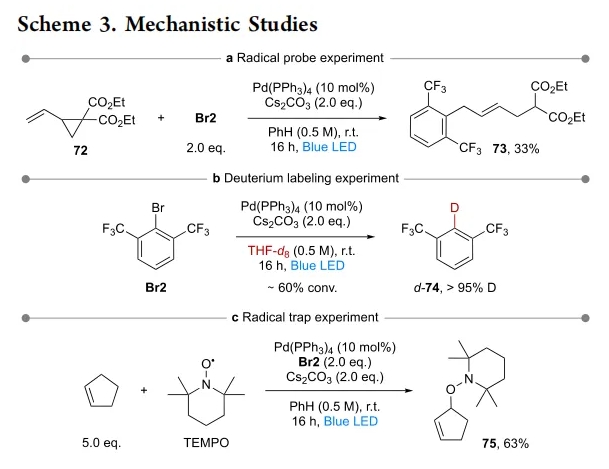
(图片来源:J. Am. Chem. Soc.)
基于上述实验结果,作者提出了此转化可能的反应机理(Scheme 4):首先,光激发的Pd(0)催化剂与芳基溴通过单电子转移(SET)得到混合的芳基Pd(I)自由基中间体A,其能够与烯烃底物通过HAT生成更稳定的烯丙基自由基中间体B。随后通过RPC形成闭壳π-烯丙基Pd(II)络合物C,该络合物经历与氧亲核试剂的烯丙基取代得到所需产物,并再生Pd(0)催化剂。
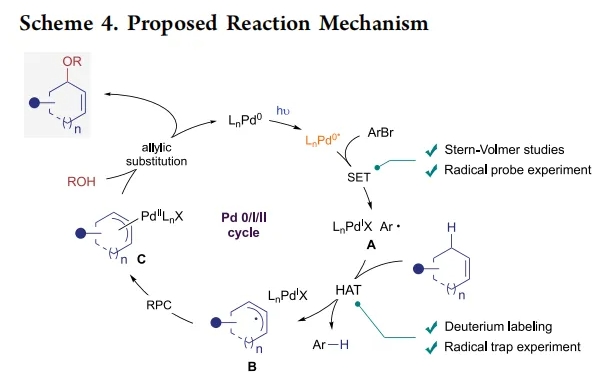
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn