

正文
传统的去消旋化策略通常需要加入额外当量的氧化剂或者还原剂,极大地破坏了其本身具有的合成优越性。近年来,随着光化学的快速发展,化学家逐渐认识到由光能转化为化学能以及其不同势能面的反应途径可以突破上述挑战,也因此发展了系列高效的光化学去消旋化策略。河南师范大学江智勇教授课题组一直致力于不对称光催化反应的研究,近年来,利用光氧化还原中性去消旋化反应模式,高对映选择性地将多类型线性/环状消旋α-氨基酯及其它类似物转化为单一构型的产物(Angew. Chem. Int. Ed. 2022, 61, e202211241);实现了轴手性2-氮杂芳烃功能化喹唑啉酮的高效合成(Angew. Chem. Int. Ed. 2024, 63, e202411236, 河南师范大学江智勇课题组Angew:通过光氧化还原催化去消旋化实现轴手性N-芳基喹唑啉酮的模块化合成)。
最近,该团队在光化学去消旋化反应研究中取得了新进展:通过[2+2]光可逆环化反应,并利用手性催化剂对映选择性控制光环裂解,实现从头去消旋化合成对映体富集的环丁烷,两个C(sp3)-C(sp3) 键的同时形成和解离使得三个立体中心的中间体能够有效实现去消旋化,涉及全碳季碳和相邻季碳手性中心,为实现不对称光化学反应(特别是涉及高活性自由基的反应)的精确对映体控制提供了一种新的策略,提供了一种更具有原子和步骤经济性的光化学去消旋化模式。这一研究成果发表J. Am. Chem. Soc.上,文章链接: https://doi.org/10.1021/jacs.4c08290。该论文的第一作者为河南师范大学化学化工学院2023届硕士毕业生王家豪,江智勇教授为通讯作者。
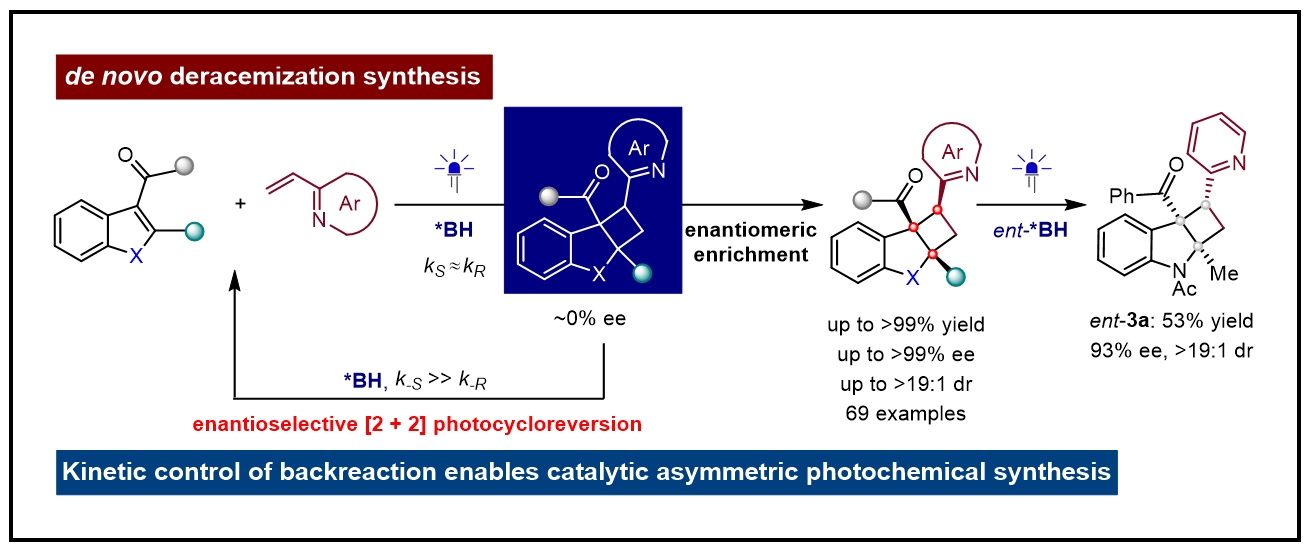
已经发展的几种光化学去消旋化模式,由于在构建外消旋分子的过程中采用了不可逆的方法,需要利用原料化学品制备外消旋底物(图1, A),在原子和步骤经济性方面限制了去消旋化的实用性。基于此,作者提出了这样一种设想,利用简单外消旋底物经历可逆的光化学反应历程,直接产生对映体富集的化合物,实现从头去消旋化合成,其中传统的手性催化剂可能无法为产物形成提供有效的对映体控制(kR ≈ kS),该方法的成功依赖于手性催化剂在通过可逆光化学反应回收起始原料的过程中充分区分产物的两种对映体的能力(k-R >> k-S)(图1, B)。
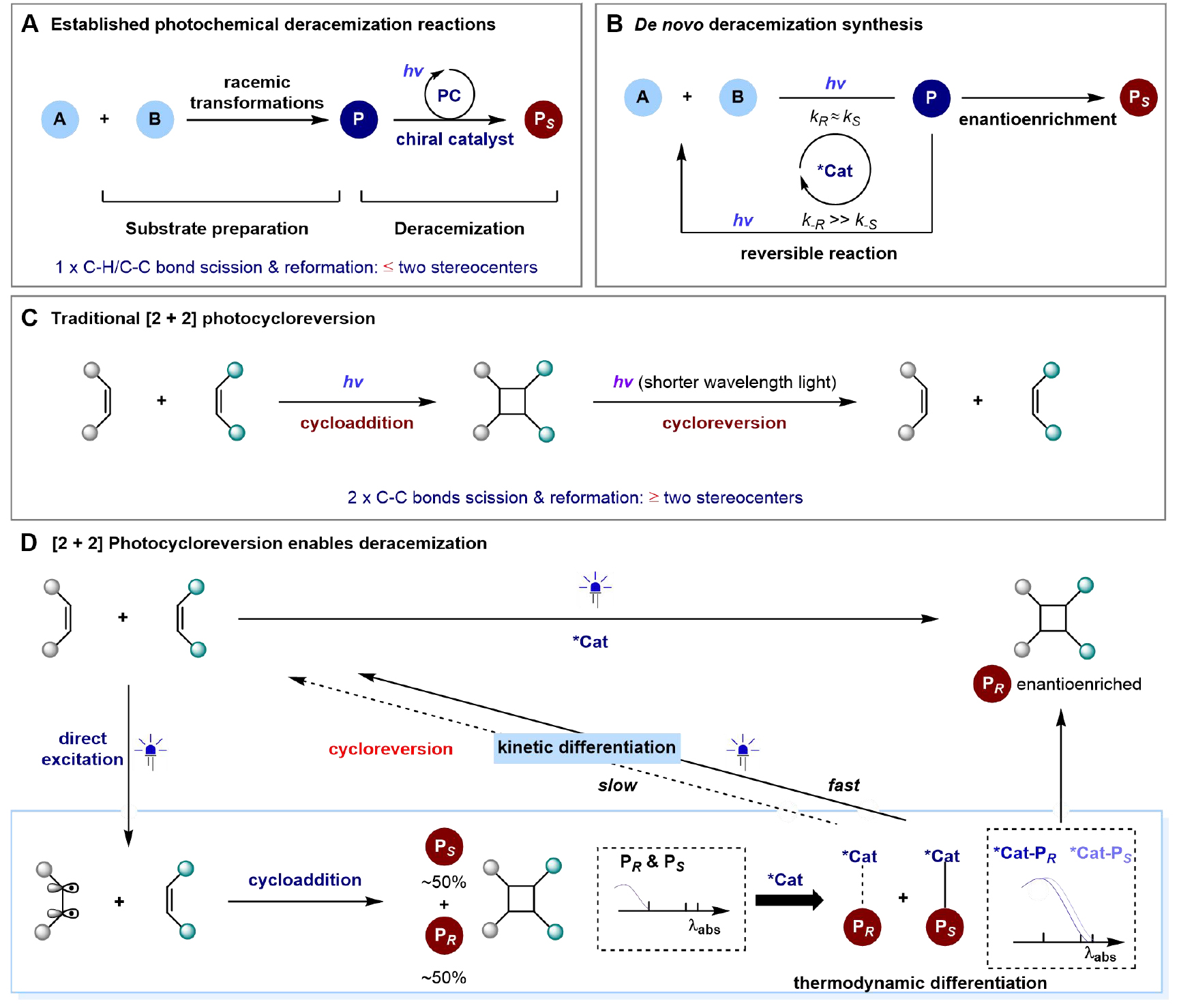
图1. 光化学去消旋化的背景及反应设计(图片来源:JACS)
与相应的环加成相比,环裂解通常需要更高的能量(图1, C),作者设想是否可以通过使用合适的手性催化剂与环丁烷相互作用来诱导红移吸收,降低其激发能量,增强光环裂解(图 1, D)。手性催化剂与环丁烷作用后会产生两种具有不同激发能的中间体(即 *Cat⸱⸱⸱PR 和 *Cat-PS),这种结合时的热力学差异以及相互作用后光环裂解的动力学差异,从而使外消旋环丁烷高产率的富集单一对映体,在不外加光催化剂的情况下,利用光敏化的手性催化剂能够使这一策略具有更高的经济性。
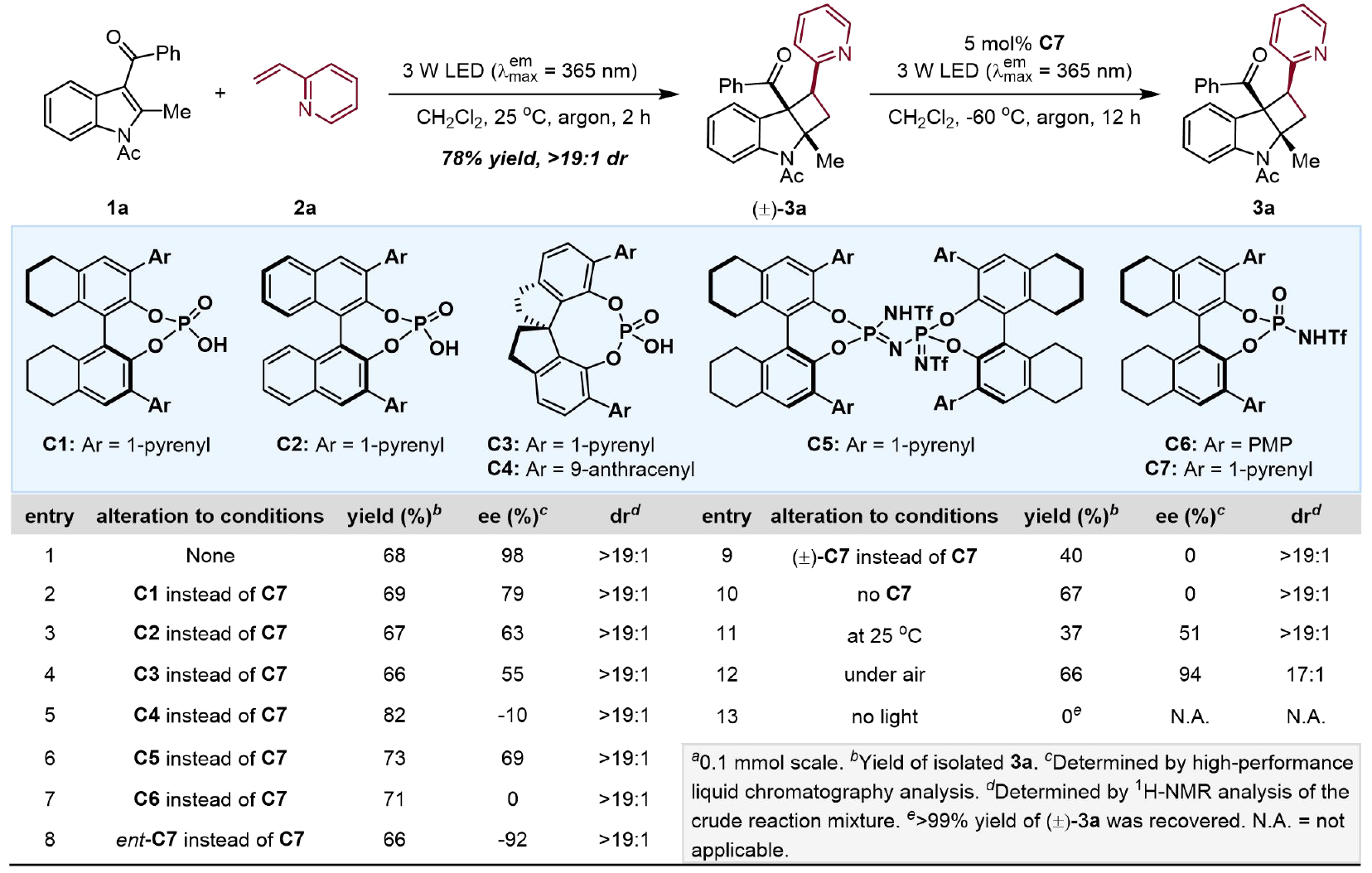
图2. 反应条件筛选(图片来源:JACS)
首先,作者选择吲哚衍生物1a和2-乙烯基吡啶2a作为模版底物,通过大量的条件筛选发现,使用催化剂C7,在-60 ℃的氩气条件下,二氯甲烷作为反应溶剂,反应12小时可以得到产率为68%,ee值为98%的对映体富集产物3a(图2,entry 1);筛选不同的手性磷酸结果表明,催化剂的酸性和取代基对于反应的对映选择性有着直接影响,芘基取代的手性磷酸优于其它稠环芳烃。值得一提的是,反应对于空气并不敏感,产率与模板条件几乎一致,对映选择性略有下降(94% ee, 图2, entry12), 不外加光源的控制实验证明了光子对于开环裂解的必要性(图2, entry13)。

图3. 从头去消旋化合成环丁烷3(图片来源:JACS)
在优化的反应条件下,作者研究了具有不同2位取代基的各类3-羰基取代吲哚与不同的乙烯基氮杂芳烃的转化(图 3)。产物3a-zk的产率为38%至>99%,ee值为82%至>99%,dr值为4:1至>19:1,吲哚的N原子可以引入多种保护基团 (3a-f),苯环各取代位置兼容吸电子和给电子官能团以及替代为杂芳环和一系列烷基酮,均能保持高对映选择性;测试了各种2-乙烯基氮杂芳烃,包括吡啶环上具有不同取代基的吡啶衍生物 (3zd-zi)、苯并恶唑衍生物 (3zj)和噻唑衍生物 (3zk),显示出良好的耐受性。
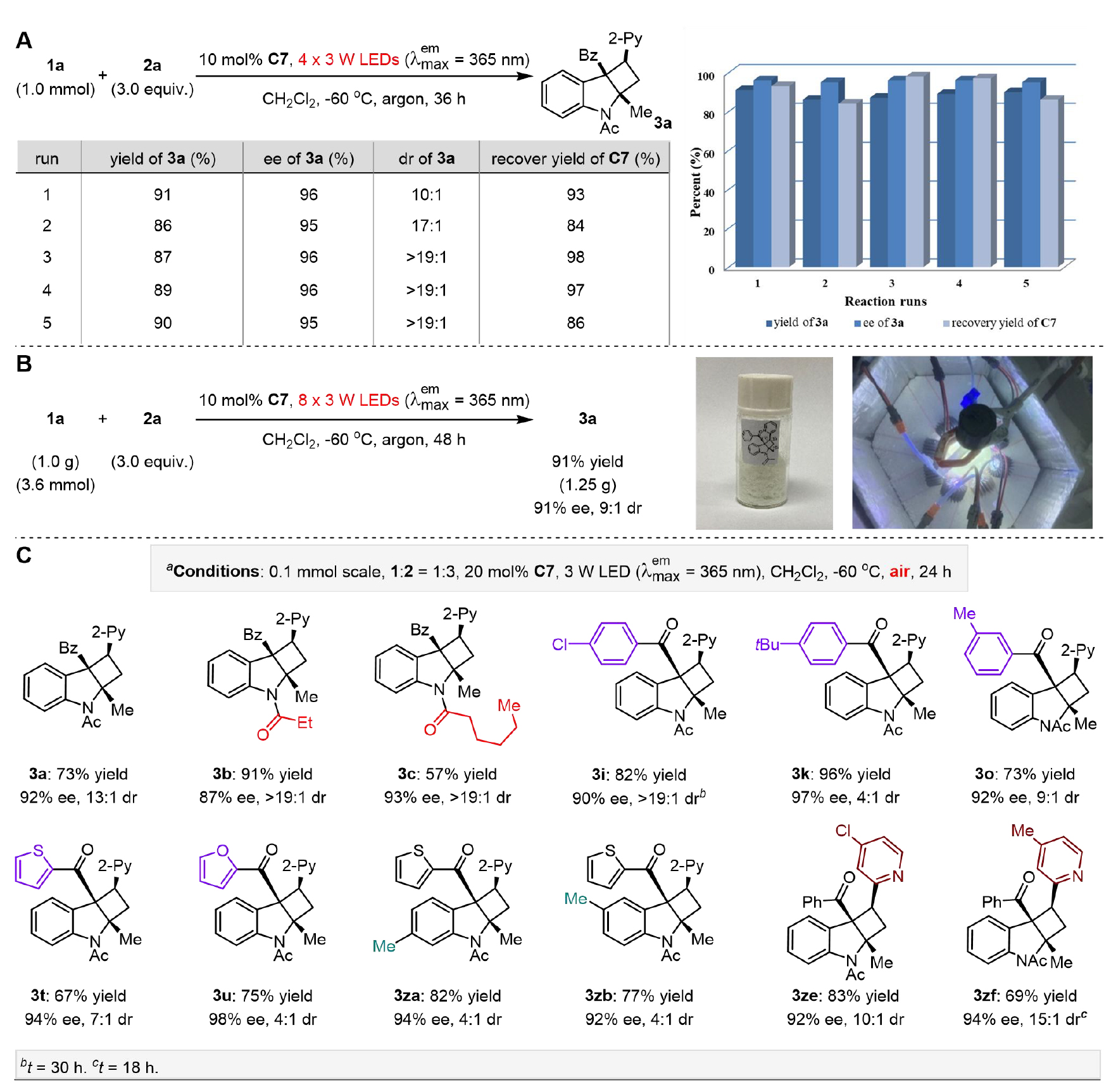
图4. 从头去消旋化合成对环丁烷3的应用探索(图片来源:JACS)
鉴于高产率、高对映选择性和非对映选择性的结果并且同时形成三个立体中心,以及能够兼容各类型底物,作者深入探究这种去消旋化策略的合成价值。首先,利用该手性磷酸的可回收特性,将反应规格放大至毫摩尔级,在1a的用量保持在所用C7的十倍的情况下,催化剂循环使用5次,仍可以得到令人满意的实验结果;克级制备成功一锅合成了产物3a (1.25g),ee值为91%(图4, B)。在空气条件下进行的反应对于工业生产尤为重要,鉴于之前的控制实验结果,作者探索了在空气条件下的从头去消旋化合成,如图4C所示,以57%至96%的产率合成了一系列代表性的环丁烷 (3),ee值为87%至98%,dr为4:1至>19:1。
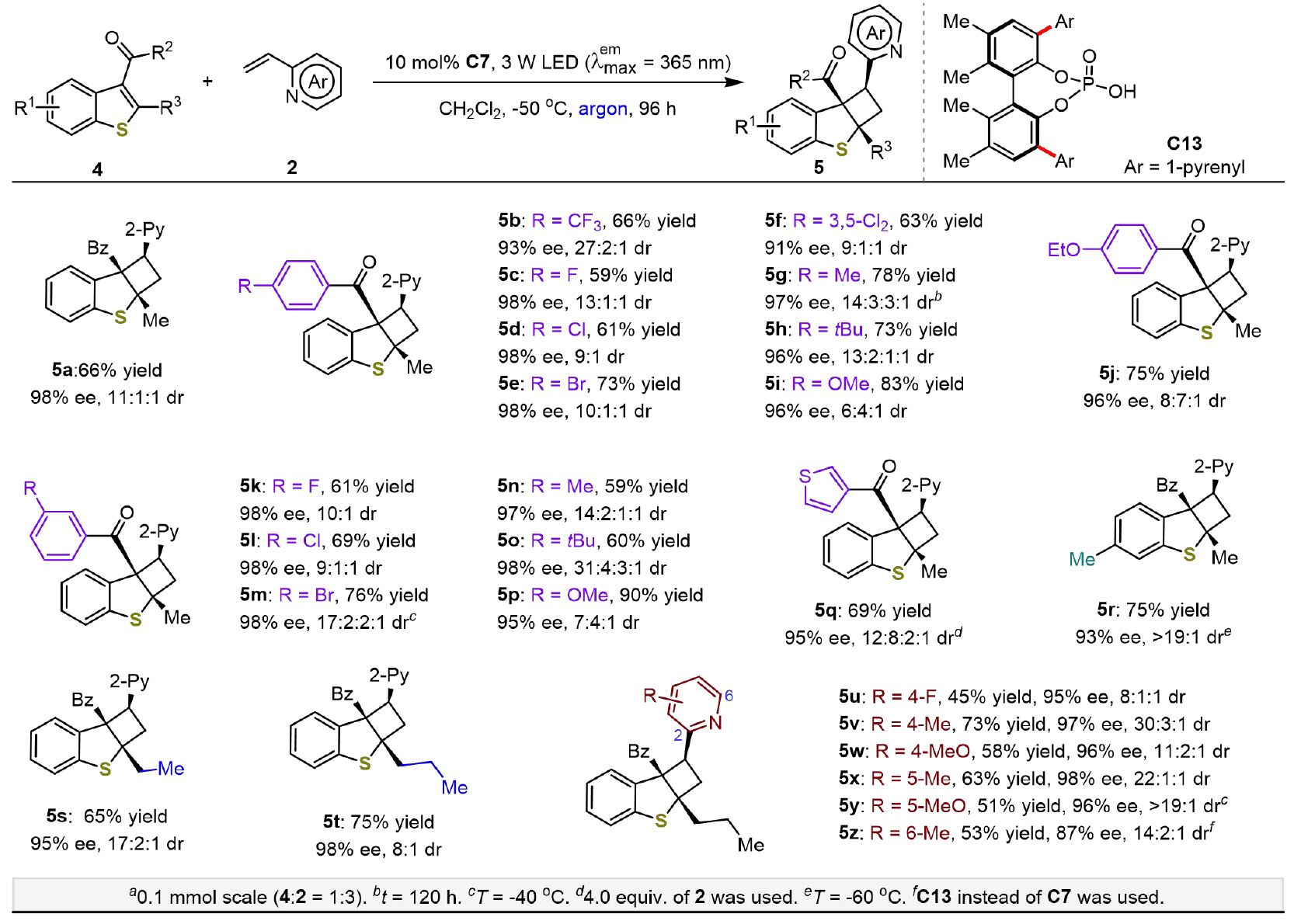
图 5. 2,3-二氢苯并[b]噻吩基吡啶官能化环丁烷5的从头去消旋化合成
(图片来源:JACS)
作者还研究了从相应的苯并噻吩 (4) 和乙烯基氮杂芳烃 (2) 进行从头去消旋化合成的可行性 (图 5)。发现底物范围很广,兼容各种苯基酮 (5a-p) 和杂芳基酮 (5q)以及其他烷基 (5s-t)的苯并噻吩;一系列乙烯基吡啶可以得到产物 (5u-z),产率从 45%到73%不等,ee值在87%到98%之间,非对映选择性中等到良好。
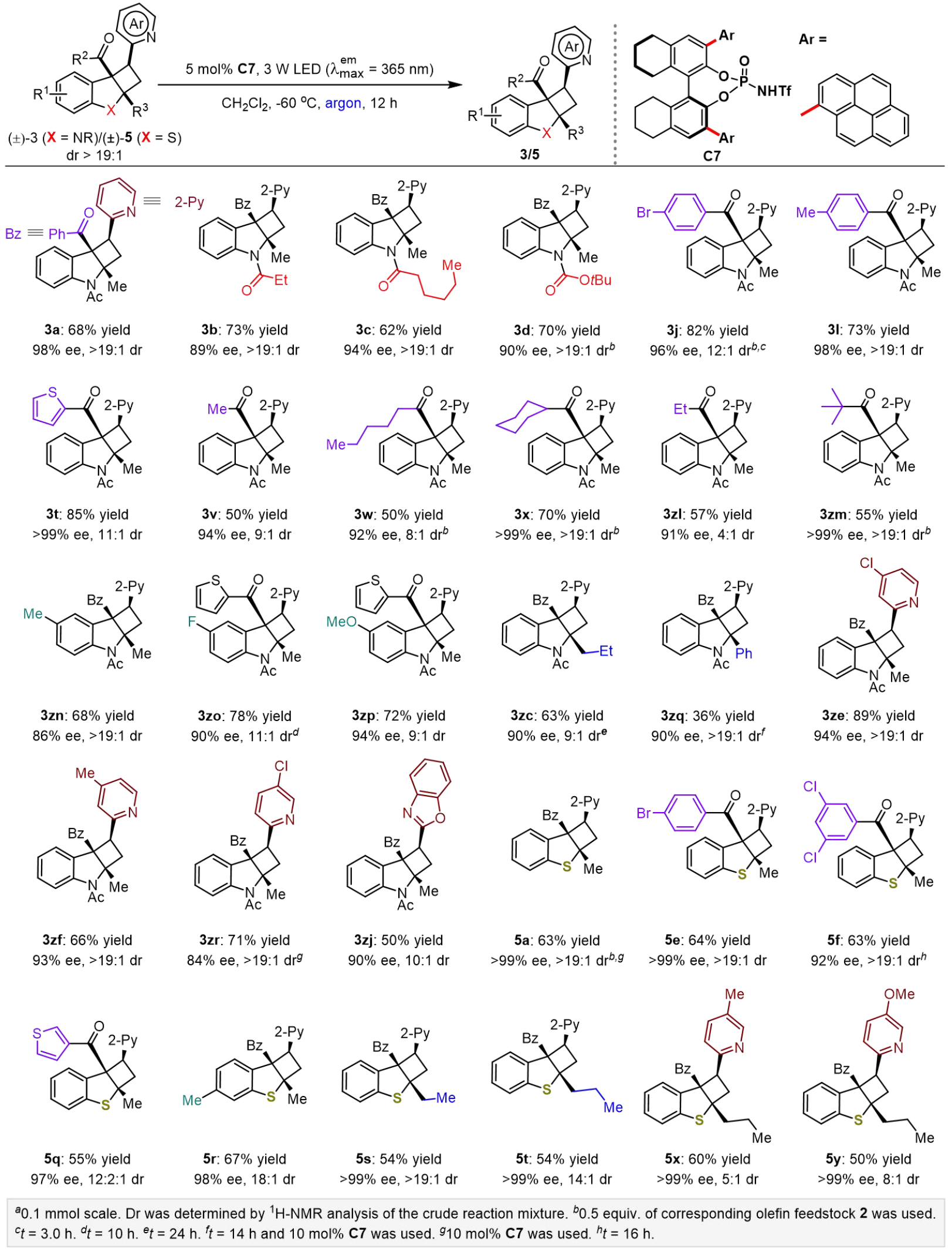
图6. 环丁烷的直接去消旋化(图片来源:JACS)
为了进一步证明从两个不同的物种合成对映体富集的环丁烷应该通过从头去消旋化的策略合成,如图6所示,作者合成了外消旋环丁烷(±)-3和(±)-5,并对这些分子进行了直接去消旋化,在既定的反应条件下,可以获得多种具有代表性的环丁烷,并且具有高产率、ee值和dr值。可能由于光环裂解的反应速率高于光环加成,大多数这些化合物的产率略低于从头合成中获得的结果,几种环丁烷(例如 3zl-zr)无法通过从头去消旋化合成来获得,这也证明了这种直接去消旋化方法的重要性。
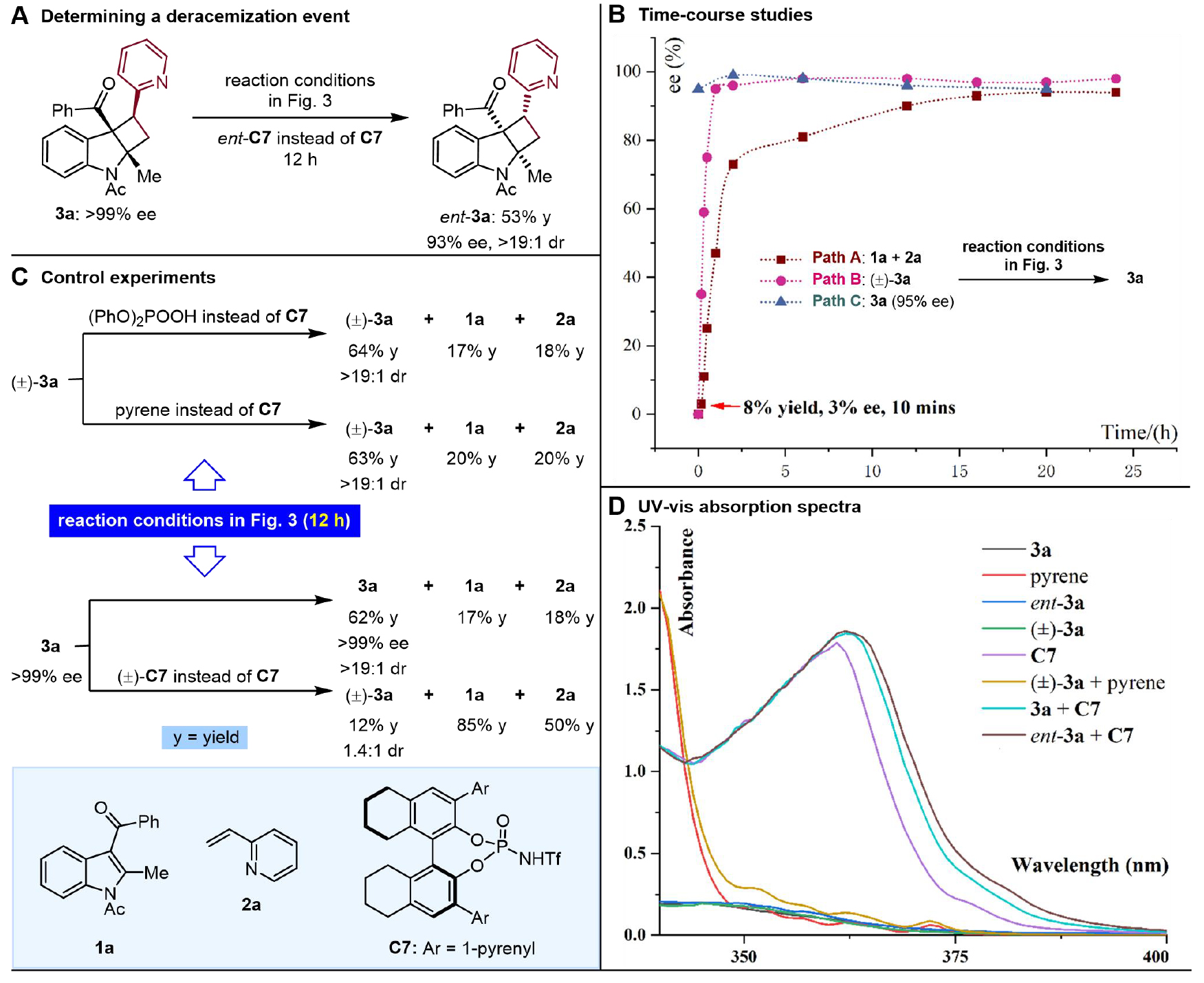
图7. 机理探究(图片来源:JACS)
为了探究反应机理,作者进行了一系列控制实验和光谱测试。首先反应结果大多数情况下产率都在50%以上,可以证明反应的对映选择性富集是由于去消旋化的历程而不是动力学拆分,如图7A所示,3a的三个立体中心成功反转也再次证明了这一点。通过三个途径的ee与反应时间之间的关系(图7, B),发现从头去消旋化合成反应10分钟以8%的产率获得3a,ee值仅为3%,随后ee值迅速增加并趋于稳定,这种关系与对于外消旋(±)-3a 的直接去外消旋化趋势类似(图7B,path B),因此,在手性磷酸 C7 存在下,1a和2a的[2+2]光环加成不能直接产生高度对映体富集的产物3a,可能是因为不可避免的外消旋背景反应性极高。通过控制实验图7C所示,不难发现,与手性催化剂具有匹配构型的环丁烷对映体更容易发生[2+2]光环裂解;通过观察紫外可见吸收光谱(图7D),手性催化剂C7由于含有芘基团,对于所使用光源的光子吸收能力强(紫线),更重要的是它会使ent-3a(深棕色线)比3a(青色线)发生更显著的红移。作者认为环丁烷与手性催化剂形成的两种复合物导致其中一种激发能较低,这基于两种构型的环丁烷与C7缔合时的热力学差异;通过氧化还原电位的测定以及Stern‒Volmer实验证明手性催化剂C7中激发态的芘基团可以被3a氧化,但是这种电子转移并不是光环裂解的原因,因为已经证明了反应可以有氧条件下进行,氧气要比3a更容易被还原,并且3zm的电位和Stern-Volmer 实验证明了两者之间在不利于电子转移的情况下,仍旧可以实现去消旋化反应,以上探究结果所指向的机理与作者在图1D中所设计的一致。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn