

正文
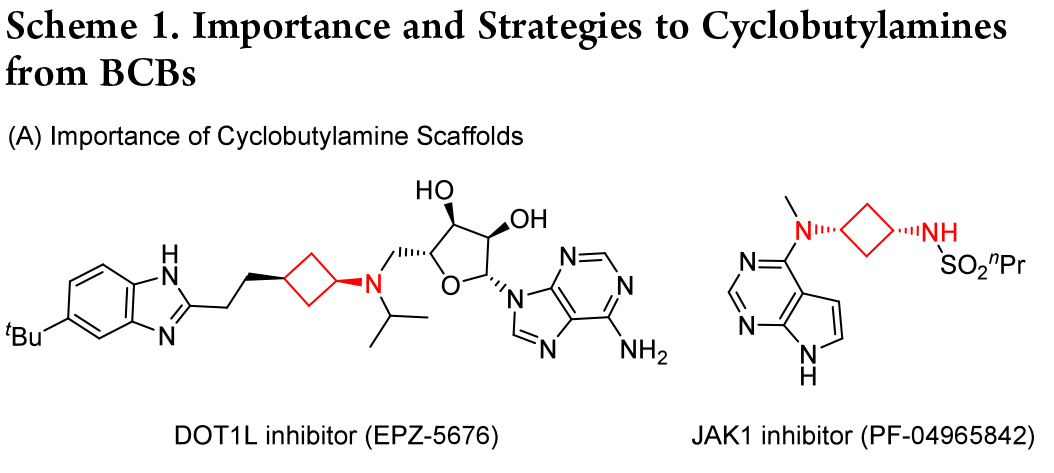
环丁烷是备受青睐的四元环合成目标物,是天然产物和药物中用途广泛的骨架,具备多样的生物学特性,并且还可作为合成结构复杂分子的关键中间体。其中,环丁胺是药物开发中的关键核心,可在多种生物活性分子中找到,如Scheme1所示。因此,开发合成具有立体控制和分子复杂性的环丁胺的新策略,具有重要意义。
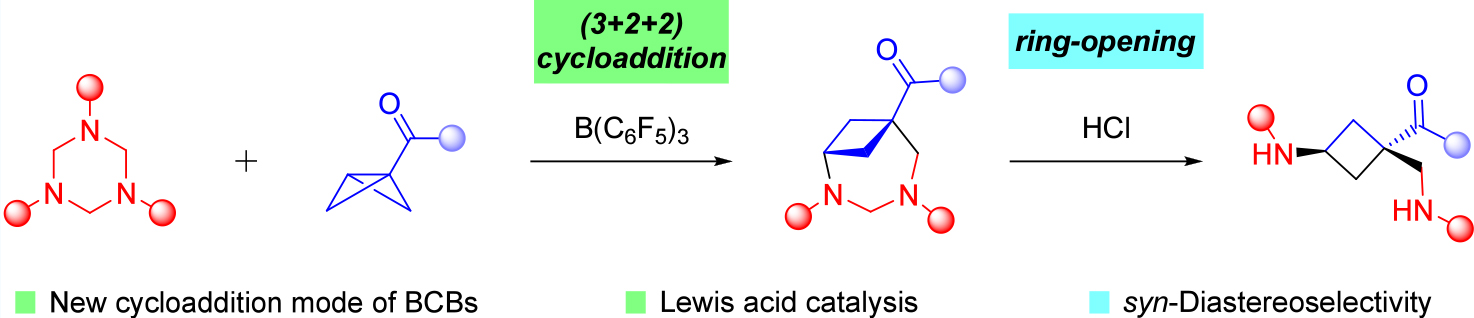
双环 [1.1.0] 丁烷(BCBs)已成为通过应变释放驱动反应来合成不同类型(桥连)环丁烷的优势构建模块。然而,开发用于环丁胺合成的模块化反应仍然具有挑战性。于是作者提出了一种路易斯酸催化策略:通过路易斯酸催化双环 [1.1.0] 丁烷与三嗪烷的 (3+2+2) 环加成/开环策略,实现环丁胺的立体控制合成。
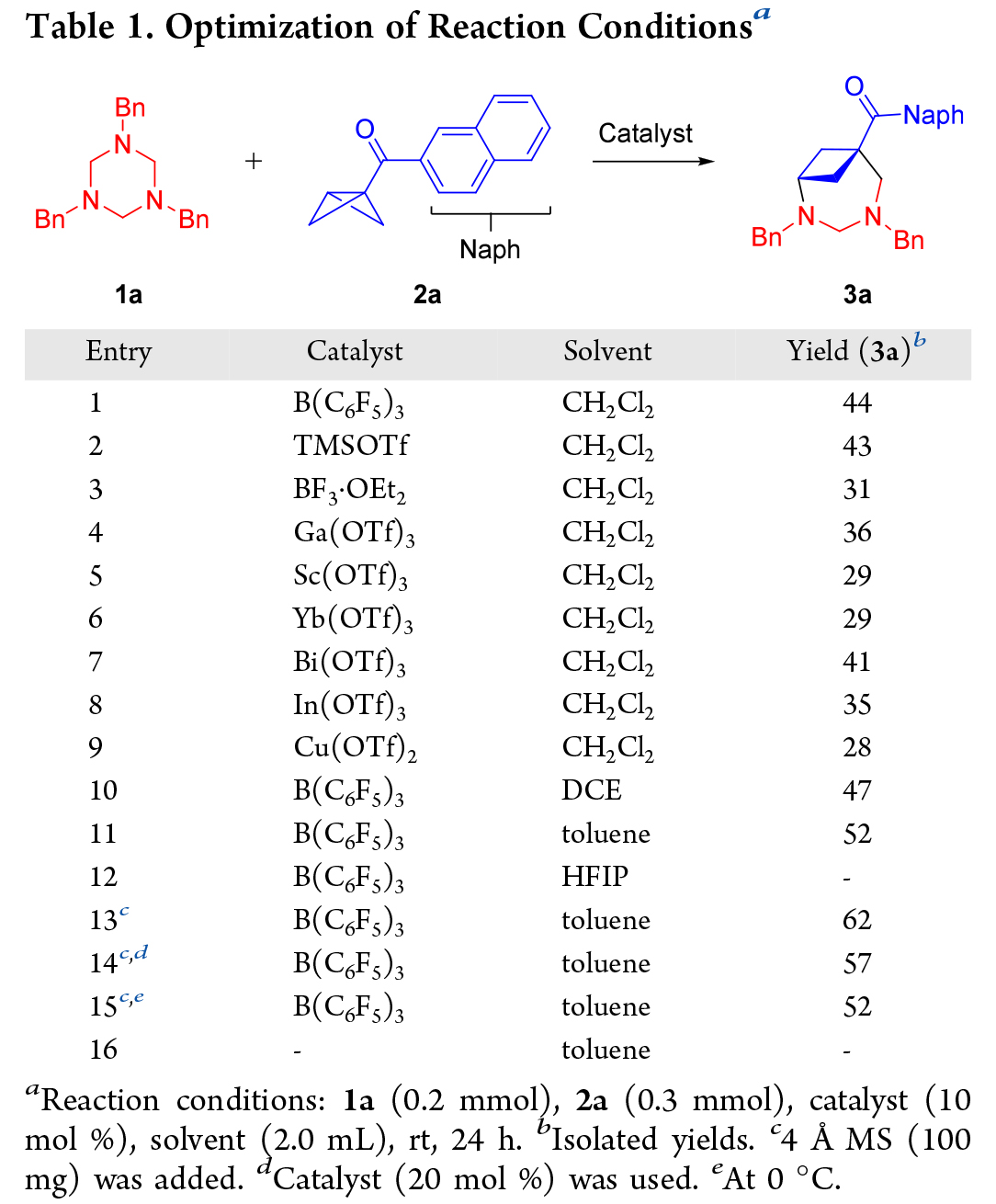
接下来作者选择N-Bn三嗪烷 1a 和 2-萘基BCB酮2a作为模板底物,发现室温下,在二氯甲烷 (CH2Cl2) 中以 B(C6F5)3 作为催化剂反应 24 小时,可以得到 (4+3) 的环加合物 3a(Table 1,entry 1)。随后筛选了多种路易斯酸催化剂(Table 1,entry 2-9),仍然是B(C6F5)3作为催化剂更好。随后,对几种溶剂进行了评估,发现甲苯效果更佳(Table 1,entry 10-12)。进一步优化了各种其他反应参数,例如添加剂、催化剂当量和温度(Table 1,entry 13-15)。最后,最佳条件确定为在室温下在甲苯中加入 10 mol % 的B(C6F5)3作为催化剂和 4Å MS 作为添加剂,产物 3a 的产率为 62%(Table 1,entry 13)。该条件中的关键改进是添加了4Å分子筛 (4Å MS) 以防止三嗪烷 1a 水解。
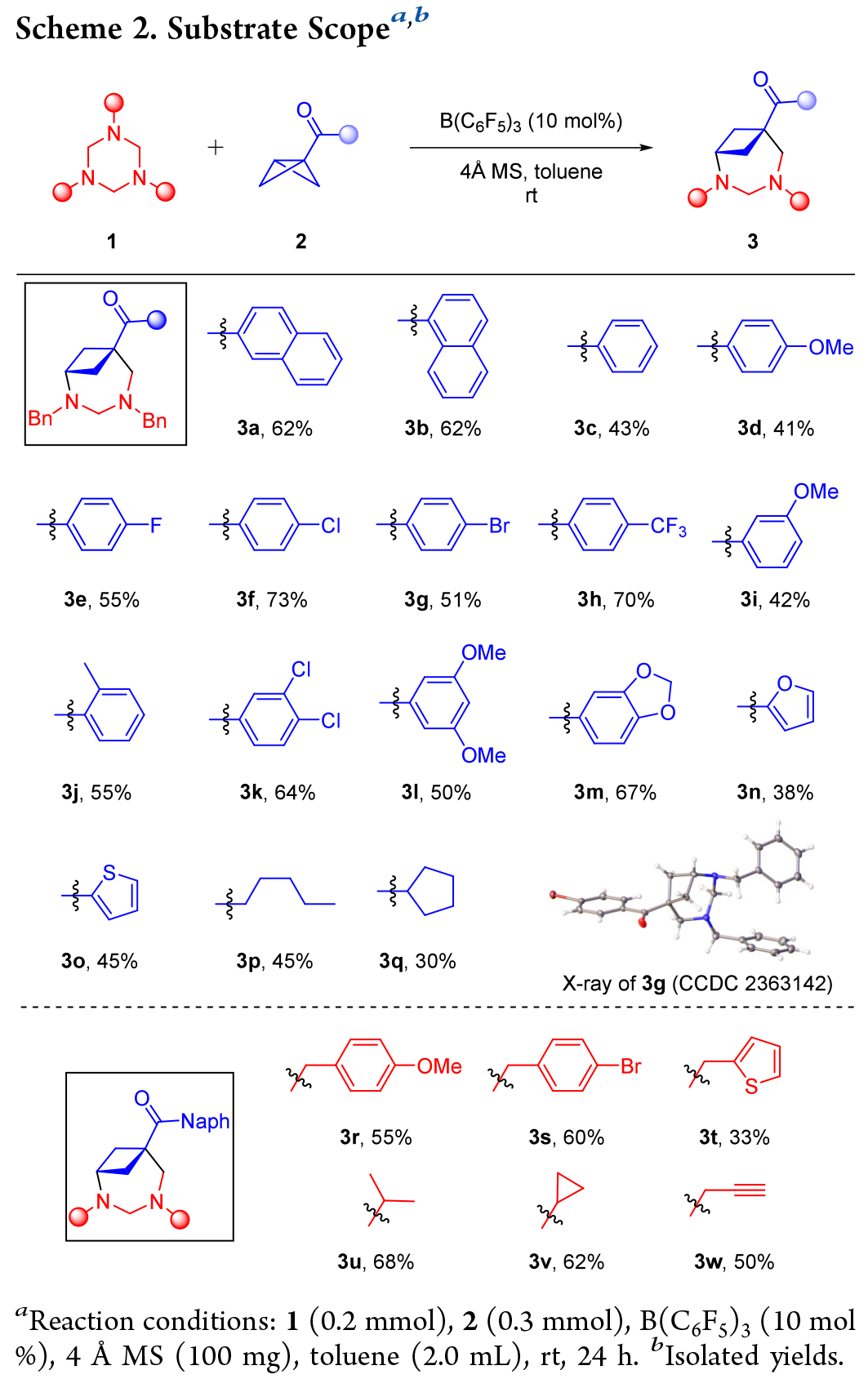
作者在确定了最佳反应条件后,首先对双环 [1.1.0] 丁烷(BCBs)的底物适用范围进行了研究(Scheme 2,上部)。1-萘基、苯基以及苯环任意位置带有单个供电子(甲基、甲氧基)或吸电子(卤素、三氟甲基)取代基的BCB酮都能以中等至良好的产率生成目标产物(3c - j)。此外,多取代芳基和杂芳基(呋喃、噻吩)、烷基取代的BCB酮也适用于该反应(3k - q)。进一步探索了三嗪烷的应用范围(Scheme 2,下部)。其他几种带有给电子(甲氧基)、吸电子(溴)或杂芳族(噻吩)基团的N-苄基三嗪烷以及三嗪烷N原子上引入烷基、炔基都得到了很好的应用(3r - w)。
接下来,作者将注意力转向阐明环加成反应机理。当使用 N-PMP(对甲氧基苯基)三嗪烷 1b 与 2a 反应时(Scheme 3A), 分离出三种主要产物,目标产物3x、环丁胺 4b和氮杂双环 [2.1.1] 己烷5b,而未检测到环丁烯胺 6b。这一结果证实了三嗪烷与路易斯酸活化的 BCB 酮发生类SN2 亲核加成反应的可能性更大;其次,5b 的形成表明环加成可能通过逐步 (3+2+2) 而不是 (4+3) 过程进行。随后进行了几个控制和氘标记实验。1a 和 1c 与 2a 的竞争反应产生了四种可分离产物,包括 3a、3r 和两个交叉环加成物 3y/3y′(Scheme 3B)。
此外,[D6]-1a 与 2a 的反应生成完全氘化产物 [D4]-3a(Scheme 3C,顶部)。用 2a 与 1a 和 [D6]-1a 反应后,生成不可分离的混合物,其中含有 [D2]-3a,经 HRMS 分析检测(Scheme 3C,底部)。这些结果表明,aza-BCO的形成是通过 (3+2+2) 路径,而非 (4+3) 环加成途径。
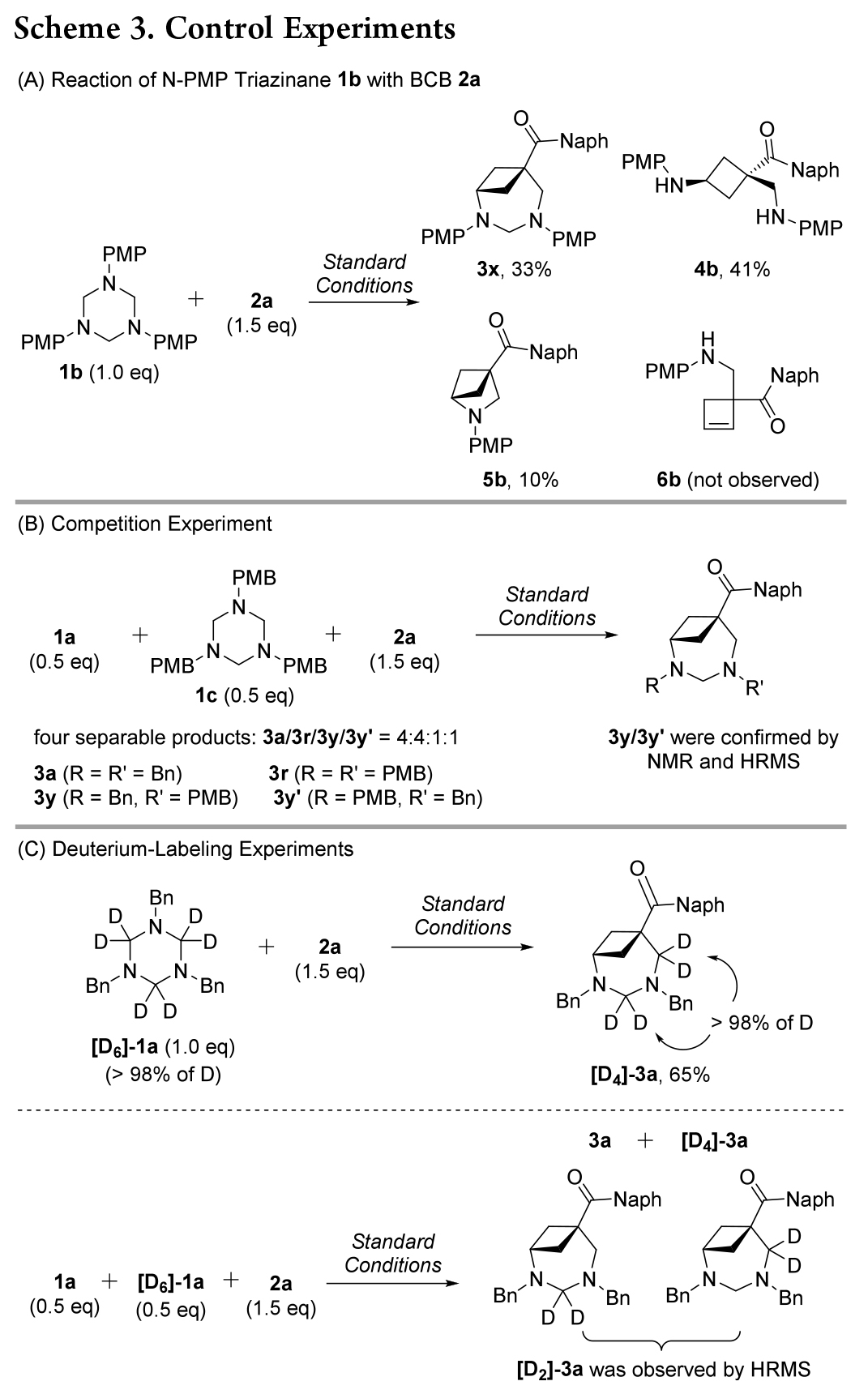
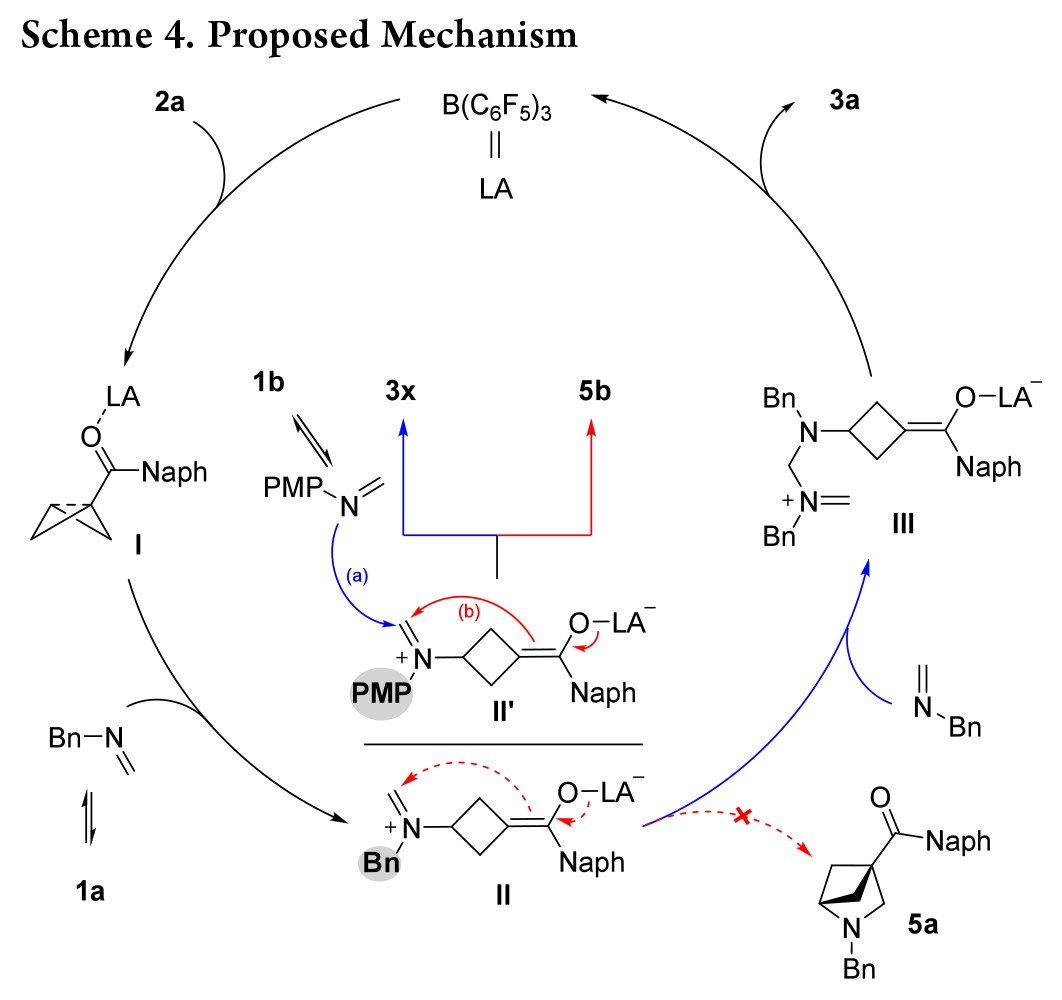
根据以上结果,作者提出了一种可能的机理(Scheme 4)。首先,B(C6F5)3 活化2a 形成复合物 I。然后,甲醛亚胺(由三嗪烷 1a 原位生成)与 I 进行类 SN2亲核加成,生成中间体 II。随后与另一分子甲醛亚胺反应生成中间体 III。最后,分子内环化释放 B(C6F5)3 催化剂,生成产物 3a。对于中间体 II,与烯醇盐对亚胺基团的分子内进攻相比,更倾向于另一种甲醛亚胺的分子间加成(III vs 5a),这可能是由于甲醛亚胺的 Bn-N 原子的亲核性高于烯醇盐。因此,当使用亲核性较低的N-PMP甲醛亚胺时,中间体 II′的分子内环化(路径 b)与另一个 N-PMP 甲醛亚胺与 II′的分子间加成(路径 a)发生竞争,同时生成产物 5b 和 3x。
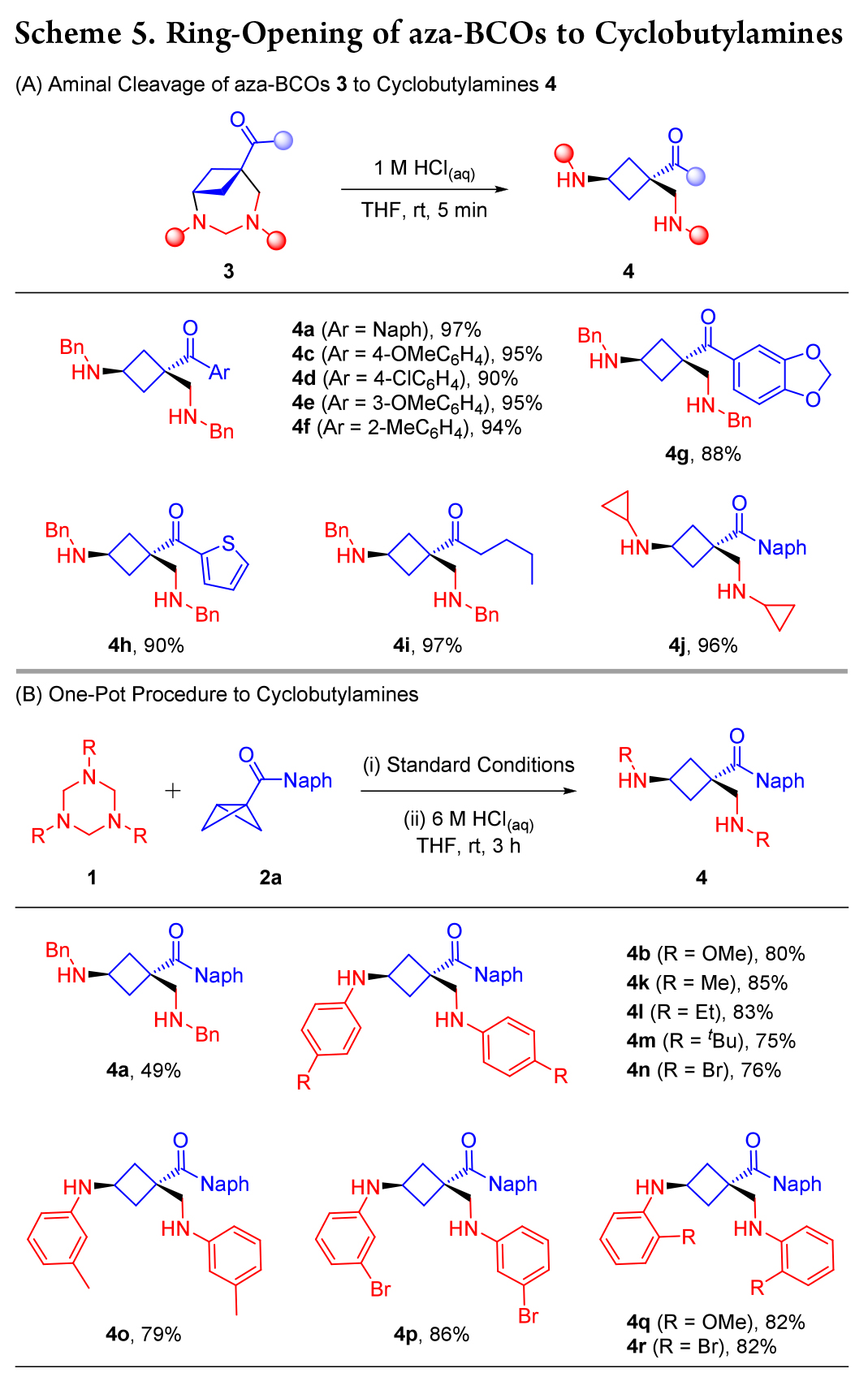
随后作者将重点放在了氮杂-双环 [4.1.1] 辛烷(aza-BCOs)的开环上(Scheme 5)。在酸性条件下,缩醛胺基团的断裂被证明是可行的,3a高效地转化为相应的环丁胺 4a,产率为 97%。作者选择了Scheme 2 中一系列的aza-BCOs,均成功以优良产率转化为环丁胺4c - j(Scheme 5A)。此外,这种“环加成/开环”过程可以一锅法进行。
N-Bn三嗪烷1a与BCB酮 2a 在标准条件下的反应完成后,直接用酸处理,尽管反应时间更长,且酸性更强的条件下进行(Scheme 5B),仍成功得到环丁胺 4a,产率为 49%。此外,作者发现 3x 不稳定,在硅胶或CDCl3中会分解为环丁胺4b,因此一锅法更适合N-PMP三嗪烷1b与2a的反应,产物4b的产率为80%. 进一步改变胺上连接的芳基对反应没有影响,产率在75-86%之间(4k - r)。
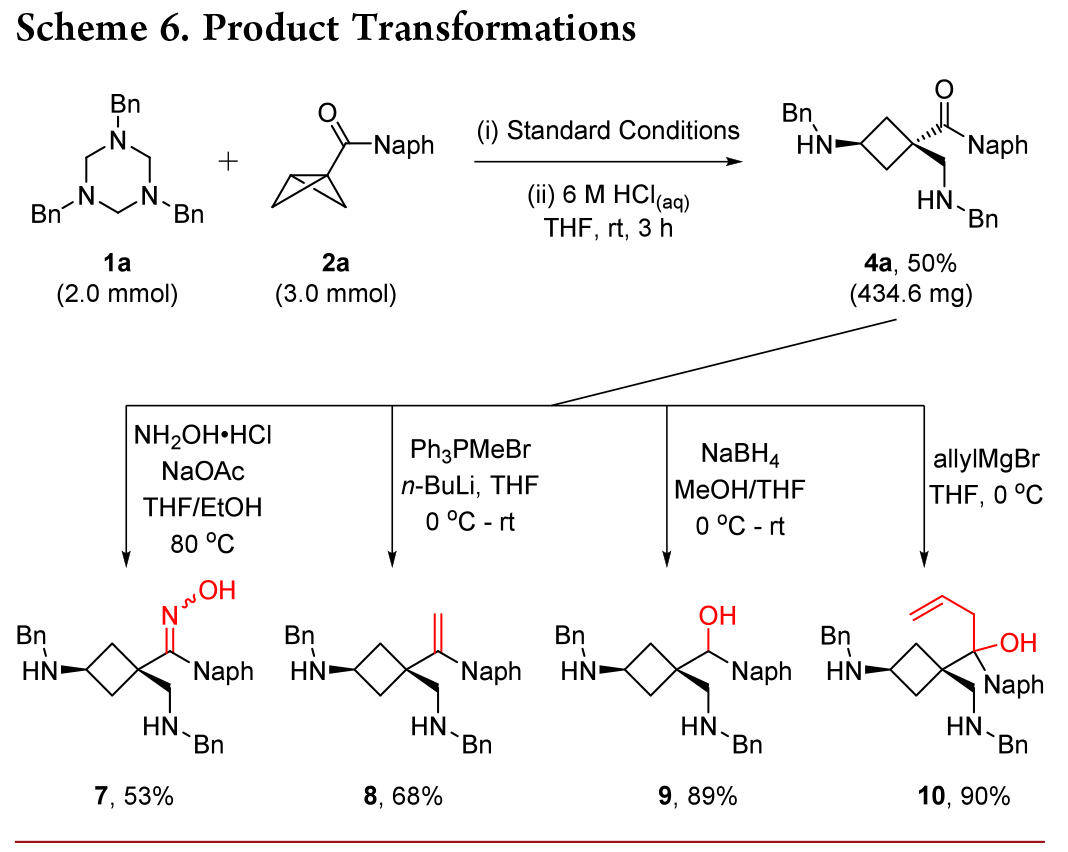
如Scheme 6 所示,在标准条件下,N-Bn 三嗪烷 1a 与 BCB 酮 2a 发生大量反应,随后经酸处理,生成环丁胺 4a,产率为 50%,进一步证明了该策略的稳定性。所得产物 4a 可用作各种转化的载体,通过缩合 (7)、Wittig 烯化 (8)、还原 (9) 和烯丙基化 (10) 获得各种功能化的环丁烷骨架。这些转化证明了该策略的潜在合成效用。
总结
作者简介
五邑大学药学与食品工程学院彭士勇课题组成立于2017年,研究方向为金属有机化学,不对称合成。现已在ACS Catal., Org. Lett., J. Org. Chem.等期刊发表相关学术论文30余篇,主持国家自然科学基金,广东省自然科学基金、广东省教育厅、五邑大学高层次人才项目5项,详见课题组主页:https://www.x-mol.com/groups/peng_shiyong
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn