

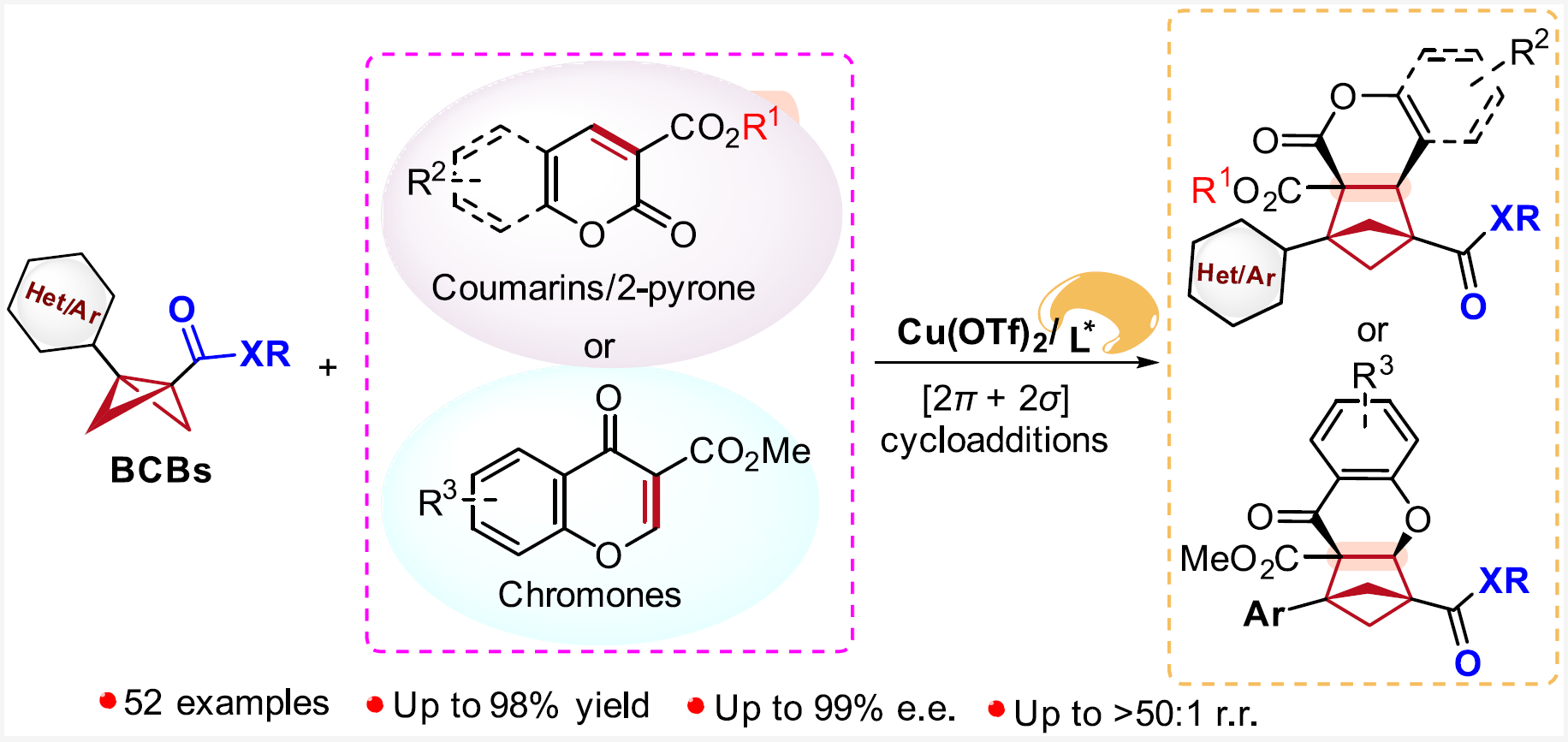
正文
在药物化学研究中,根据“逃离平面”概念,提高sp³杂化碳的比例和手性碳的数目可以增加候选药物分子的复杂性,从而提高其临床成功率;因此三维(3D)、饱和的、桥环类化合物在药物化学中受到广泛关注,其中全碳的双环[2.1.1]己烷(BCHs)能够作为多种不同取代苯基的生物电子等排体;然而,目前手性全碳的BCHs的合成方法尚未得到充分研究,且手性全碳的BCHs替代生物活性分子(或小分子药物)中的苯环及其相应的生物活性研究还未见文献报道(图1A)。
双环[1.1.0]丁烷(BCBs)的[2π + 2σ]环加成反应是构建BCHs最简便的方法之一。2022年,Glorius课题组(德国明斯特大学)报道了光催化BCBs与香豆素等的[2π + 2σ]环加成反应,成功合成了1,2,3-三取代、全碳的BCHs(图1B)。Studer(德国明斯特大学)、冯见君(湖南大学)、邓力&倪冬顺团队(西湖大学)、李鹏飞(西安交通大学)和王洪根(中山大学)等国内外的课题组在这一领域进行了广泛而细致的研究。2023年,Thorsten. Bach课题组(德国慕尼黑工业大学)报道了首例光介导的BCBs的[2π + 2σ]不对称环加成反应,但该反应需要2当量的手性光敏剂;随后,江智勇课题组(河南师范大学)报道了光与手性磷酸催化BCBs的[2π + 2σ]不对称环加成反应;最近,冯见君(湖南大学)、李孝训(山东大学)、周其林(南开大学)等课题组也报道了BCBs与多类底物的不对称环加成反应,构建各种手性的杂芳基生物电子等排体,这些工作基本和作者的研究工作是同期进行的。尽管有了这些重大进展,但通过路易斯酸催化BCBs的不对称[2π + 2σ]环加成反应来构建手性、多取代的、全碳BCHs的方法仍未见文献报道(截至作者投稿时)。鉴于BCBs的高应变能、固有的不稳定性和高反应性,如果要实现以上策略,需亟待解决以下诸多挑战:1)极性翻转的Alder-ene反应(Bai, D. & Chang, J. et al. Nat. Commun. 2024, 15, 2833.);2)开环反应(Feng, J.-J. et al. Chem. Sci. 2023, 14, 9696.);3)消除反应(Feng, J.-J. et al. Angew. Chem., Int. Ed. 2023, 62, e202310066.; Leitch, D. C. et al. Angew. Chem., Int. Ed. 2022, 61, e202204719.);4)强大的外消旋背景反应(Ni, D. & Deng, L. et al. Angew. Chem., Int. Ed. 2023, 62, e202308606.);5)区域选择性问题(Zhang, J.-L. & Feng, J.-J. et al. J. Am. Chem. Soc. 2024, 146, 19621.)等(图1C);此外,同时构建相邻三级-四级手性碳中心也是一个巨大的挑战。
针对以上问题,清华大学深圳国际研究生院/深圳湾实验室蒋宇扬团队、南方科技大学刘心元团队和清华大学深圳国际研究生院林进顺团队合作发展了路易斯酸催化BCBs分别与香豆素、2-吡喃或色酮等的不对称分子间[2π + 2σ]环加成反应,以优秀的对映/非对映/区域选择性合成了结构多样的、具有邻位的三级-四级碳手性中心的、1,2,3,4-四取代的、全碳的BCHs。在该反应中,手性双噁唑啉配体的引入可有效抑制副反应、能显著地减少外消旋的背景反应,并精确调控反应活性以及区域、对映和非对映选择性,所得的手性BCHs可以替代抗肿瘤药物Sonidegib和非肽类小分子PD-1/PD-L1抑制剂BMS-202中的苯环,并合成了这两个生物活性分子的手性类似物BCHex-Sonidegib和BCHex-BMS-202,并评估了二者的理化性质和药理学特性(图1D)。
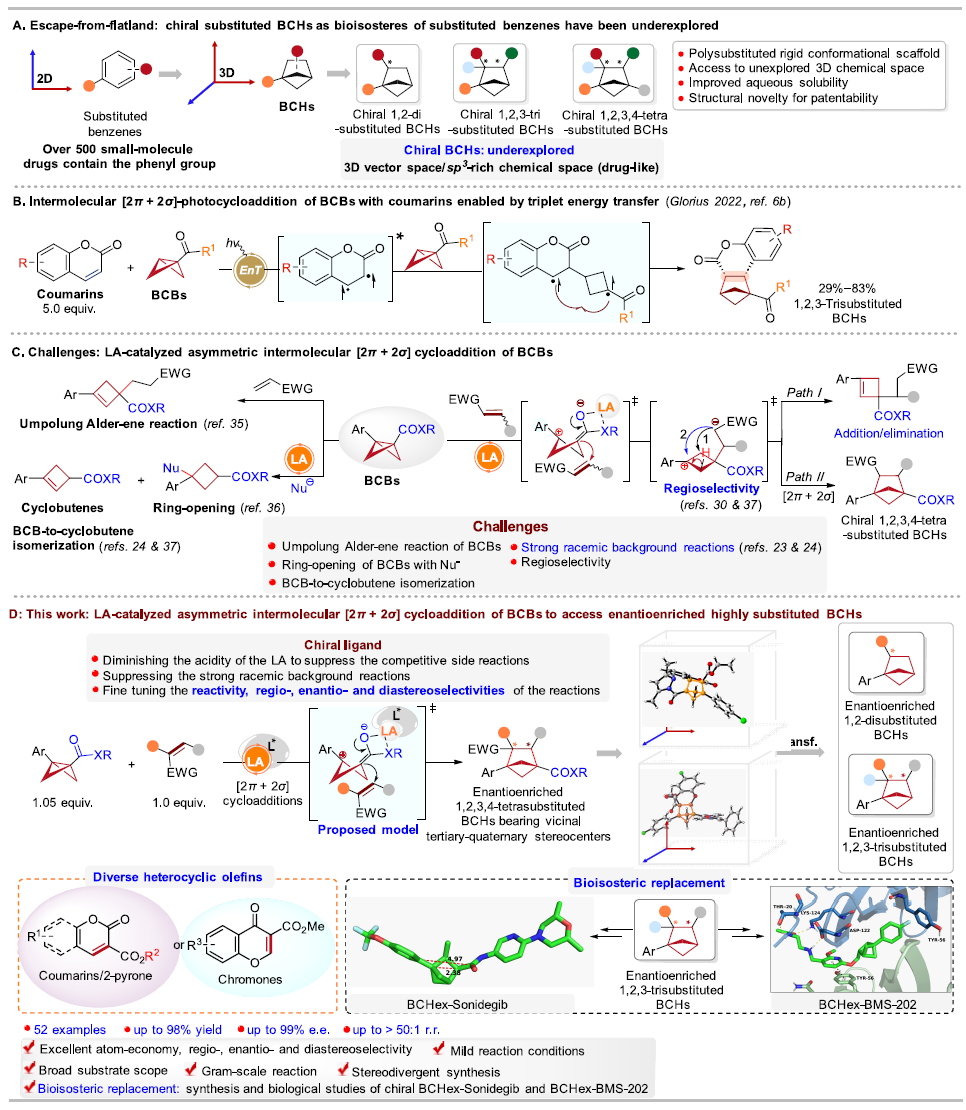
图1. 路易斯酸催化BCBs的不对称[2π + 2σ]环加成反应构建手性BCH化合物
作者对手性配体、路易斯酸和溶剂等反应条件进行系统性筛选,获得了以下最优条件:Cu(OTf)2/L*12为手性催化体系,DCM作溶剂,在-20 ℃下反应。在该条件下,香豆素乙酯可与具有酰基吡唑基团的BCBs底物进行不对称[2π + 2σ]环加成反应,以优异的产率和对映选择性(95%,97% e.e.)得到手性BCHs产物(图2)。
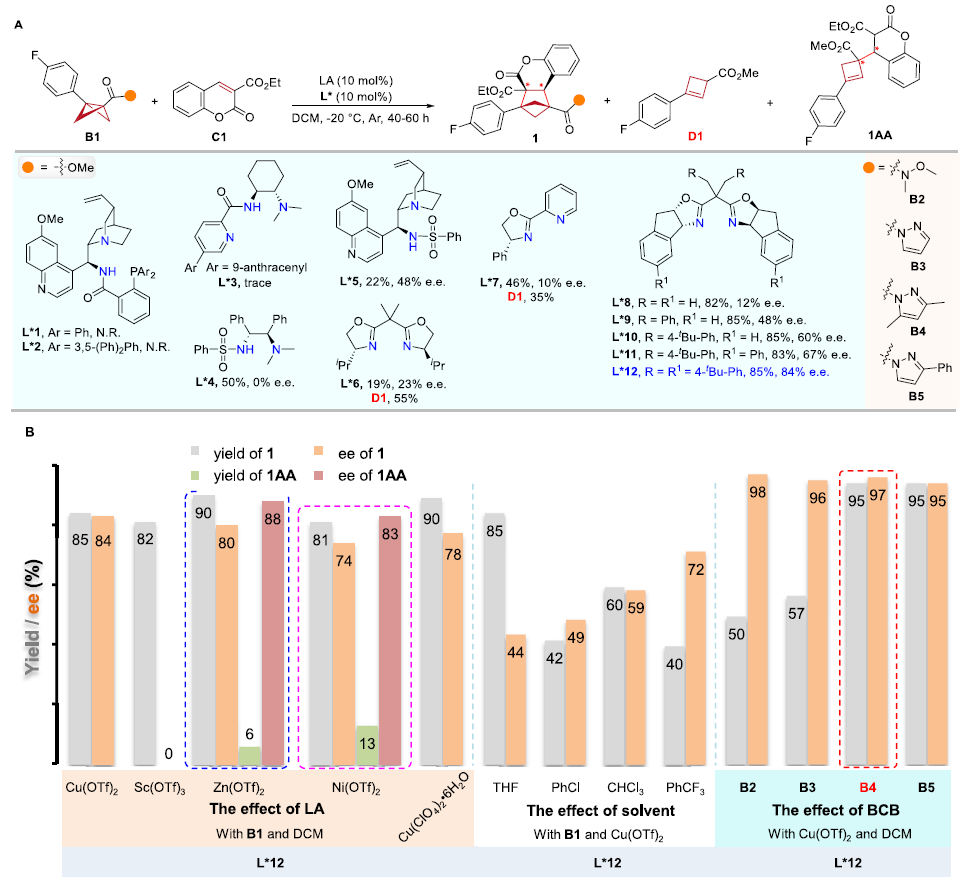
图2. 反应条件的优化
在确定了最佳反应条件后,作者对反应的底物普适性进行考察。首先,BCBs芳环上取代基的位置和电性对反应效率和立体选择性的影响较小。特别值得一提的是,作者通过3-噻吩和苯乙炔取代的BCBs得到了相应的BCHs(17和18),苯乙炔取代的BCBs中的炔基可能会在BCB的相关自由基反应过程中发生反应,但在该催化体系中能很好的保持;此外,产物18的还原可能生成含有苯乙烯的BCH,可以作为苯乙烯的生物电子等排体。接下来,作者对香豆素底物范围进行考察,含有不同酯或酰胺基团的香豆素底物均具有良好的产率和对映选择性,值得注意的是,带有烯基或炔基的香豆素在相关的自由基反应中倾向于发生分子内[2+2]环加成;含有给电子基团或吸电子基团和不同位置取代以及萘环的香豆素底物都能够以中等至优异的收率得到高对映选择性的BCHs产物(图3)。

图3. BCB和香豆素底物的普适性考察
此外,作者还意外发现在路易斯酸和手性配体的催化下,BCBs与2-吡喃底物并没有发生预期的不对称Diels-Alder类([4π + 2σ])环加成反应,生成手性双环[4.1.1]辛烷,而是仍然发生[2π + 2σ]环加成生成了相应的BCHs,该结果极大地扩展了已知的2-吡喃反应模式。此外,BCBs与色酮底物的不对称[2π+2σ]环加成反应也顺利得到了相应的手性BCHs产物(图4)。
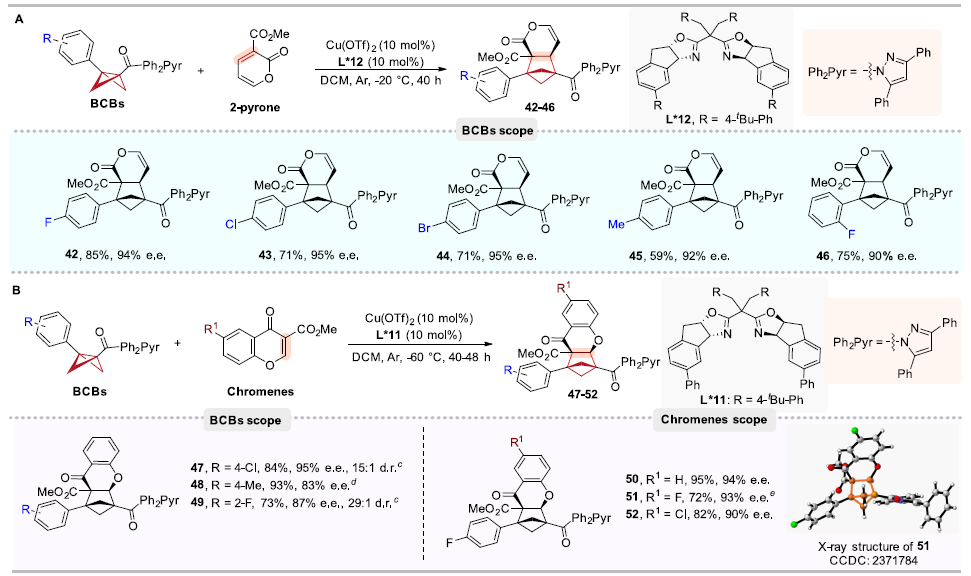
图4. BCB和2-吡喃及色酮底物的普适性考察
为了进一步展示该反应体系的实用性,作者进行了放大实验(克级)(图5A),反应仍具有高效和高立体选择性。BCHs产物中的酰基吡唑基团可以方便的进行后续官能团化转化,合成一系列手性BCHs衍生物,得到1,2-二取代和1,2,3-三取代的BCHs(图5 B-C),这些转化产物提供了实用的手性BCHs模块,在上述转化中BCHs的e.e.都能保留,进一步证明了该方法在合成中的实用性。此外,作者使用手性配体L*12的对映异构体ent-L*12实现手性BCH产物12的立体发散性合成,得到了对映异构体ent-12(图5D)。
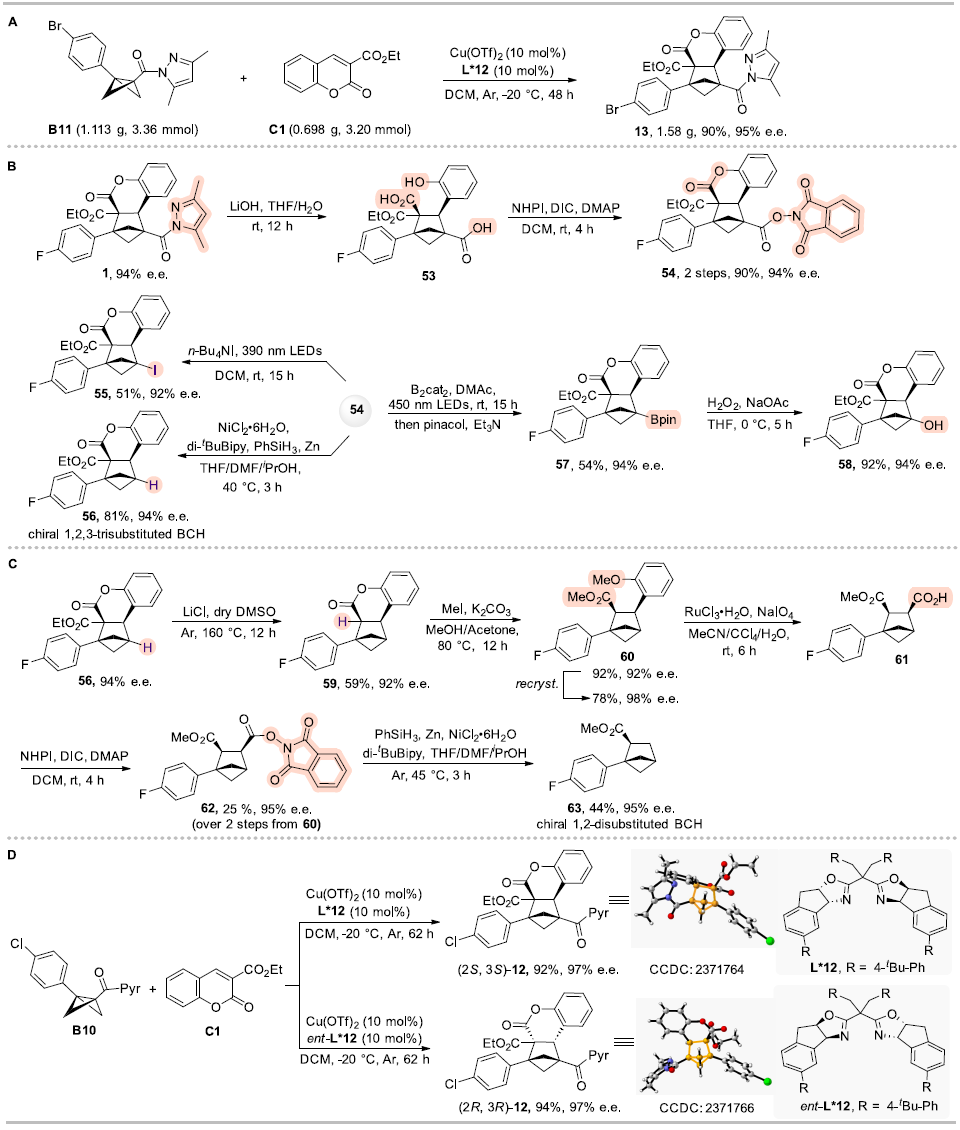
图5. 合成应用
为了展示1,2,3-三取代BCHs作为1,2,3-三取代苯的替代物的应用价值,作者设计并合成了抗癌药Sonidegib的类似物BCHex-Sonidegib和非肽类PD-1/PD-L1小分子抑制剂BCHex-BMS-202。作者使用软件模拟了Sonidegib和BCHex-Sonidegib的三维构象,发现二者能够良好重叠,表明替代前后分子的空间几何特征基本相同;并使用分子对接模拟预测了手性BCHex-BMS-202与PD-L1的结合模式,结果表明其结合构象与BMS-202基本一致,并保留了关键的π-π相互作用(图6)。这些结果应证了BCHs作为苯的生物电子等排体的可行性。
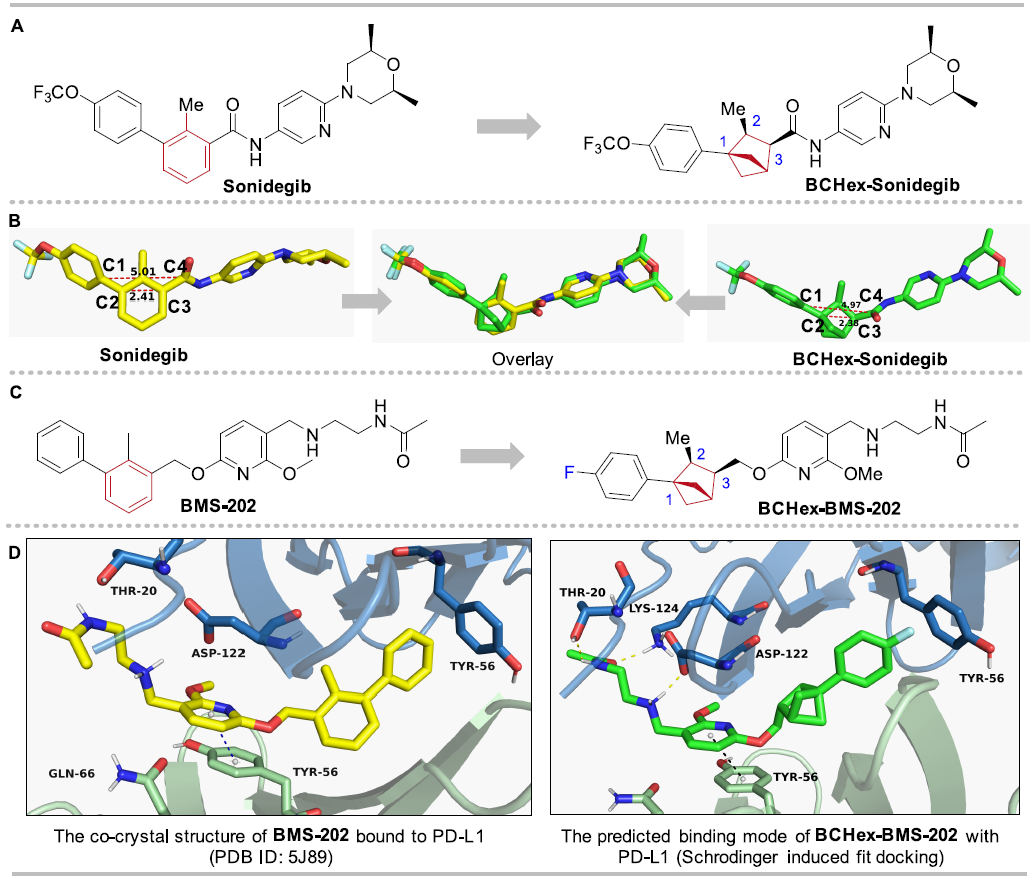
图6. 生物等排替代和计算模拟预测
作者分别合成了BCHex-Sonidegib和BCHex-BMS-202,并评估了分子的理化性质和药理学特性,结果显示,与阳性对照Sonidegib和BMS-202相比,BCHex-Sonidegib和BCHex-BMS-202表现出更好的溶解性和代谢稳定性(图7);同时,它们表现出与阳性对照Sonidegib和BMS-202相当的抗肿瘤活性、在正常的肝脏细胞中表现出更低的毒性(表1),且能诱导肿瘤细胞凋亡和抑制肿瘤细胞的克隆形成(图8)。
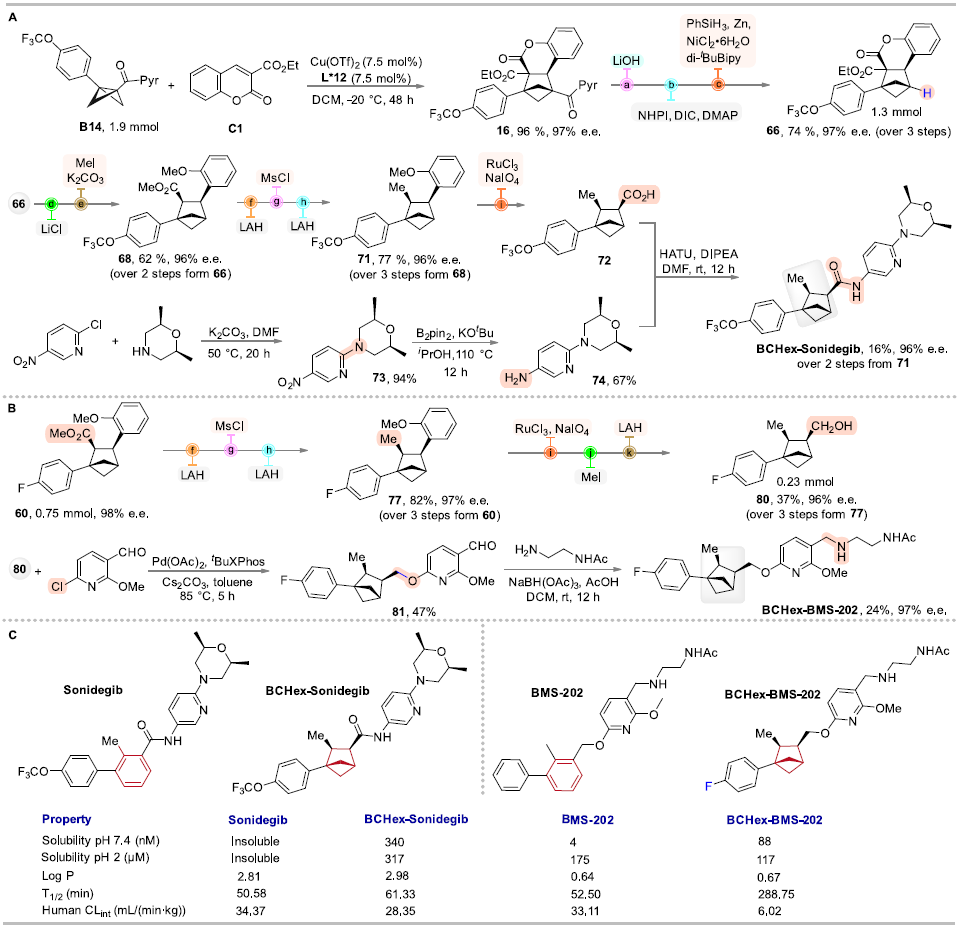
图7. BCHs生物等排体的合成路线与理化性质分析
表1. 化合物对人类肿瘤细胞系和正常肝细胞的抗肿瘤活性
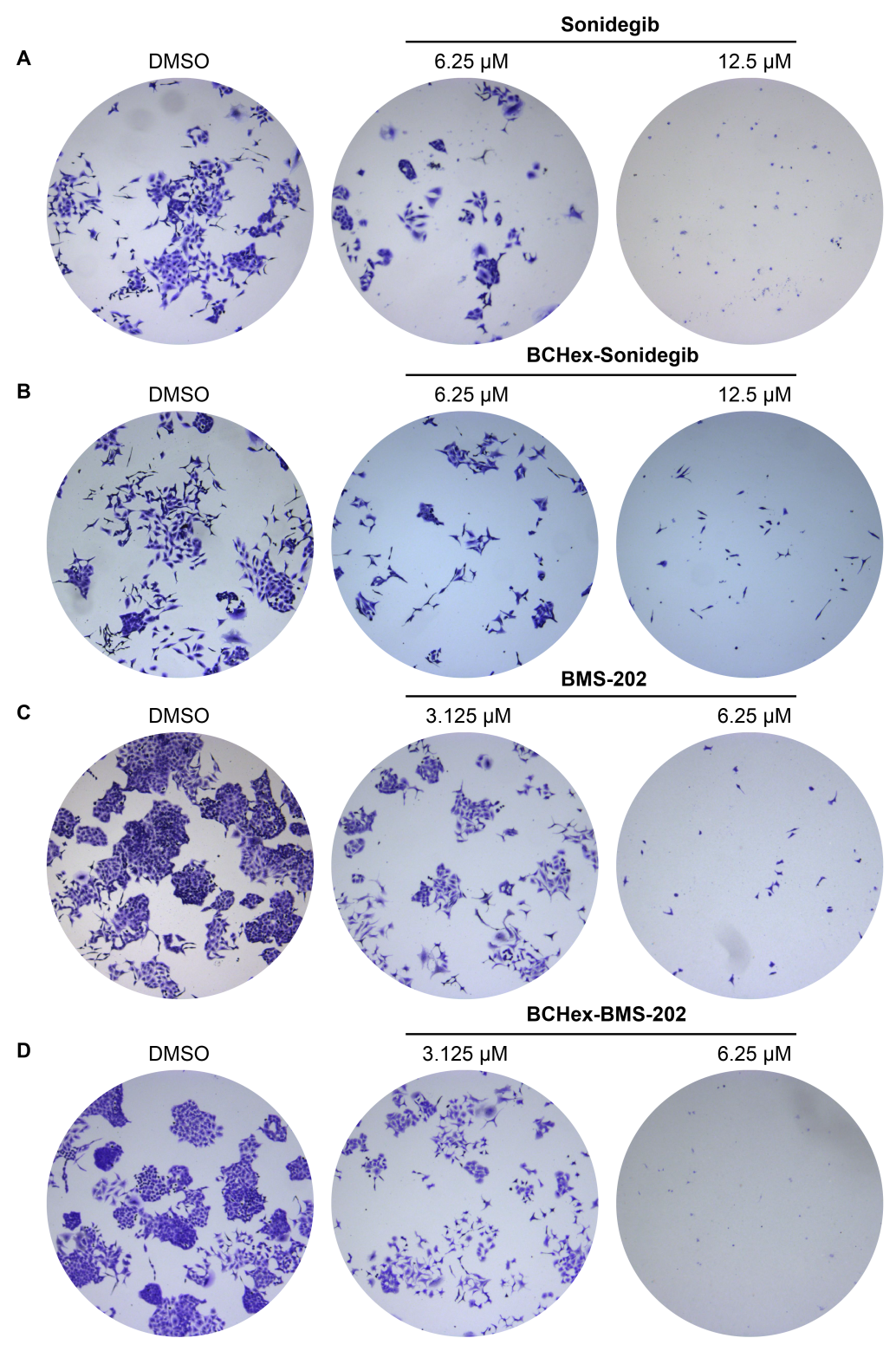
图8. 化合物抑制肿瘤细胞A549的克隆形成
为了深入了解反应机理,作者进行了自由基捕获实验、控制实验等一系列机理实验,证明了:反应不涉及自由基历程;手性双噁唑啉配体能够有效降低路易斯酸的酸性,抑制BCB的分解;香豆素底物的环外酯基作为配位基团与路易斯酸结合,从而促进反应和立体诱导。最后,作者发现环丁烯中间体1AA在标准反应条件下未得到手性BCH产物,这表明BCBs的环加成并未通过环丁烯中间体进行。基于上述实验结果和文献报道,作者提出了路易斯酸催化的BCBs不对称分子间[2π + 2σ]环加成反应的可能反应机制(图9)。
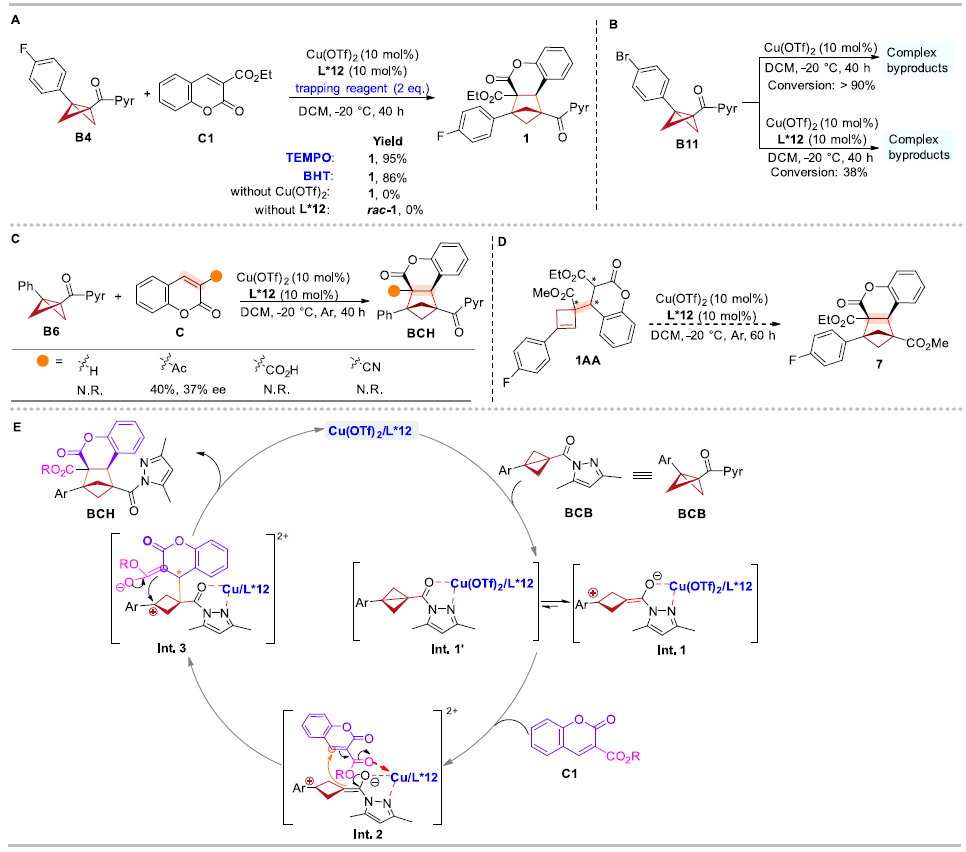
图9. 机理实验和推测的机理
总结
综上所述,清华大学深圳国际研究生院/深圳湾实验室蒋宇扬团队、南方科技大学刘心元团队和清华大学深圳国际研究生院林进顺团队合作发展了路易斯酸/手性配体催化的BCBs分别与香豆素、2-吡喃或色酮的不对称分子间[2π+2σ]环加成反应,以优秀的对映/非对映/区域选择性合成了结构多样的、具有邻位的三级-四级碳手性中心的、1,2,3,4-四取代的、全碳的BCHs。接着,作者合成了抗癌药物Sonidegib和非肽类小分子PD-1/PD-L1抑制剂BMS-202的手性BCHs类似物:BCHex-Sonidegib和BCHex-BMS-202。与Sonidegib和BMS-202相比,BCHex-Sonidegib和BCHex-BMS-202在体外的理化性质都得到显著改善,同时具有与Sonidegib和BMS-202相当的抗肿瘤活性,并表现出抗增殖效果、诱导肿瘤细胞凋亡和抑制肿瘤细胞克隆形成。这项研究工作是国际上首次利用手性1,2,3-三取代的BCHs替代1,2,3-三取代的苯环,突显了手性多取代BCHs作为苯环生物电子等排体在药物化学中的潜在应用。
这一成果近期发表在Journal of the American Chemical Society上,清华大学深圳国际研究生院/深圳湾实验室蒋宇扬教授、南方科技大学刘心元教授和清华大学深圳国际研究生院林进顺博士为本论文的共同通讯作者;清华大学深圳国际研究生院为第一完成单位,清华大学硕士生李英杰和吴志龙、南方科技大学顾强帅副教授和深圳湾实验室樊婷婷副研究员为论文的共同第一作者。该工作得到了深圳市科技创新委员会、广东省本土创新团队项目和深圳湾实验室科研启动基金等的支持。最后,作者衷心感谢哈尔滨工业大学(深圳)的夏吾炯教授、郭林副教授和师成城博士在光催化反应方面提供的帮助,以及南方科技大学化学系的常晓勇博士在X射线晶体学分析方面的协助。

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn