


(图片来源:J. Am. Chem. Soc.)
正文
目前,已知有超过50种植物来源的单萜生物碱天然产物,它们具有共同的保守的氮杂双环[4.3.0]骨架,但在立体化学构型及氧化修饰模式上存在差异(Figure 1A)。其中,备受关注的化合物是Incarvillateine(1),该分子展现出强效镇痛活性,且是传统中药野生植物角蒿(Incarvillea sinensis)的活性成分。针对Incarvilline(2)其结构紧凑但立体化学复杂的双环核心,目前已开发了多种合成策略(Figure 1B)。在首例不对称合成中,Kibayashi课题组(J. Am. Chem. Soc. 2004, 126, 16553.)利用环戊烯酮(7)的分子内Heck偶联反应构建了哌啶环。随后,Bergman与Ellman课题组(J. Am. Chem. Soc. 2008, 130, 6316.)开发的合成路线则依赖铑催化的非对映选择性C−H活化生成环戊烷骨架。然而,上述方法及所有其他已知合成策略中,[4.3.0]-氮杂双环均通过多步反应构建,且立体生成中心与氧化修饰模式需在合成早期阶段确立。由此可见,若要合成该家族其他成员化合物,需通过从头合成并可能依赖全新的成环策略。相比之下,生物合成路径的设想则提出:环烯醚萜骨架(9,iridoid)可通过酶促过程直接由无环前体8-Oxogeranial(8)组装而成。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
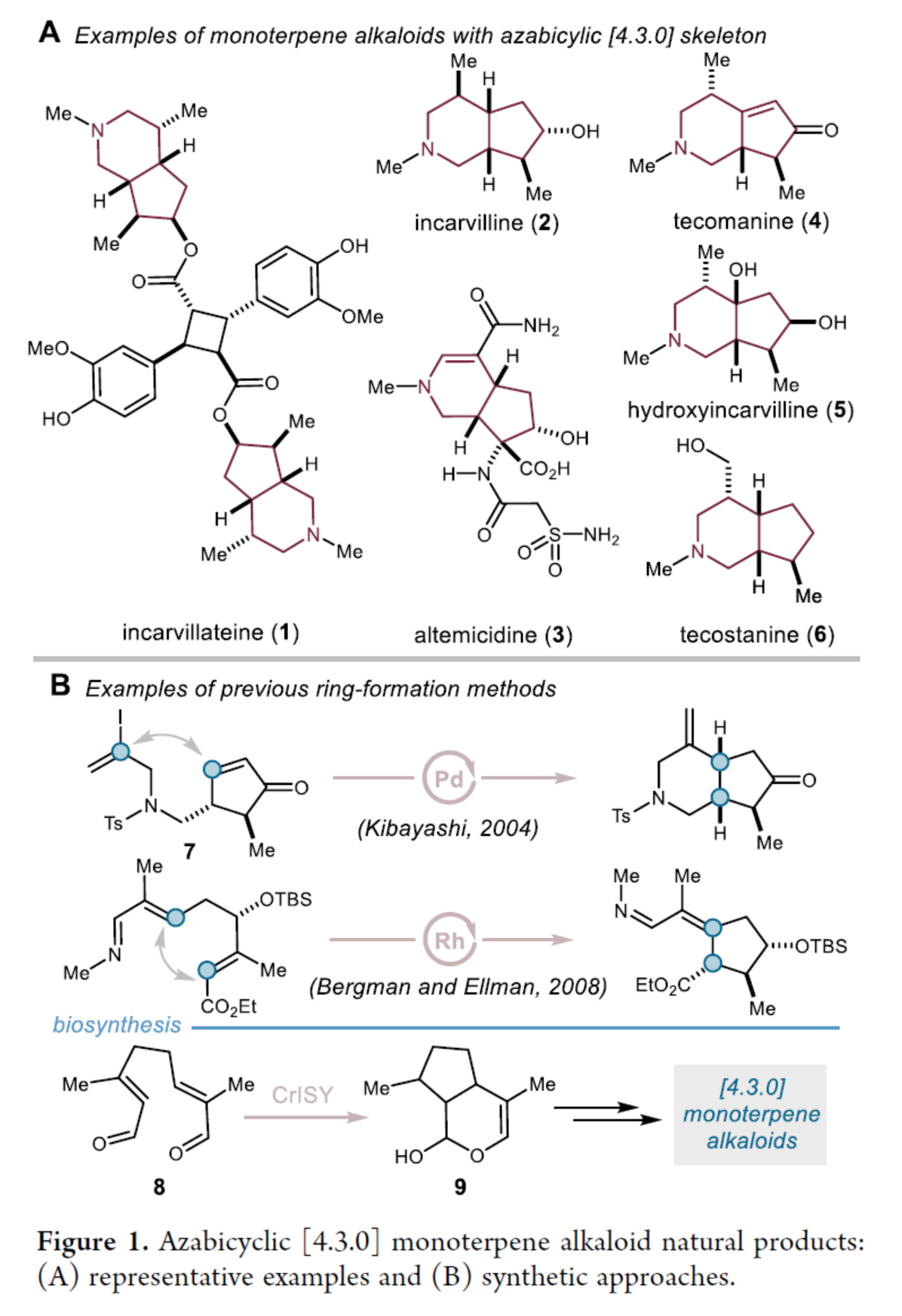
(图片来源:J. Am. Chem. Soc.)
Uyeda团队假设,利用不对称分子内[4+1]环加成反应,有望通过单步转化直接构建完整的[4.3.0]-氮杂双环骨架。对于含环己烷的稠合双环骨架,I型分子内Diels−Alder反应因其在逆合成分析中可同时切断中心键与外围键、生成无环前体的特性,是最简单的策略。而与之类似的分子内[4+1]-环加成反应,虽理论上可构建[n.3.0]型双环骨架,但此类方法在天然产物全合成中迄今未见报道。近日,美国普渡大学Christopher Uyeda团队报道了一种镍催化不对称分子内[4+1]-环加成反应,合成了一系列[4.3.0]-氮杂双环产物。该环加成产物可作为通用前体,通过对其空间差异化的三取代与四取代烯烃进行区域与立体选择性官能团化,进而制备六种单萜生物碱(Figure 2A)。
(−)-Incarvillateine(1)的形式全合成(Figure 2B)。酰胺衍生物(12)和醇衍生物(13)在DIAD/PPh3条件下进行Mitsunobu反应,可制备所需的环加成前体(10),收率为85%。通过对配体的筛选后发现,环加成前体(10)在indPyBox/Ni(dme)Cl2条件下,可顺利进行不对称分子内[4+1]-环加成反应,可以52%的收率得到氮杂双环中间体(11),ee为91%。值得注意的是,单镍催化剂在分子间[4+1]-环加成反应中完全无效。中间体(11)与1,1,2-三甲基丙基硼烷在NaBO3条件下进行硼氢化-氧化反应,可以78%的收率得到醇中间体(14),几乎具有完全的区域和非对映选择性。中间体(14)经进一步的Ts基团脱保护与还原胺化反应,可以两步58%的总收率得到中间体(15)。中间体(15)在Pt/C/H2条件下进行氢化反应,可以65%的收率得到(+)-7-epi-Incarvilline(16),dr > 20:1。(+)-7-epi-Incarvilline(16)作为合成(−)-Incarvillateine(1)的前体。
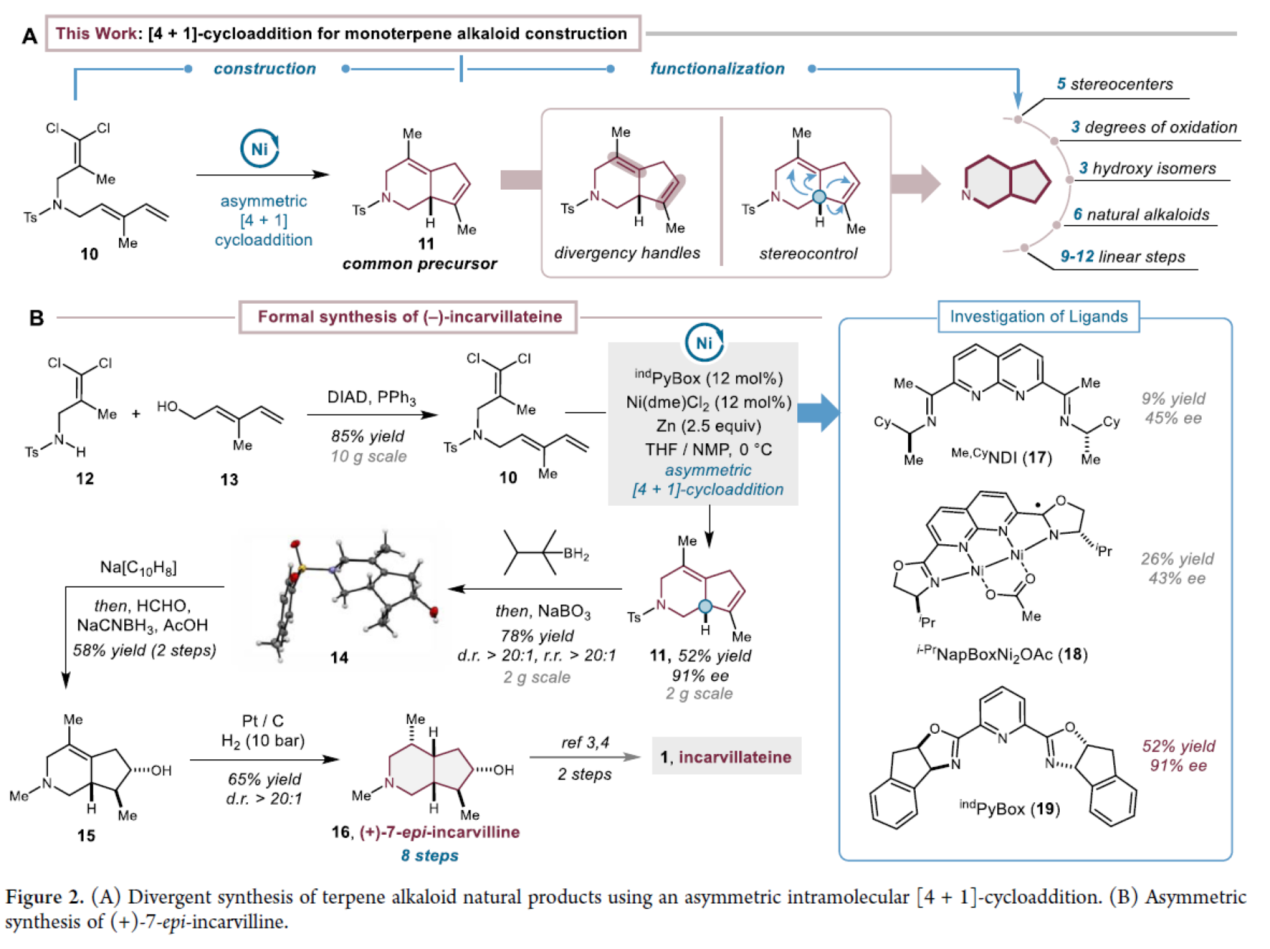
(图片来源:J. Am. Chem. Soc.)
关键[4+1]环加成步骤的DFT模型研究表明,假定的镍亚乙烯基中间体与1,3-二烯烃加成时可能存在两种可行的路径,即协同[4+2]环加成或分步[2+2]环加成与随后的1,3-迁移(Figure 3A)。在[4+2]环加成路径中,生成S-对映体产物的过渡态更为有利,而导致次要R-对映异构体的相应过渡态则不受青睐。对于[2+2]环加成路径,pro-S过渡态能障更低,pro-R过渡态同样不受青睐。因此,DFT计算支持[2+2]-环加成机理。其次,1,3-二烯的Z-和E-立体异构体,均可汇聚为相同对映异构体的环加合物(S)-11(Figure 3B)。同时,10-Z未能异构化为10-E。此外,使用10-E和10-Z的1:1混合物进行反应时,观察到两种非对映异构体以几乎相同的速率反应(Figure 3C)。最后,作者提出了一种合理[4+1]-环加成的反应机理(Figure 3D)。通过一系列的C−Cl氧化加成和Zn还原步骤,生成亚乙烯基镍配合物(20-iii)。配合物(20-iii)与1,3-二烯烃近端双键发生的[2+2]环加成反应,生成四元金属环中间体(20-v)。在优势过渡态中,亚乙烯基单元与1,3-二烯烃上的甲基取代基能够进入配体茚基未占据的空间象限。20-v经1,3-异构化生成20-vii的过程具有热力学优势,随后通过C−C还原消除,从而获得最终的环加成产物。
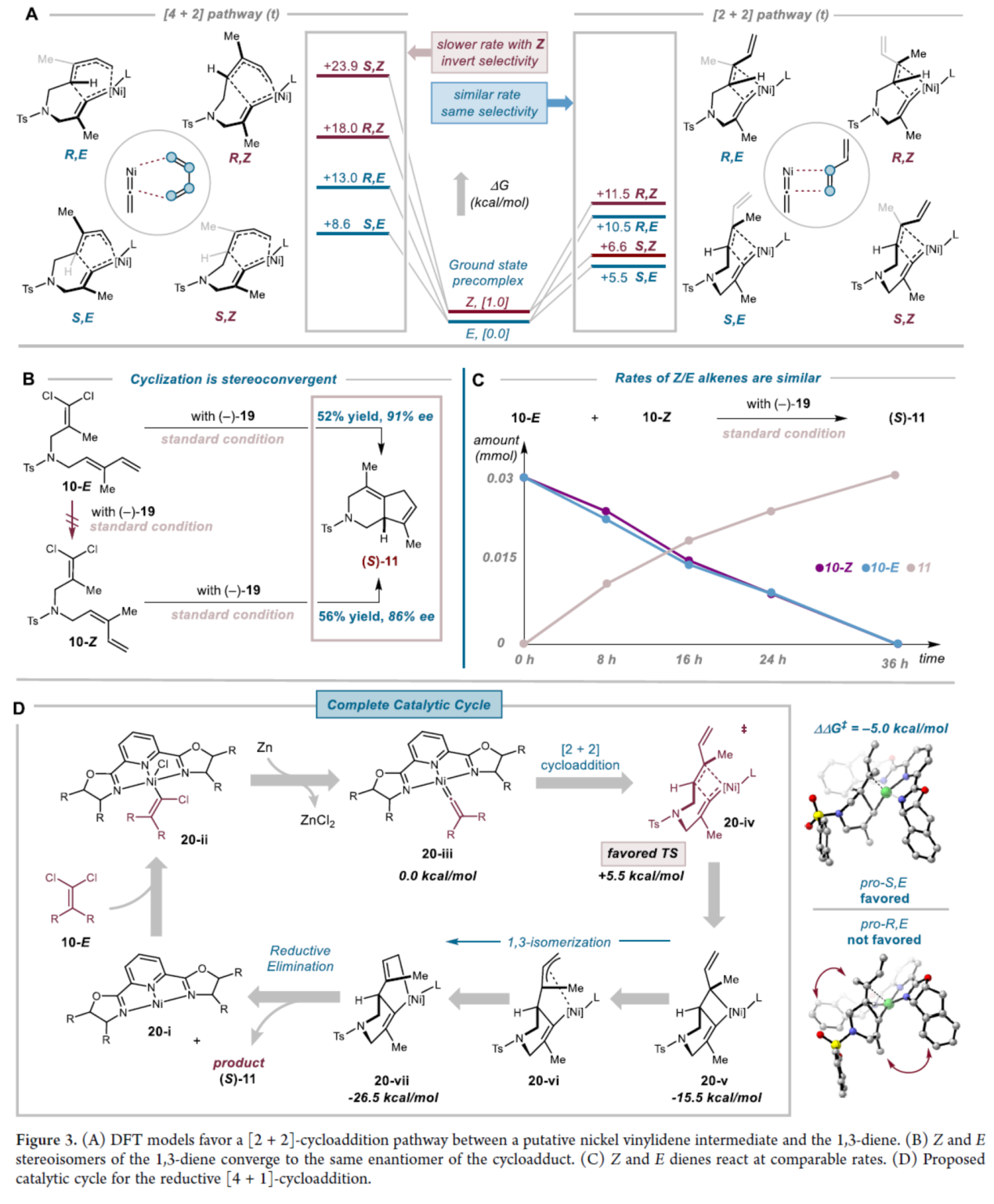
(图片来源:J. Am. Chem. Soc.)
(−)-Hydroxyincarvilline(5)的合成(Figure 4A)。氮杂双环中间体(11)与1,1,2-三甲基丙基硼烷在NaBO3条件下进行硼氢化-氧化反应,可以78%的收率得到醇中间体(14),几乎具有完全的区域和非对映选择性。醇中间体(14)在DIAD/PPh3条件下进行Mitsunobu反应,可以96%的收率得到乙酸酯中间体(21)。中间体(21)通过氧气进行氧化,并使用NaBH4原位还原过氧化物中间体,可以44%的收率得到烯丙醇中间体(22)。通过对氢化条件的筛选后发现,中间体(22)在Pt−Ni/SiO2/H2条件进行氢化反应,可以80%的收率得到中间体(23),dr为7:1。中间体(23)经脱保护与N-甲基化反应后,可以两步60%的总收率得到(−)-Hydroxyincarvilline(5)。
(−)-Isoincarvilline(27)和(−)-Incarvilline(2)的全合成(Figure 4A)。四取代烯烃(21)很容易进行催化氢化反应,在Pd(OH)2/C/H2条件下可生成非对映异构体25和26(比例为2:1),而在Pt/C条件下可进行非对映选择性翻转生成非对映异构体25和26(比例为1:3)(Figure 4B)。同时,四取代烯烃(21)在反应性较低的Pd/C条件下反应,可生成单一非对映异构体的烯胺中间体(24),以及中间体25和26。并且,中间体(24)在Pd(OH)2/C/H2或Pt/C条件下均可进行氢化反应,生成氢化混合物25和26。四取代烯烃(21)的氘代实验结果表明,异构化是不可逆的。中间体(25)经脱保护与N-甲基化反应后,可以两步64%的总收率得到(−)-Isoincarvilline(27)。中间体(25)经脱保护与N-甲基化反应后,可以两步67%的总收率得到(−)-Incarvilline(2)。
(−)-Tecomanine(4)的全合成(Figure 4A)。醇中间体(14)在DMP条件下进行氧化,可以78%的收率得到酮中间体(28)。酮中间体(28)在酸性条件下进行异构化,可以72%的收率得到共轭烯酮中间体(29),dr为7:1。中间体(29)经进一步的还原、脱保护、N-甲基化与氧化反应,可以三步47%的总收率得到(−)-Tecomanine(4)。
(−)-5-Hydroxyskytanthine(33)与(+)-Tecostanine(6)的全合成(Figure 4A)。氮杂双环中间体(11)与1,1,2-三甲基丙基硼烷经硼氢化以及自由基脱硼化反应,可以58%的收率得到中间体(31),几乎具有完全的区域和非对映选择性。中间体(31)通过氧气进行氧化,并使用NaBH4原位还原过氧化物中间体,可以42%的收率得到烯丙醇中间体(32)。中间体(32)在Pt−Ni/SiO2条件下进行氢化,可以89%的收率得到非对映异构体中间体(dr为3:1),其经进一步的脱保护与N-甲基化反应后,可以两步61%的总收率得到(−)-5-Hydroxyskytanthine(33)。或者,中间体(32)在ReO3OSiPh3条件下进行烯丙基转位反应,可以80%的收率得到热力学上更有利的四取代烯烃中间体(34)。中间体(34)在Pt−Ni/SiO2条件下进行氢化,可以60%的收率得到非对映异构体中间体(dr > 20:1),其经进一步的脱保护与N-甲基化反应后,可以两步56%的总收率得到(+)-Tecostanine(6)。
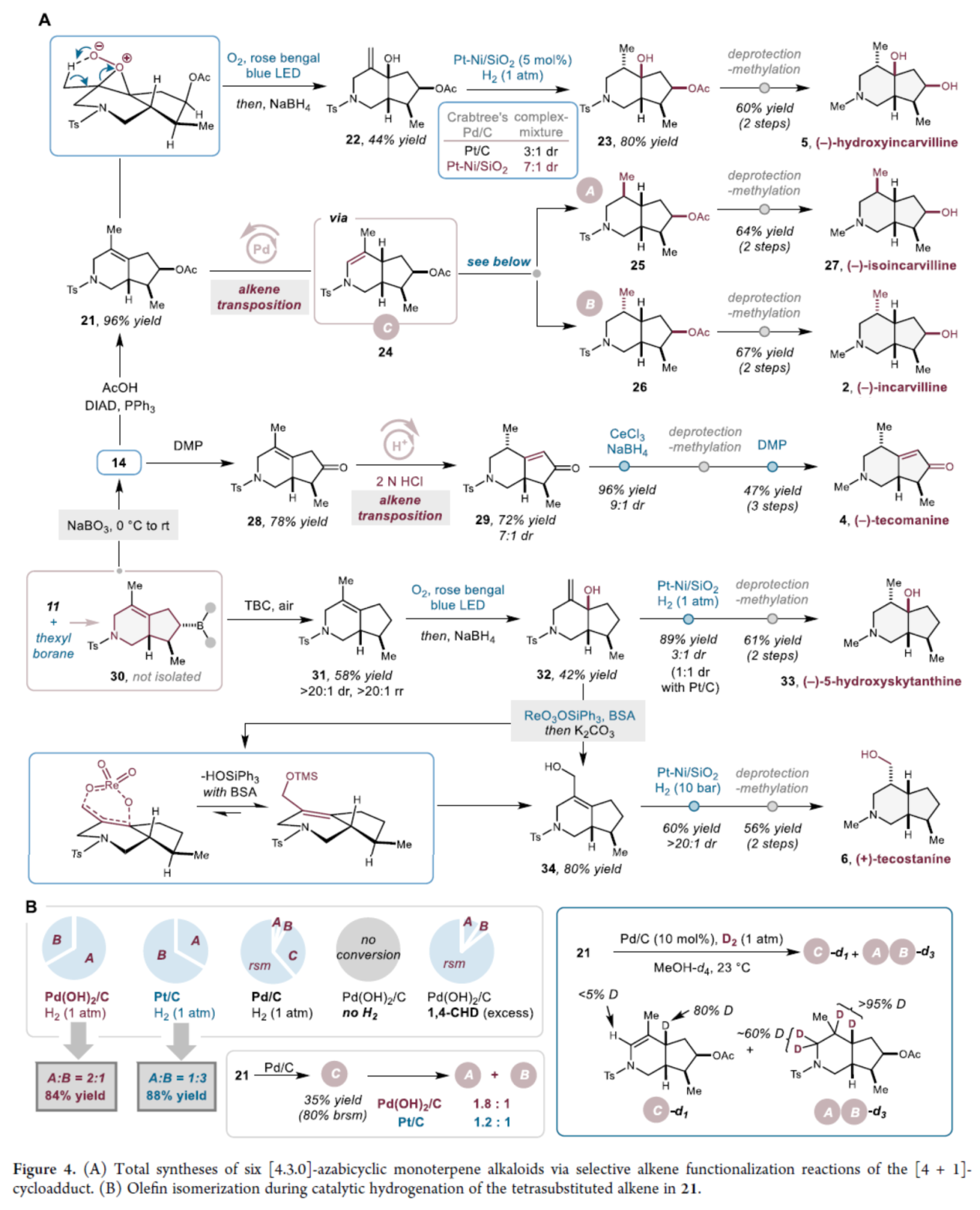
(图片来源:J. Am. Chem. Soc.)
总结
Christopher Uyeda团队报道了一种镍催化亚乙烯基和1,3-二烯的不对称分子内[4+1]-环加成反应,合成了一系列[4.3.0]-氮杂双环产物,反应成功的关键在于筛选出耐受目标分子中甲基化模式的单镍催化剂,其可精准调控环加成过程中的立体化学选择性。所得环加成产物含有两个空间差异性显著的烯烃位点,通过区域选择性和非对映选择性官能团化,可以发散性方式高效制备该天然产物家族的六种成员。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn