

正文
环丙烷独特的结构特征和反应活性长期以来一直是有机化学领域的研究重点。这种具有高度环张力的三元碳环结构能够与亲核试剂、亲电试剂以及自由基化合物发生多种反应。此外,环丙烷的构象刚性特征及其取代基在空间排列上的高度定向性,使其成为药物化学研究中至关重要的药效团结构单元。在有机合成中,烯烃的环丙烷化反应是构建环丙烷骨架最常用的方法之一。而传统的烯烃直接环丙烷化方法无法修饰烯烃α-碳或β-碳上的官能团。近年来,通过开环反应实现环烷烃衍生物解构的方法已成为有机合成中极具吸引力的骨架跃迁策略。基于以上骨架跃迁策略,作者提出了一种通过"闭环-开环-闭环"策略实现的解构性环丙烷化反应,该反应能够实现官能团从一个碳骨架向烯烃α-或β-碳的迁移,从而达成环丙烷化合物的区域选择性合成。具体过程如下:(1)烯烃首先通过[2+2]环加成反应形成高张力环丁烷中间体,该张力为后续反应提供驱动力;(2)环张力促使环丁烷发生开环,在此过程中键的重排引发官能团迁移,并通过区域选择性调控决定官能团迁移方向;(3)开环中间体经由水介导的质子穿梭过程进行亲核取代,重新形成环状结构,最终将官能团高区域选择性地定位至烯烃的α或β位。值得注意的是,水分子在该过程中作为质子转移试剂,实现了对解构中间体的质子迁移(图1)。
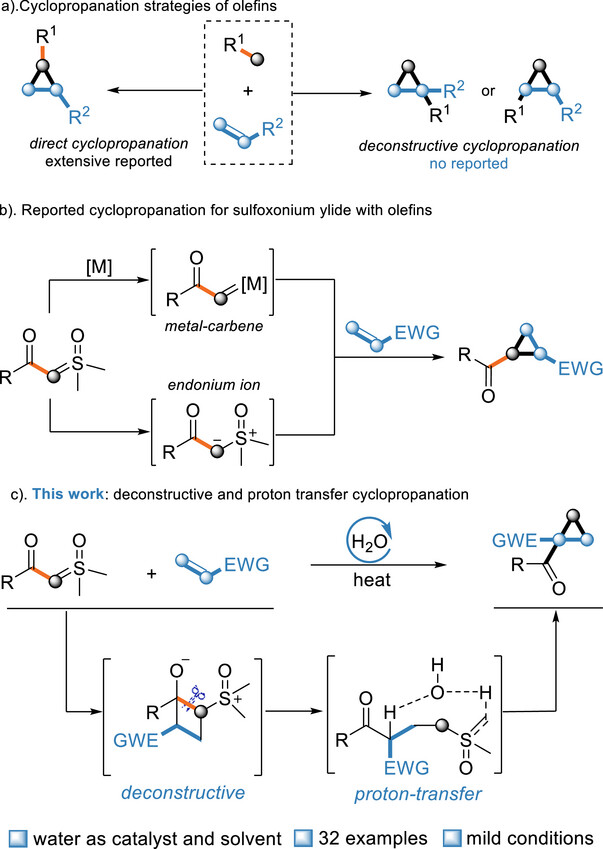
图1. 烯烃的环丙烷化策略。
作者最初尝试在DMSO溶剂中使用H2O,通过亚砜叶立德1a和烯烃2a实现了解构性质子转移环丙烷化反应。当反应在100℃下进行12小时后,成功获得了预期的1,1-二取代环丙基酮3a,产率为50%。基于这些结果,作者进一步优化了反应条件。增加水的用量显著提高了产物产率。当使用DMSO/H2O(1:1)作为溶剂时,产物的产率达到78%。溶剂筛选实验表明,DMSO/H2O(1:1)是最佳溶剂体系;相比之下,单独使用H2O(0.5 mL)作为溶剂仍可获得75%的产率。DMSO不仅能提高反应溶剂的沸点,还能确保反应体系的均相条件。值得注意的是,在没有H2O存在的情况下无法获得产物3a。通过条件优化,确定最佳反应温度为100℃。将亚砜叶立德的用量增加至1.2当量并未提高产物的产率。当用CH3COOH或CH3CH2OH替代H2O时,目标产物的产率有所降低(Table 1)。
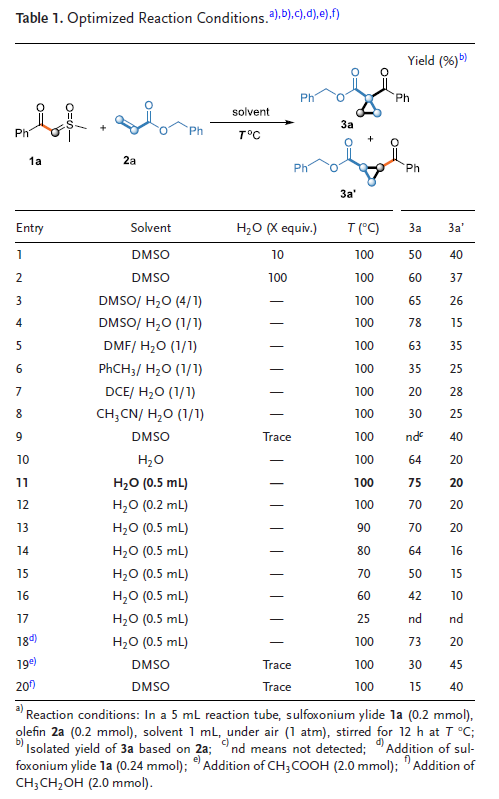
在优化反应条件下,作者系统考察了亚砜叶立德与缺电子烯烃的适用范围。首先测试了一系列烯烃底物,发现该反应对不同取代的丙烯酸酯均表现出良好的兼容性,相应环丙烷产物的产率较高。通过研究取代基的电子效应发现不同碳链长度的烷基取代基均能顺利反应并获得良好产率,但含吸电子基团取代的苯环取代基的产率更高。值得关注的是,N,N-二甲基丙烯酰胺和3-氧代-3-苯基丙烯作为底物时也表现出良好的反应性。进一步研究发现,该反应对非羰基取代的缺电子烯烃同样适用:丙烯腈和苯基乙烯砜作为底物时,均能以可接受产率获得目标产物。含额外烯烃基团和额外羰基的底物仍能得到目标产物。含活泼亚甲基的烯烃能选择性地生成目标产物,且亚甲基未发生转化。此外,含DL-薄荷醇和胆固醇结构的烯烃也能以中等产率顺利得到目标产物(Table 2)。

接下来,作者考察了多种亚砜叶立德的适用范围。研究发现,不同位置单取代的亚砜叶立德在最优条件下均能顺利反应。无论是给电子基团还是吸电子基团取代的亚砜叶立德都具有良好的反应性,能以中等至良好的产率转化为目标环丙烷产物。值得注意的是,与给电子基团相比,吸电子基团取代的亚砜叶立德表现出更高的反应产率。特别是硝基和氰基取代的亚砜叶立德同样能以良好产率获得环丙烷产物。呋喃、噻吩和萘取代的亚砜叶立德均表现出良好的兼容性。然而,烷基亚砜叶立德的反应效果相对欠佳,仅以59%的产率得到相应产物(Table 3)。
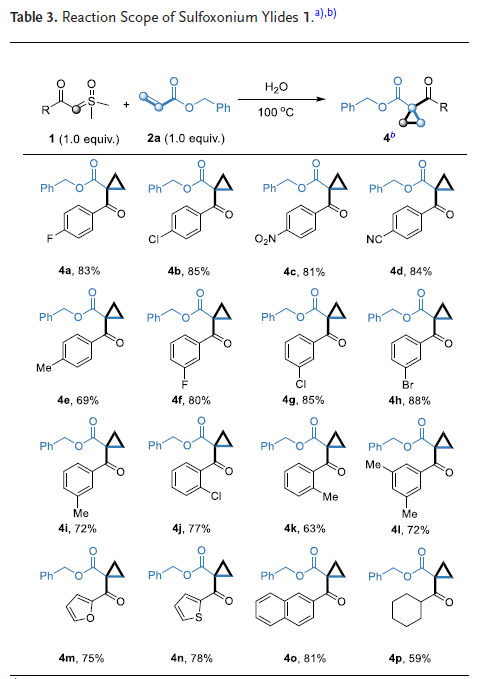
为探究反应机理,作者进行了一系列控制实验。首先进行了同位素标记实验。亚砜叶立德1a在D2O中的核磁氢谱显示,羰基α位C-H键发生了完全的D/H交换,证实了水相亚砜叶立德的可逆水合过程。在D2O/H2O(1:1)体系中观测到1:2的D/H比例,表明反应存在一级动力学同位素效应。当改用D2O作为反应溶剂时,得到氘代产物和氘代副产物。竞争性动力学同位素效应实验表明,水分子加成中间体时表现出正常的二级动力学同位素效应,并伴随不可逆的sp3至sp2的杂化转变。平行同位素实验证实,水加成步骤并非催化循环的决速步。将模版反应分别在H2O和D2O中反应1小时后,混合物的核磁氢谱显示亚砜叶立德的CH3基团发生显著D/H交换。反应过程监测发现主产物3a的生成先于副产物3a',表明动力学上更倾向于形成主产物。值得注意的是,当用其他亚砜叶立德替代时反应不能进行。同时,α位带有取代基的亚砜叶立德和非末端烯烃均无法获得目标产物(图2)。

图2. 机理研究。
基于上述实验结果,作者提出了一种水分子催化的亚砜叶立德与烯烃发生解构性质子转移环丙烷化反应的可能机理。亚砜叶立德1a与苯丙烯酸酯2a 的Michael加成反应生成中间体I。该中间体随后对苯甲酰羰基进行分子内亲核进攻,形成两性离子环丁烷中间体II。随后,中间体II在醇盐作用下发生环丁烷开环,形成中间体III。反应过程通过水介导的1,3-质子转移实现中间体III向中间体IV的转变,随后经历第二次质子转移生成中间体V。最终通过分子内环化形成环丙基酮3a并释放DMSO。水分子介导的质子转移促进了两个羰基间碳负离子中间体的形成,这一关键步骤驱使反应选择性地进行环丙烷环合,而非通过羰基反应性形成二氢呋喃衍生物。高分辨质谱成功捕获了不同的氘代中间体(图3)。
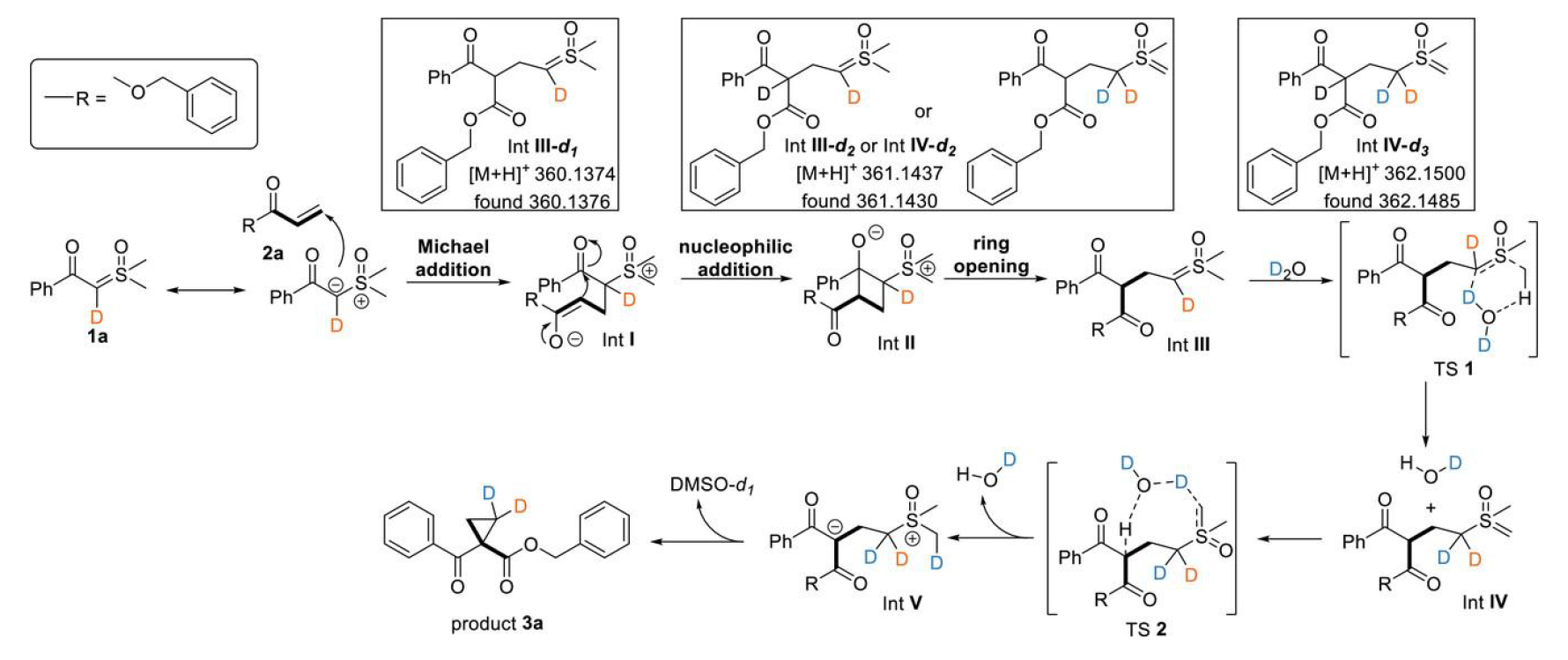
图3. 反应机理。
机理计算研究
为深入验证所提出的反应机理,作者进行了DFT计算。计算结果表明:水分子辅助形成环丁烷中间体的过程在能量上比直接生成环丙烷产物更为有利。该反应以通过过渡态TS1的Michael加成作为决速步(活化能垒为20.8 kcal mol−1),随后经历13.9 kcal mol−1的低能垒,完成苯甲酰羰基的分子内亲核加成,形成四元环中间体int3。值得注意的是,竞争路径中通过传统三元环过渡态TS2R生成副产物的能垒更高(16.8 kcal mol−1)。理论计算证实,环丁烷路径的优势源于过渡态中更强的氢键相互作用——水分子与羰基氧的键距缩短至1.7 Å。特别重要的是,无水条件下环丁烷路径的活化能(10.0 kcal mol−1)反而高于环丙烷路径(8.4 kcal mol−1),导致选择性反转与传统反应结果一致。这些发现充分证明:氢键相互作用是调控该反应选择性的关键因素(图4)。
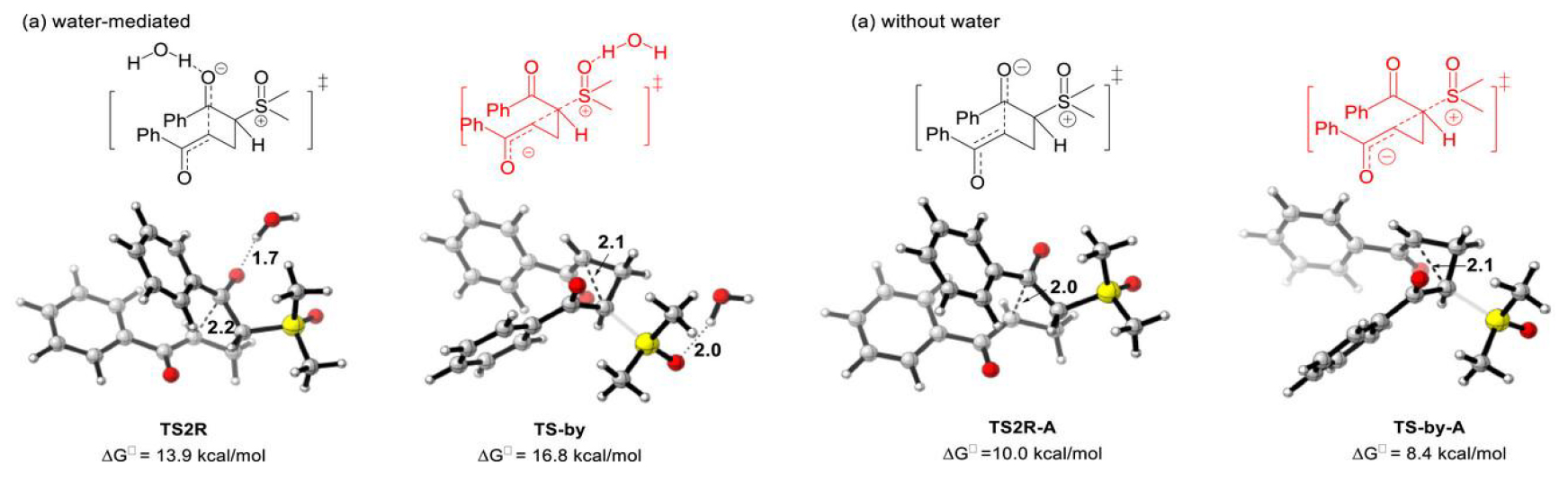
图4.含水(TS2R和TS-by)和不含水(TS2R-A和TS-by-A)的过渡态对比。
为进一步验证该方法的合成应用价值,作者实现了1-苯甲酰基环丙烷-1-甲腈的克级连续流动合成。为充分展示产物的衍生化潜力,作者以了1-苯甲酰基环丙烷-1-甲腈为底物开展了系列转化实验:(1)通过有机催化Cloke-Wilson重排反应转化为2,3-二氢呋喃衍生物;(2)采用NaBH4选择性还原获得β-羟基腈;(3)醇解反应得到酯类环丙基酮;(4)水解反应制备羧酸。所有转化均顺利进行,充分证明了本方法产物的合成应用价值(图5)。
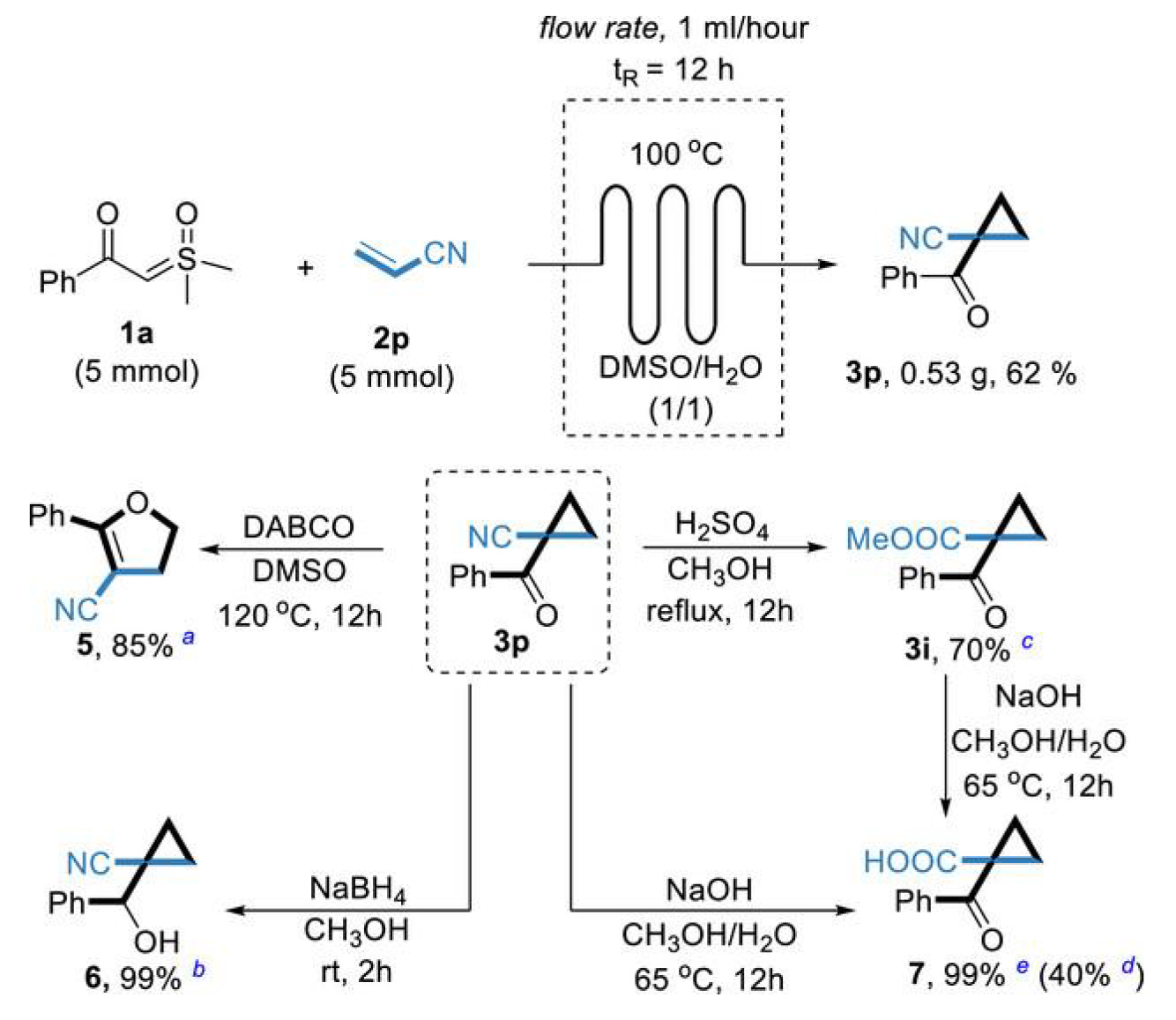
图5. 克级连续流动合成与官能团化研究。
总结
在这项工作中,作者成功开发了一种水催化亚砜叶立德与烯烃的解构性质子转移环丙烷化反应。该反应以亚砜叶立德和烯烃为起始原料,在温和条件下高效构建1,1-二取代环丙基酮类化合物。通过控制实验和DFT计算研究,成功阐明了水分子参与质子转移的反应机理。值得注意的是,该方法可适用于连续流动合成,为工业化应用提供了重要途径。
这一研究成果发表在Advanced Science,云南大学药学院的于祥林博士为该论文的第一作者,云南大学药学院的金毅研究员和哈尔滨工业大学(深圳校区)理学院的宋丽娟教授为共同通讯作者。该工作得到了国家自然科学基金,云南省自然科学基础项目基金,广东省自然科学基金等基金的支持。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn