

(图片来源:J. Am. Chem. Soc.)
正文
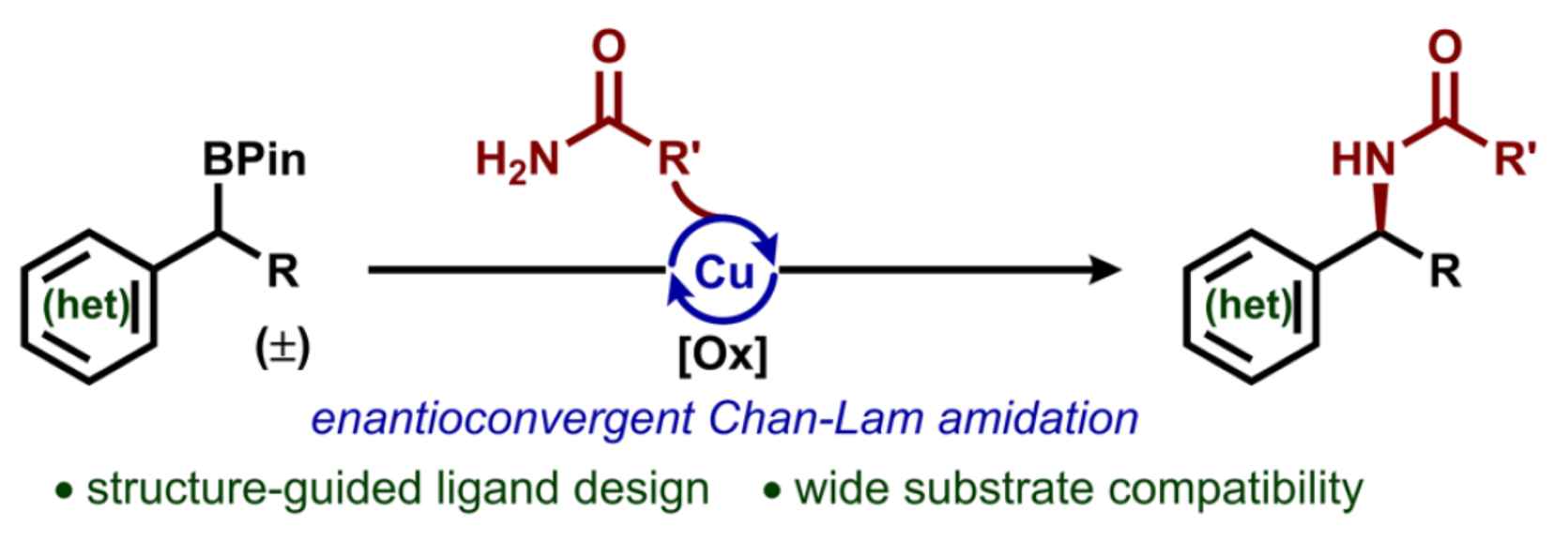
有机硼试剂的氧化Chan−Lam胺化反应是一种合成药物活性成分的高效交叉偶联策略。尽管Chan−Lam偶联反应在芳胺合成中应用广泛,但其在对映选择性构建C(sp3)−N键领域的应用仍存在局限。这一挑战源于通常依赖于使用超化学计量量的铜试剂,且缺乏适用于烷基硼试剂参与的普适性机理框架。然而,这一转化反应通过结合Chan−Lam偶联的普适性与烷基硼试剂的合成多功能性,能够实现强大的逆合成断键策略,从而构建复杂烷基骨架(Figure 1A)。作者认为,烷基硼酸频哪醇酯和酰胺之间的脱硼交叉偶联反应将为获得手性苄基酰胺提供一种有利的策略,其是一类特殊的药物亚结构(Figure 1B)。该策略不仅为传统依赖手性助剂或拆分工艺的多步合成法提供了简化且模块化的替代路径,同时可作为新兴催化策略(如近期C−H键官能团化策略)的正交互补方案(Figure 1C)。作者设想,通过解决两大关键机理挑战可达成该转化:(1)烷基频哪醇硼酸酯中C−B键的均裂;(2)经由铜(II)酰胺中间体实现烷基自由基的对映选择性官能团化(Figure 1D)。具体反应过程如下:通过自由基接力路径(step a)形成的高活性有机自由基,可应用于类似反应过程(step b)。所产生的前手性烷基自由基将与原位生成的Cu(II)酰胺中间体反应,进而生成光学活性产物(step c-d)。在此,美国科罗拉多州大学Robert S. Paton与Yuyang Dong团队首次报道了一种通过配体设计促进的对映汇聚性Chan−LamC(sp3)−N偶联反应,涉及自由基介导的脱硼官能团化的过程(Figure 1D)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:J. Am. Chem. Soc.)
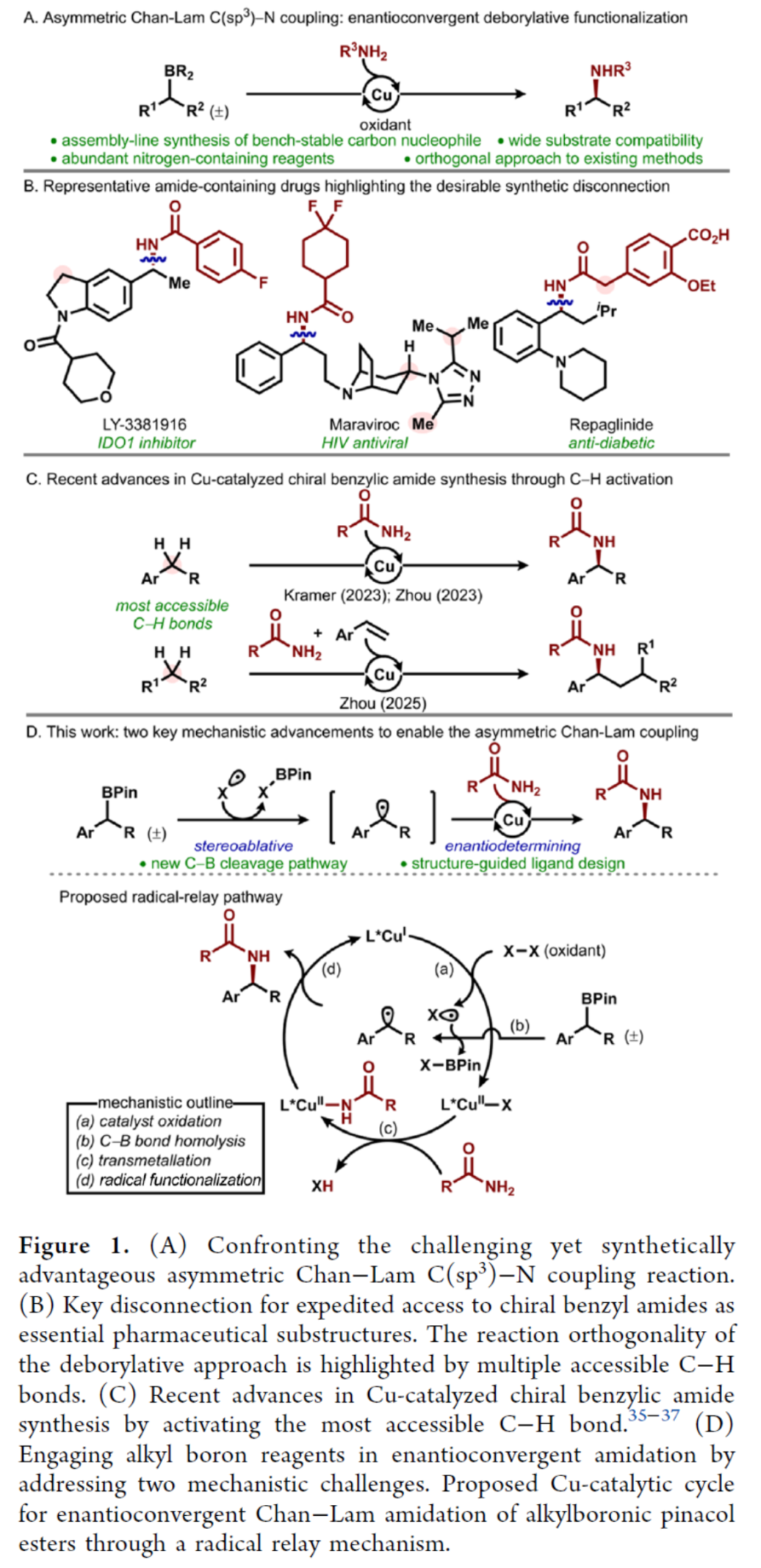
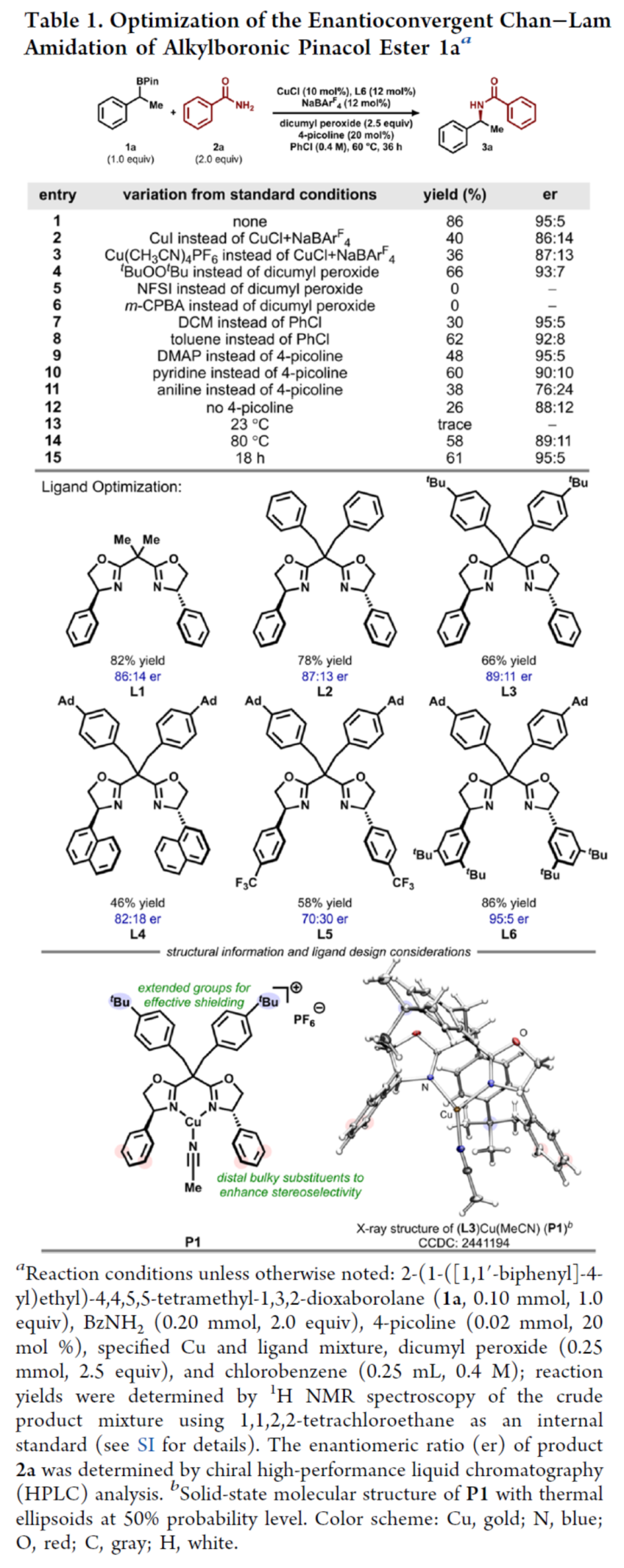
首先,作者以烷基硼酸频哪醇酯1a与苯甲酰胺2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以CuCl(10 mol %)作为催化剂,NaBArF4(12 mol %)作为添加剂,L6(12 mol %)作为配体,4-甲基吡啶(20 mol %)作为Lewis碱性添加剂,过氧化二异丙苯(2.5 equiv)作为氧化剂,在PhCl溶剂(0.4 M)中60 oC反应36 h,可以86%的收率得到产物3a,er为95:5。
(图片来源:J. Am. Chem. Soc.)
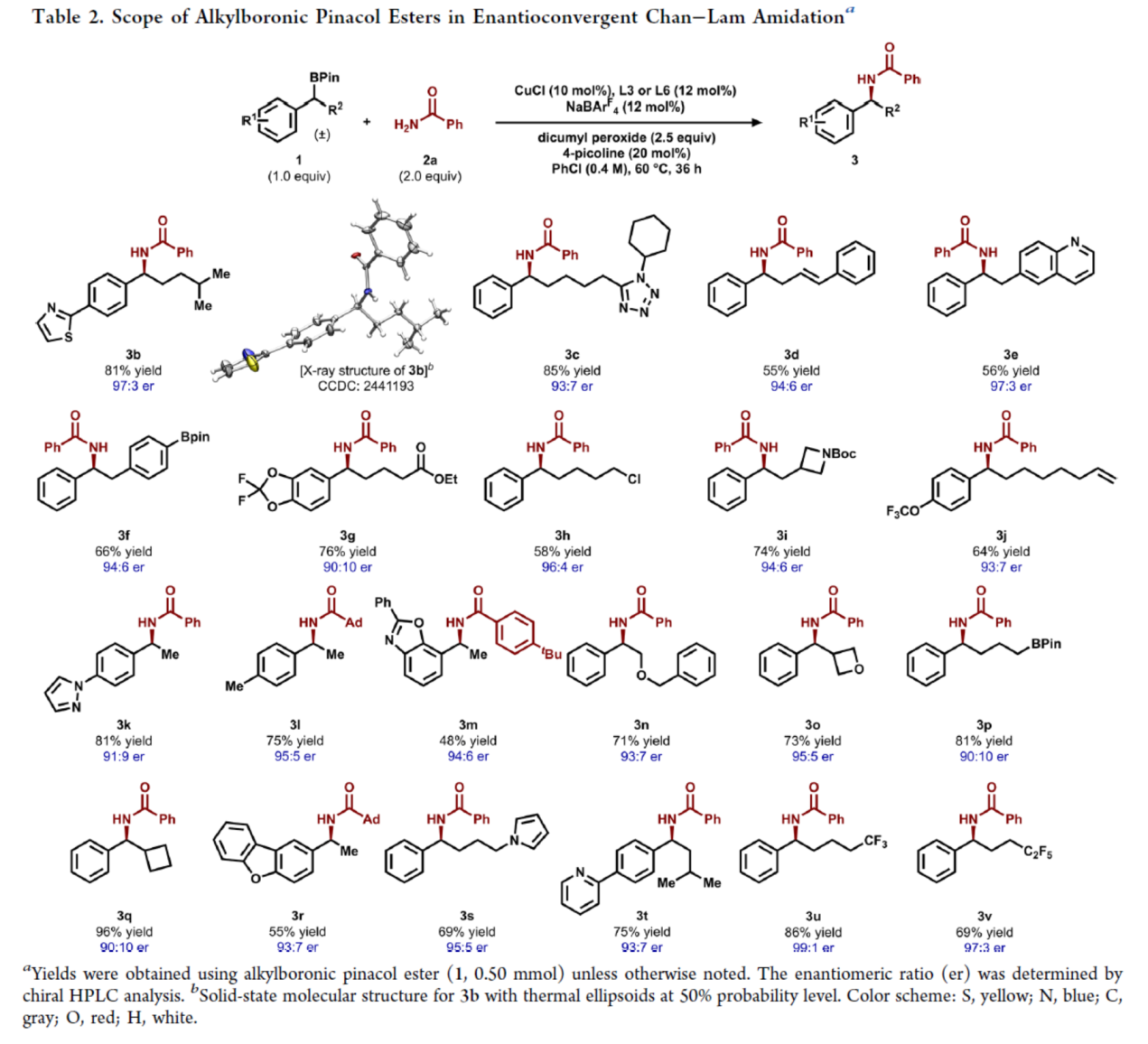
在获得上述最佳反应条件后,作者对烷基硼酸频哪醇酯的底物范围进行了扩展(Table 2)。研究结果表明,当烷基硼酸频哪醇酯底物1中含有不同电性取代的芳基、杂芳基或者含有各种烷基与环烷基取代时,均可顺利反应,获得相应的产物3b-3v,收率为48-96%,er为90:10-99:1。
(图片来源:J. Am. Chem. Soc.)
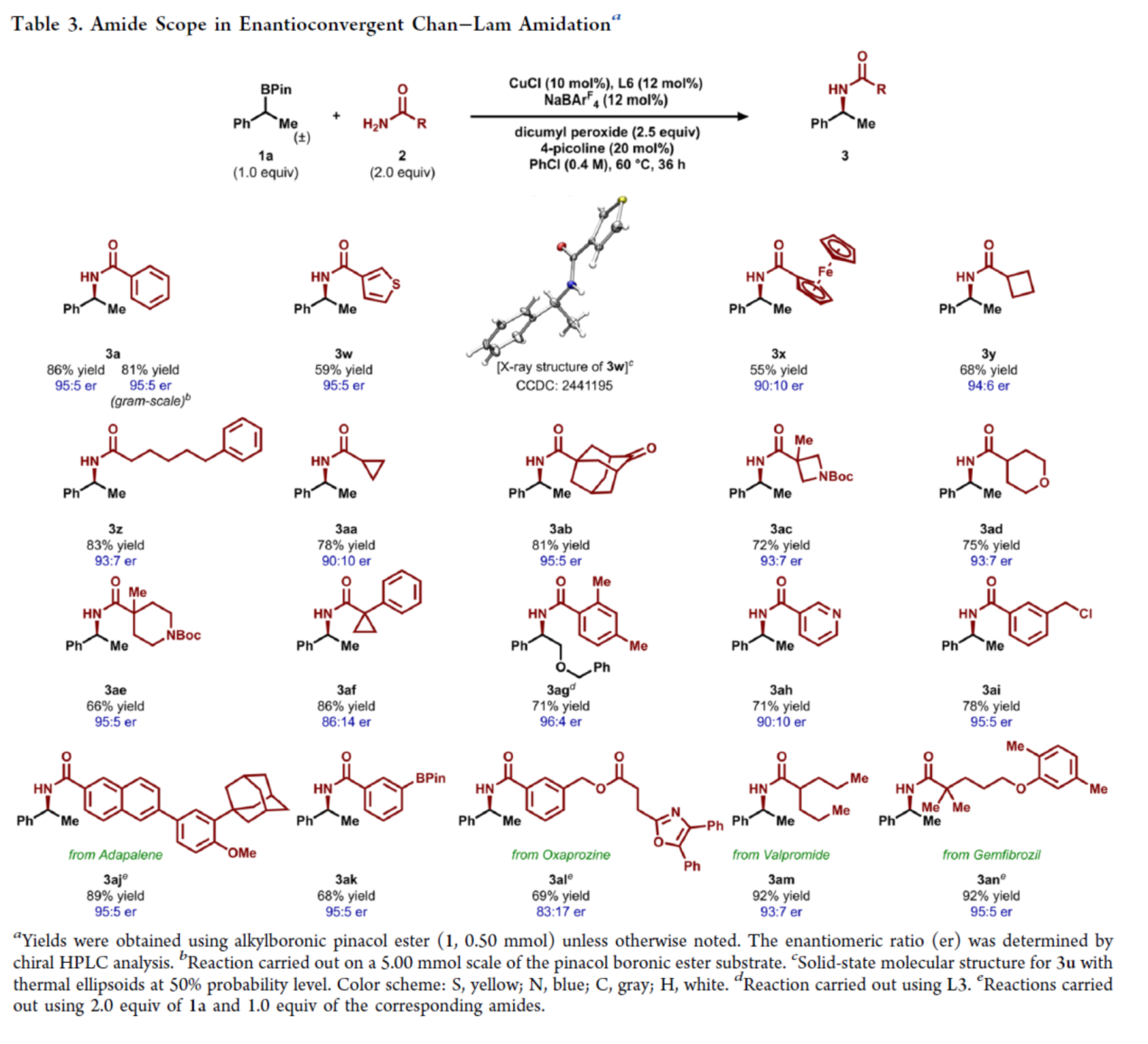
紧接着,作者酰胺的底物范围进行了扩展(Table 3)。研究结果表明,当酰胺底物2中含有不同取代的芳基、杂芳基、烷基与环烷基时,均可顺利反应,获得相应的产物3a、3w-3z、3ak和3aa-3ai,收率为55-86%,er为86:14-96:4。值得注意的是,该策略还可用于多种药物分子的后期衍生化,如维生素A衍生物阿达帕林(3aj)、非甾体抗炎药奥沙普秦(3al)、抗癫痫药丙戊酰胺(3am)以及降脂剂吉非罗齐(3an),收率为69-92%,er为83:17-95:5。
(图片来源:J. Am. Chem. Soc.)
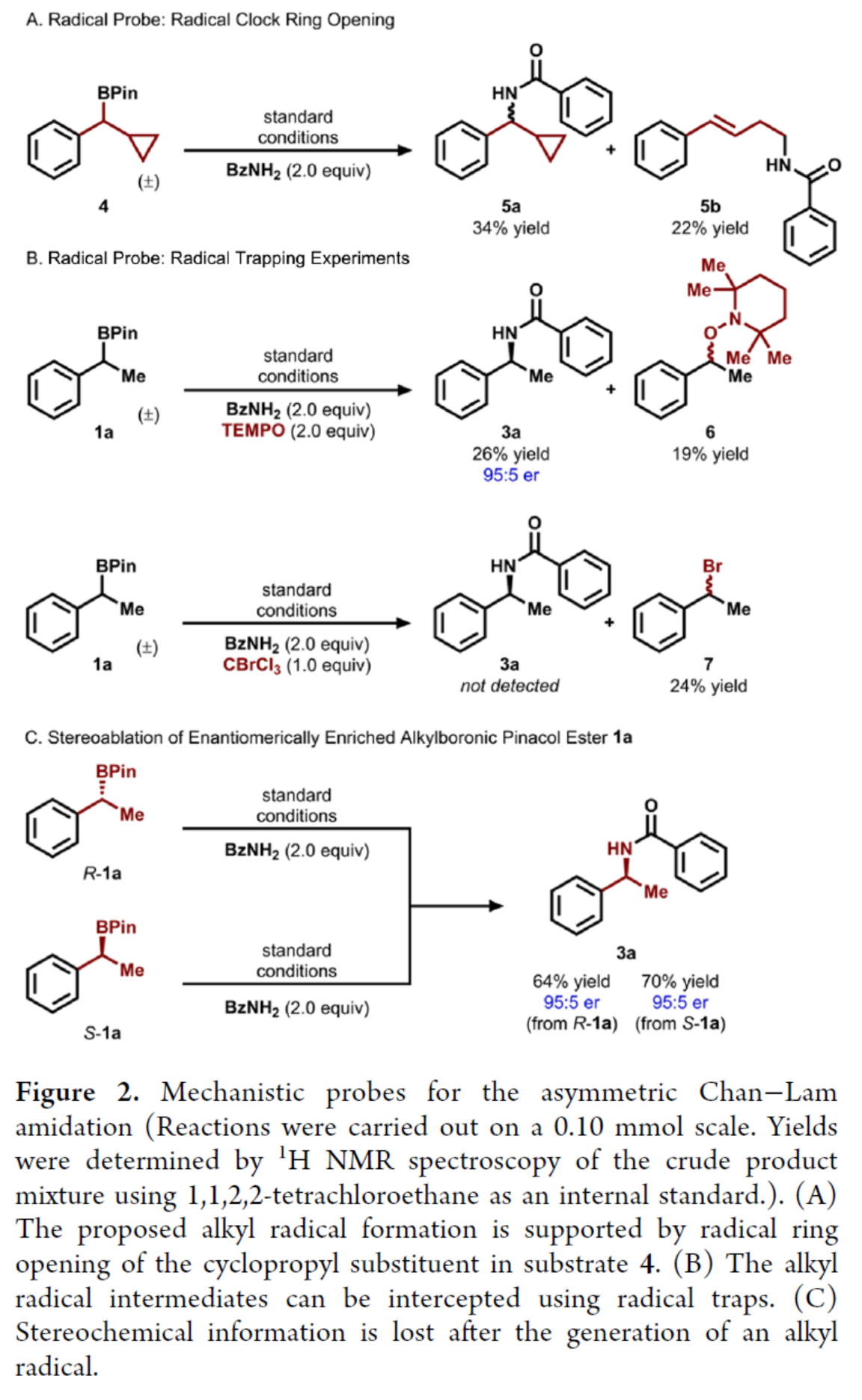
随后,作者对反应的机理进行了研究(Figure 2)。首先,自由基钟实验(Figure 2A)与自由基捕获实验(Figure 2B)结果表明,反应涉及烷基自由基的生成。其次,将对映体富集的(R)-1a和(S)-1a置于标准条件下,均生成具有相似对映体比例的产物3a,表明了在C-N键形成之前已发生立体化学信息损失(Figure 2C)。
(图片来源:J. Am. Chem. Soc.)
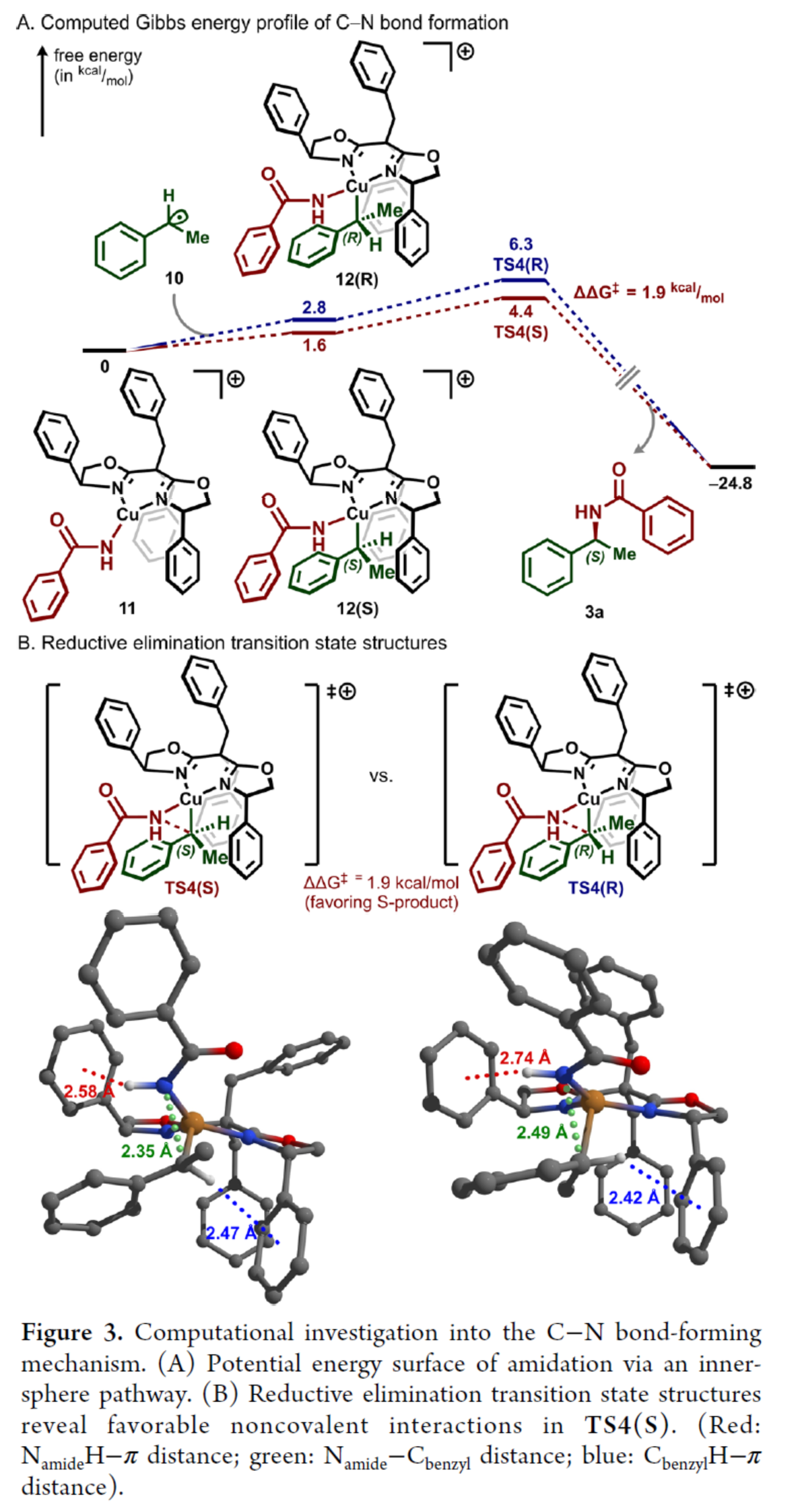
随后,作者通过相关的理论计算,探究了C-N键形成机理并阐明了其对映汇聚性的起源(Figure 3)。计算结果表明:二价铜中间体11的形成是放热过程,其反应路径为先经二异丙苯过氧化物氧化,再与苯甲酰胺2a发生金属转移反应(Figure 3A)。烷基自由基10和二价铜中间体11的结合具有轻微的吸电子性,形成形式的Cu(III)中间体12(R)和12(S)。随后,C-N键形成过程通过还原消除过渡态结构TS4(R)和TS4(S)进行,且苄位构型保持。其中,计算结果表明,反应有利于S-对映异构体的形成(Figure 3B)。同时,S-对映体的优势源于TS4(S)中更强的NamideH−π相互作用。
(图片来源:J. Am. Chem. Soc.)
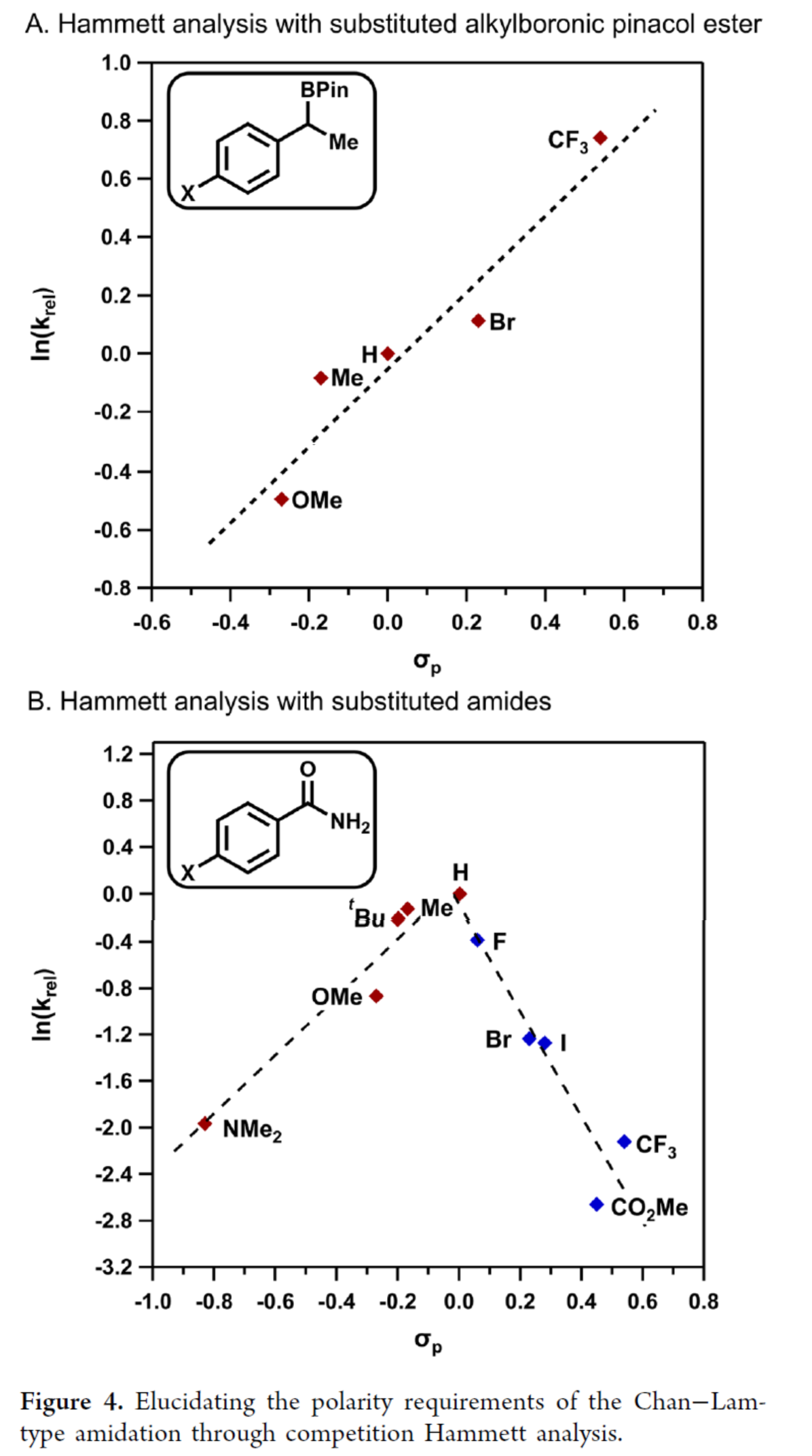
最后,作者通过竞争性Hammett分析阐明Chan-Lam型酰胺化的电子效应需求(Figure 4)。通过分析取代烷基硼酸频哪醇酯的Hammett参数与反应速率的相关性,揭示出正斜率趋势(Figure 4A)。该现象可归因于:(1)C-B键断裂前,枯氧自由基8与亲电性更强的苄基硼酸酯之间存在有利结合;(2)亲电性更强的苄基自由基提升了C-N偶联效率。相应地,缺电子酰胺的反应速率低于苯甲酰胺(Figure 4B),这很可能源于极性失配导致。然而,作者也观察到富电子酰胺反应速率减缓,导致Hammett相关曲线斜率发生变化。向下凹陷的Hammett图表明限速步骤发生转变。作者认为,富电子酰胺的较低酸性导致转金属化过程变慢。基于上述机理框架,作者正在进行不对称Chan-Lam型交叉偶联实验方案的开发,以适应广泛的亲核试剂。
(图片来源:J. Am. Chem. Soc.)
总结
美国科罗拉多州大学Robert S. Paton与Yuyang Dong团队开发了首个不对称Chan−LamC(sp3)−N偶联反应。该策略对各类官能团及杂环结构均具有良好兼容性,可在克级规模上以高度的对映选择性获得相应的酰胺化产物。实验与理论计算研究共同支持其经由内球层C-N偶联机理的自由基接力反应路径,其中立体选择性源于配体-底物间的非共价相互作用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn