

正文
石房蛤毒素(1,图 1a)是1957年从阿拉斯加黄油蛤(Saxidomas giganteus)中分离得到的第一个纯麻痹性贝类毒素。石房蛤毒素及其类似物(如图1a中的4-13)可根据结构分为几类,每种毒素的毒性水平各不相同。STX可逆性地与电压门控钠通道(Nav) α亚基的1号位点结合,直接阻塞Nav孔道,阻止钠离子流入可兴奋细胞(包括神经元),从而阻断动作电位(AP)的产生和传递。在过去的五十年中,出现了许多精妙的STX及其相关天然产物的全合成方法。逆合成方面,这些合成主要依赖于极性键的断裂,最终总产率为0.01%-4.22%。这些路径本质上都是线性的,因此在快速类似物制备方面效率低下,模块化程度也较低。在此,Marisa Roberto和Phil S. Baran团队报道了一种完全不同的 STX 合成方法,该方法通过应用自由基逆合成断开、C–H 官能化逻辑和生物催化,最大限度地增加骨架键形成事件和收敛性,从而实现了迄今为止 STX 及其相关家族成员的最高效合成(图1a)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
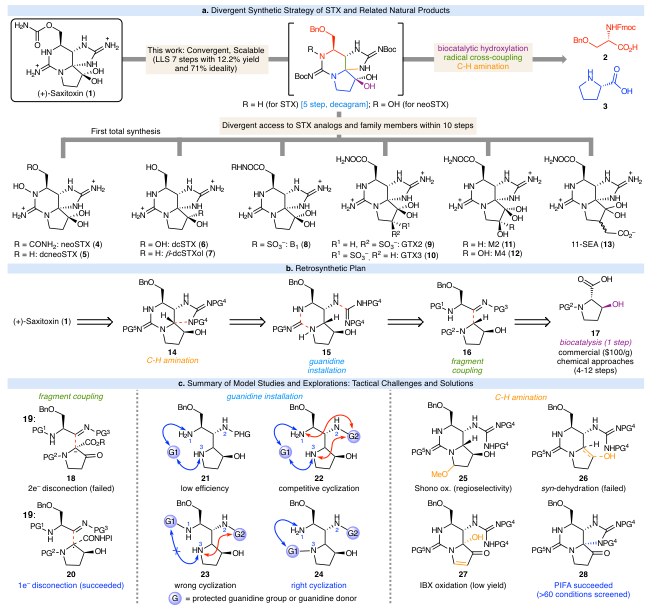
图1. 石房蛤毒素及相关天然产物的合成策略
(图片来源:Nature)
图1b所示的逆合成策略提出了四个需要克服的主要策略挑战。首先,需要发明一个关键的C–H胺化反应来解锁五元胍亚基(14)。其次,需要确定胍单元的精确安装时间和身份(15)。为了实现最大程度的收敛,需要一种偶联吡咯烷和二胺片段的方法(16)。最后,需要一种简单的途径来获得对映体纯的反式3-羟基脯氨酸。最终发现,可以利用一种新型真菌加氧酶实现L-脯氨酸的选择性生物催化C–H羟基化。
作者探索了未表征的真菌羟化酶的功能,利用工程酶 FrbA-Rd10bb,开发了一种在高底物浓度(> 70 g/L 脯氨酸 3)下,在可扩展条件下生产反式-3-羟脯氨酸的工艺。羟基化反应完成后,用 Boc2O 进行了原位保护,并分离出相应的 N-Boc-反式-3-羟脯氨酸 31,产率为 61%(图2)。
其余三个策略难题可以如图1c所示解决。标准极性键分析表明,β-酮酯18与亚胺19发生Mannich型反应,然后进行脱羧反应是合理的。最终,脱羧自由基与亚磺酰亚胺的偶联反应被证明是一种温和、可靠且通用的方法来合并这些片段。这种方法使得作者能够探索大量受保护的1,2-二氨基片段,并以良好的非对映选择性生成加合物。
如图1c所示,对一系列差异保护的三胺研究了一系列不同的胍供体。最终发现,诸如24之类的结构,其中N(3)和N(2)被胍基化,可以实现所需的环化反应。该反应可以在“一锅法”中进行,并且由于自由基偶联的模块化特性,可以制备和评估数十种类型的底物。针对所提出的简化C–H胺化断开方法(14),作者对多种最终环化方法进行了评估。受到Nagasawa使用高价碘氧化剂的启发,尝试了基于IBX的氧化,经过大量优化后,得到α-羟基烯酮 27,产率约为 20%。在此结果的基础上,对一系列基于I的氧化剂和条件进行了评估,最终发现 PIFA 可以得到所需的环化加合物28;进一步优化这一目标,得到了一个强大且可扩展的解决方案,以打造这一关键的N-C骨架键。
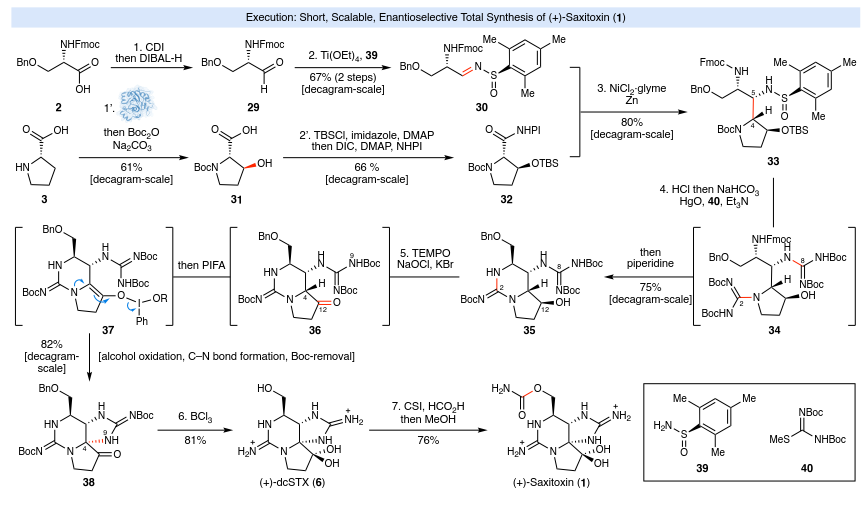
图2. 石房蛤毒素的短、可扩展、对映选择性全合成
(图片来源:Nature)
STX及其相关类似物的全合成,其简洁且可扩展的解决方案如图2所示。以丝氨酸衍生物2和脯氨酸(3)为原料,以十克规模制备了所需的结构单元30和32。前者可以通过还原和亚磺酰亚胺的形成得到30(两步产率为67%);后者则利用前述3的生物催化C-H氧化,然后进行一锅醇保护/氧化还原活性酯(RAE)形成,以40%的总产率得到RAE 32。在已报道的条件下,30和32的收敛自由基偶联反应顺利进行,以80%的分离产率在十克规模上生成单一非对映异构体33,其中均三甲苯基亚磺酰胺和TBS保护的醇分别控制C-5和C-4处的立体化学。使用HCl去除亚磺酰胺、Boc和TBS基团,然后依次添加NaHCO3、HgO和胍供体40,生成中间体34,在加入哌啶后环化为35。在完成合成所需的所有原子都到位后,通过连续氧化一步形成了最后一个骨架键(C4-N9)。将35暴露于Anelli氧化条件(TEMPO/NaOCl)下生成 36,然后立即添加 PIFA (2.0 当量),得到完整的 STX 核心38,在十克规模上的分离产率为 82%。该方法的简便性可见一斑:一位化学家仅用三天时间,就能够从结构单元30和32一次性制备出超过9克的38。上述五步(LLS)路线迄今为止已制备出超过12克的关键中间体(38)。由于天然产物及其类似物在脱保护后具有毒性,后续步骤的规模较小。BCl3介导的Bn和Boc基团脱保护反应顺利进行,产率为81%,最终实现了众多STX家族成员的形式全合成。如对Kishi的程序进行轻微修改,即可得到产率为76%的1。在用于制备1的七个步骤中,有五个步骤形成了关键的骨架键,理想化率达到71%。
如图 3a 所示,在有了足量关键前体38的情况下,可以通过不同途径合成各种天然存在的 STX 类似物。修改 Nagasawa 和 Du Bois 的方案,可以合成 M2 (11)和GTX2/3 (9,10)。将 38转化为相应的硅醇醚(NaHMDS/TBSCl),再进行 Rubottom 氧化,可以65%的产率得到环氧化物 41。使用 BCl3 去除 Boc 基团,在原位 TBS 迁移后生成 42。在标准条件下进行氨基甲酸酯安装,经过 2 步合成 M2 (11),产率为 51%。然后可以使用已知方法合成硫酸化天然产物 9/10 (DMF•SO3, DTBMP, 71%)。将M2 (11)在甲酸铵水溶液中长时间暴露于空气中,可直接生成M4 (12),产率为58%。类似地,Looper策略也可通过简单的四步反应轻松获得(+)-11-SEA (13):(1)脱除Bn,(2)用ICH2CO2H酰化得到43(两步产率为58%),(3)与叔丁基亚氨基-三(吡咯烷基)正膦(BTPP)环化得到大环44,最后(4)使用氯磺酰异氰酸酯(CSI)和甲酸进行开环/氨基甲酸酯化(两步产率为43%)。值得注意的是,(+)-dcSTX (6)是天然产物 7 (β-dcSTXol)和 8 (B1)的已知前体,因此也可以实现这些化合物的形式合成。
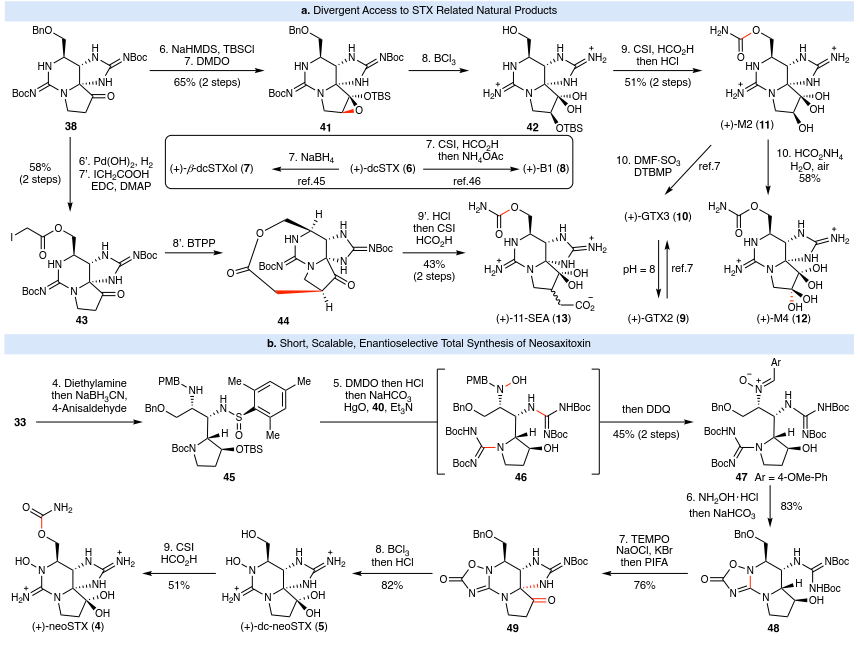
图3. 石房蛤毒素相关天然产物的不同获取途径
(图片来源:Nature)
为了突出上述模块化方法的优势,作者进行了 neoSTX (4) 的首次全合成。需要克服的关键障碍是将氧定点掺入STX中间体33中的三个氮原子之一上(图2)。这是通过去除Fmoc基团并通过还原胺化与PMB 基团原位交换得到仲胺45来实现的。筛选了一系列氧化剂,发现 DMDO 可以将仲胺干净地氧化为相应的 PMB 保护的羟胺衍生物。这些温和的条件允许依次添加试剂以去除亚磺酰胺、Boc 和 TBS 基团以及安装胍以提供 46(未分离);用 DDQ 立即处理反应混合物,经过两个步骤得到硝酮 47,产率为 45%。在对盐酸羟胺的当量、温度、添加剂(NaHCO3、吡啶、TEA、AcOH、PPTS、PTSA)和溶剂进行广泛筛选后,在0 ºC至室温条件下,将一当量的羟胺•HCl溶于DCM/MeOH(1:1)中,然后加入等体积的饱和NaHCO3,即可以83%的产率干净地生成48。这种串联脱保护和双环化反应对于掩盖敏感的胍基和N-羟基官能团至关重要。接下来,利用用于合成1(35至38)的关键C–H胺化步骤,可以顺利地将48转化为49,产率为76%。与1的合成类似,将中间体49脱保护,并选择性氨基甲酰化,经HPLC纯化后,分离产率为51%,最终得到4,其谱图结果与报道的天然产物一致。
除了STX家族外,这种模块化方法还可以合成新的非天然类似物。因此,分别以D-丝氨酸(50)和Fmoc-Hyp(Bzl)-OH(55)为原料,合成了(+)-6-epi-dcSTX(51)/(+)-6-epi-STX(52)和类似物56,如图4a所示。同时,将neoSTX (4)合成中的高级中间体49脱保护,然后进行氨基甲酰化,得到类似物53和54。鉴于Nav通道在中枢和周围神经系统的重要生理功能中发挥着广泛的作用,利用CHO细胞表达的hNav1.7和hNav1.4的全细胞膜片钳记录技术,以及体外大鼠背根神经节(DRG)感觉神经元实验和大鼠内侧前额叶皮质(mPFC)脑切片实验,评估了这些新型类似物的钠通道抑制活性(图4b)。结果显示,类似物51、52、56和53对hNav1.4和hNav1.7以及DRG实验均表现出较弱的抑制活性。
图4. 石房蛤毒素类似物的合成及活性研究
(图片来源:Nature)
总结
Marisa Roberto和Phil S. Baran团队概述了STX家族(已制备或可形式获取的11种天然产物)的简洁、可扩展、对映选择性合成方法,这是迄今为止已报道的获取这一经典且具有重要药用价值的天然产物家族的最直接途径。该合成路线的模块化特性原则上可以用于获取各种天然和非天然的STX类似物。其中一些独特的类似物已通过电生理学分析进行评估,并有望进一步开展后续研究。经证明,将自由基逆合成(以实现收敛)、C-H官能化(以形成关键的C-N骨架键)和生物催化(以简化反式-3-羟脯氨酸的获取)等现代策略巧妙结合至关重要。本文的合成蓝图将使这些具有药用价值的天然产物的获取更加便捷,并促进更复杂家族成员的合成。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn