

上海交通大学陈志敏课题组长期致力于手性有机硫/硒化学研究,近年来开发了Lewis碱/Brønsted酸协同催化烯烃的亲电硫化/硒化反应,高效合成了一系列中心手性有机硫/硒化合物(Angew. Chem. Int. Ed., 2025, 64, e202503815; Nat. Commun., 2025, 16, 2147; Angew. Chem. Int. Ed., 2019, 58, 12491-12496; CCS Chem., 2022, 4, 3342-3354; ACS Catal. 2023, 13, 2715-2722.)。同时,他们于2022年首次实现了Lewis碱催化的芳香亲电硫代反应,为合成轴手性含硫化合物提供了新方法(J. Am. Chem. Soc., 2022, 144, 2943-2952; Angew. Chem. Int. Ed., 2022, 61, e202211782.)。并进一步将该策略拓展至平面手性含硫大环化合物与固有手性含硫杯芳烃的高效构筑(Angew. Chem. Int. Ed., 2024, 63, e202318625; Nat. Commun., 2024, 15, 9929.)。近期,该课题组取得新进展,报道了基于动态动力学拆分策略的不对称亲电硫代反应,成功实现了螺旋手性含硫氮杂-[5]螺烯的高效、高对映选择性合成 。
螺旋手性化合物因其独特的结构与电子性质,在功能材料与不对称催化等领域应用潜力广阔(Scheme 1a)。尽管合成化学家已发展了多种方法以构建结构多样的手性螺烯,但与发展相对成熟的中心手性及轴手性不对称合成相比,其催化不对称合成研究仍面临挑战,关注相对较少(Scheme 1b)。这一挑战可能主要源于其螺旋骨架固有的结构刚性与较大空间位阻,使得高对映选择性构建较为困难。现有策略主要包括从头合成、动力学拆分及动态动力学拆分;其中,DKR策略虽简捷高效,但目前仅有一例相关研究报道(Scheme 1c)。此外,有机催化在该领域的应用也相对滞后。因此,发展新策略以高效合成具有独特结构的螺旋手性分子,仍是当前亟需解决的重要课题。
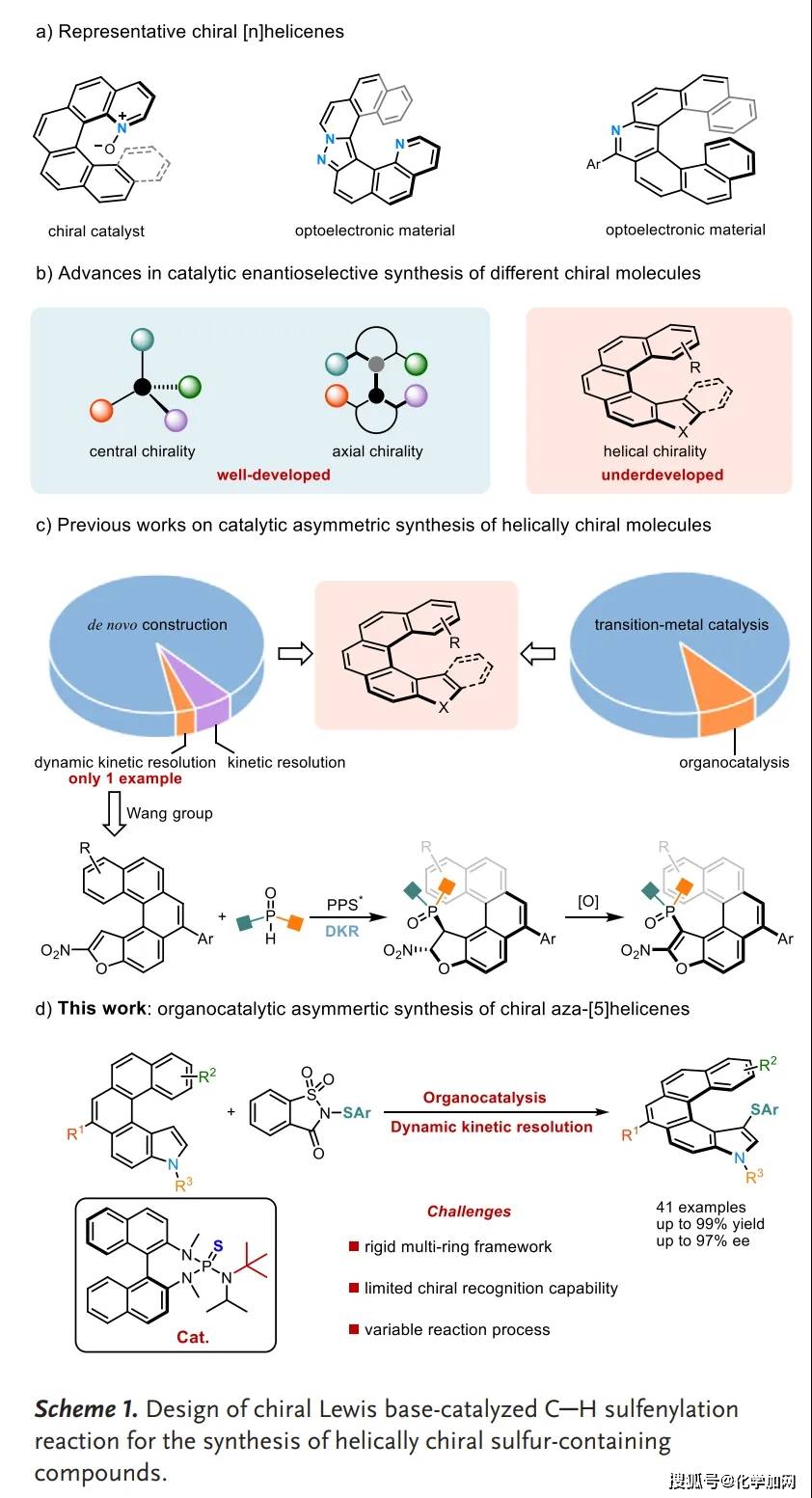
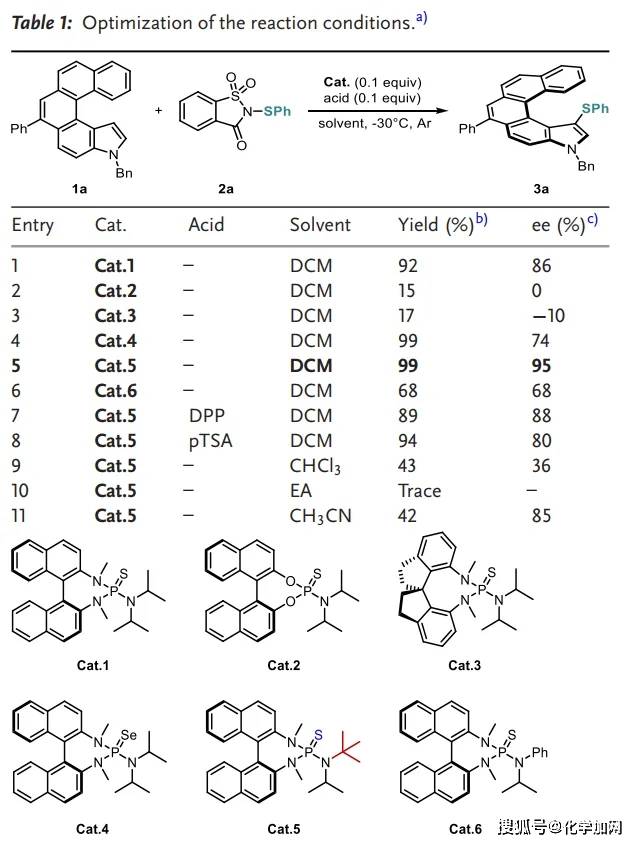
本研究设计通过吲哚衍生物的C–H硫化反应来高效构建结构多样的螺旋手性含硫氮杂-[5]螺烯(Scheme 1d)。首先使用一种新型吲哚衍生物1a作为模型底物,并选用糖精衍生的硫化试剂2a作为亲电试剂。初始反应在手性BINAM衍生Lewis碱催化剂Cat.1的催化下,在–30 °C、二氯甲烷(DCM)中进行(Table 1)。令人欣喜的是,目标产物3a收率达92%,86% ee。为进一步提升对映选择性,作者对一系列催化剂、溶剂和酸进行了系统筛选,确定了最优反应条件(entry 5)。
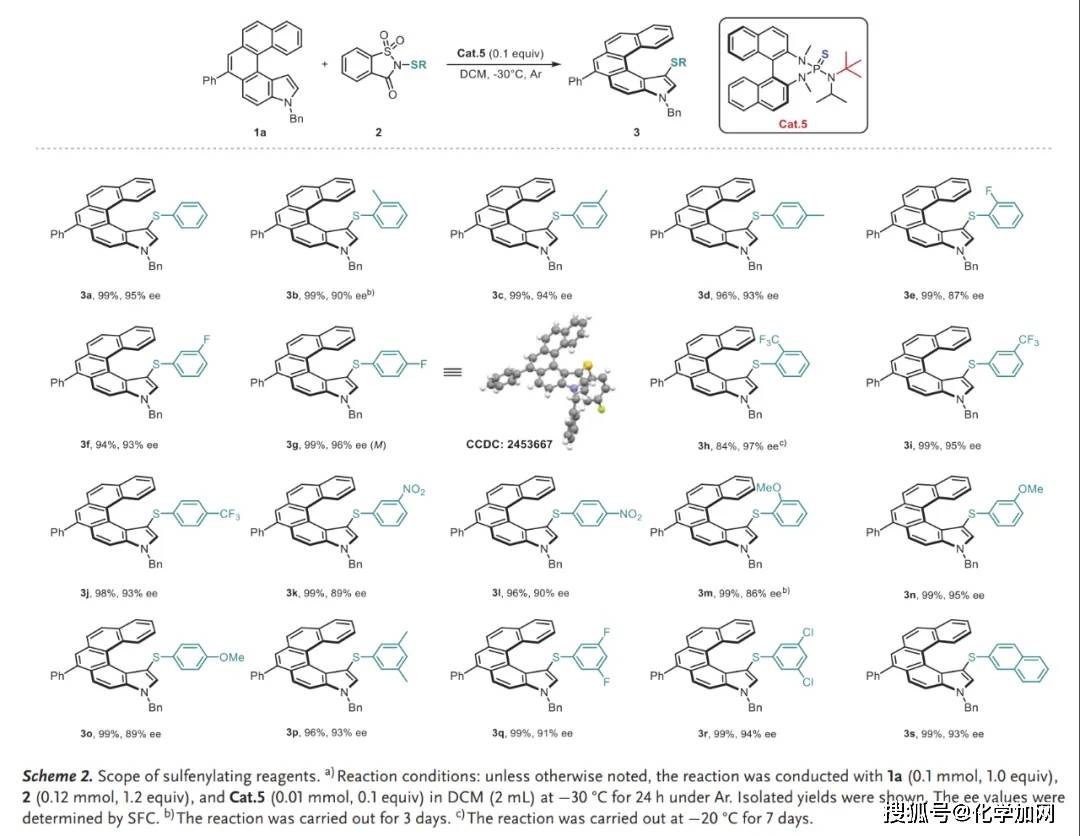
在获得最优反应条件后,作者对该方法的底物适用性进行了考察。该方法对硫化试剂和吲哚底物均表现出广泛的适用性。各种取代的糖精衍生硫化试剂(含甲基、氟、三氟甲基、硝基、甲氧基等取代基)以及多取代和2-萘取代的硫化试剂都能很好地适应此催化体系(Scheme 2)。同时,多种吲哚衍生物,包括带有吸电子基团(氟、氯、氰基、酯基、三氟甲基)和给电子基团(甲氧基、羟基)的底物,以及含有2-萘环、噻吩环和烷基的底物,都能以高收率和高对映选择性得到相应产物(Scheme 3)。
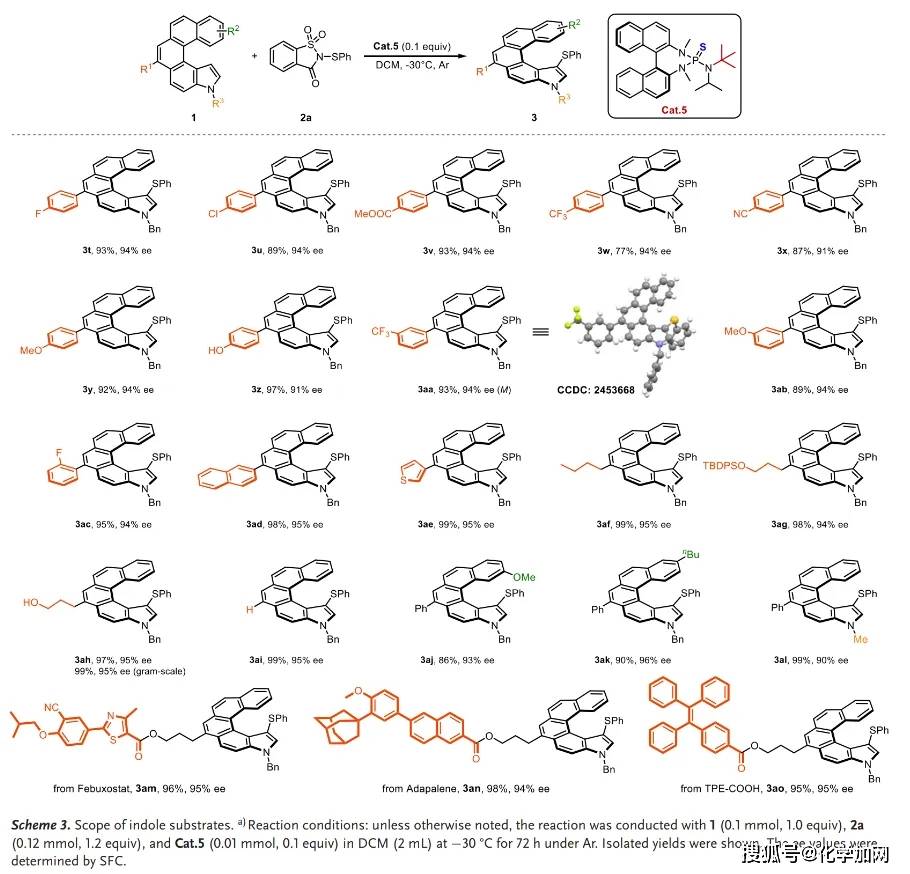
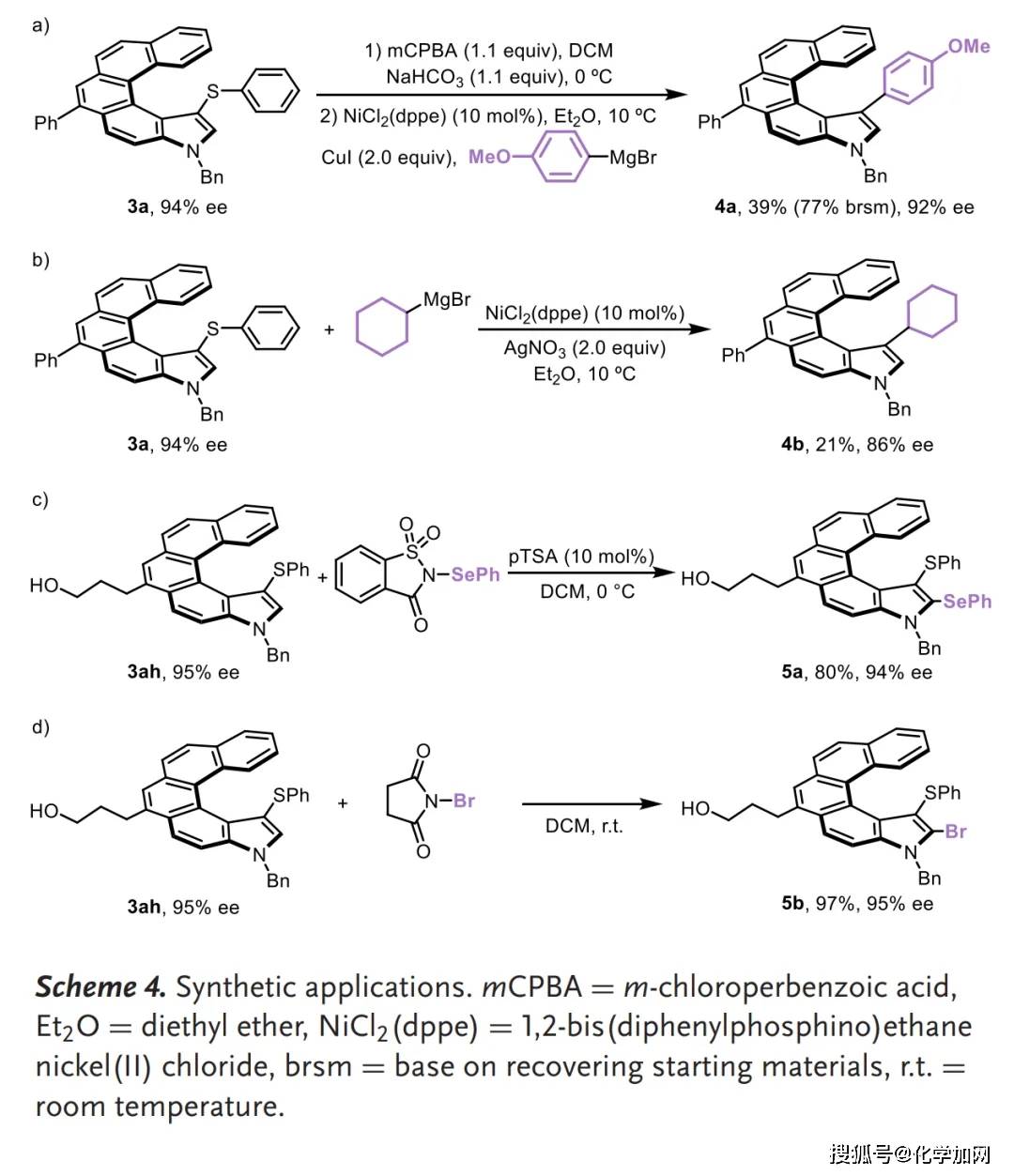
该方法也可以应用于药物分子(如非布索坦和阿达帕林衍生物)和聚集诱导发光(AIE)分子(四苯基乙烯衍生物)的后期修饰。克级规模反应也能以99%的收率和95%的对映选择性获得产物3ah(Scheme 3)。此外,产物3a经过氧化和镍催化的交叉偶联反应,成功实现了C-S键断裂和C-C键形成,得到了对应的芳基化和烷基化产物。化合物3ah 分别与N-苯硒代糖精 和N-溴代丁二酰亚胺(NBS) 反应也能以较高收率获得对应取代产物且对映选择性得以保持(Scheme 4)。
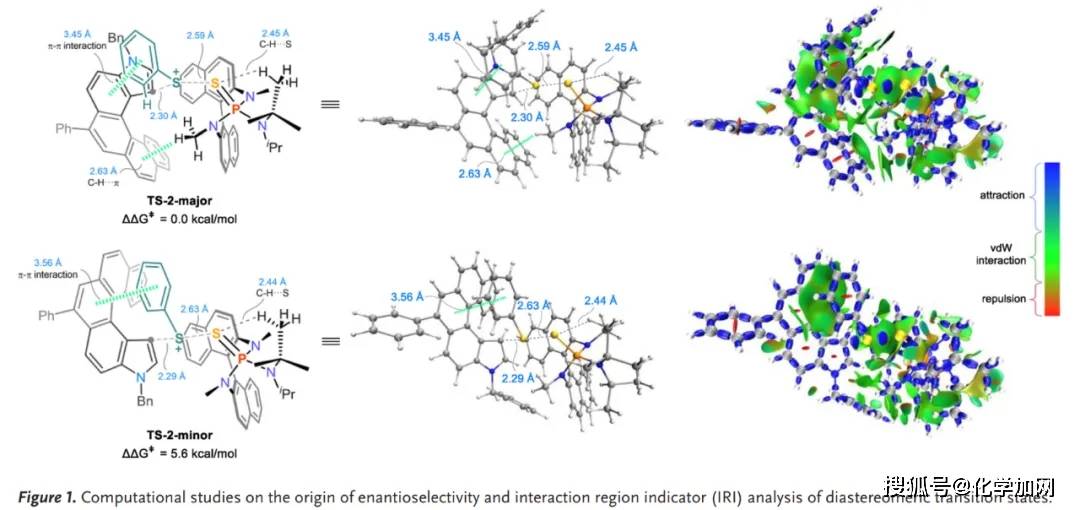
作者通过实验证明了底物1a具有较低的旋转能垒,容易发生外消旋化,表明芳香硫化反应通过动态动力学拆分过程进行。为深入理解反应得对映选择性控制,作者进行了 DFT 计算,比较了两种可能过渡态(TS-2-major 与TS-2-minor)的 Gibbs 自由能,对应于 3a 主要对映体的TS-2-major 比TS-2-minor 稳定5.6 kcal mol⁻¹。相互作用区域指示(IRI)分析显示TS-2-major 中存在芳基硫与底物芳环的π‧‧‧π 堆积作用,催化剂 N-甲基 C–H 与底物芳环的 C–H‧‧‧π 作用与催化剂与底物间显著的范德华(vdW)作用也降低了此过渡态的能量。上述多重非共价作用的协同差异,共同决定了 TS-2-major 的能量优势,从而保证了高对映选择性(Figure 1)。
上海交通大学陈志敏教授课题组开发了一种通过手性硫醚催化的C-H键硫化反应合成螺旋手性含硫氮杂-[5]螺烯的简便高效方法。机理研究表明该反应经历了动态动力学拆分过程,同时DFT计算阐明了对映选择性的起源,并强调了硫化试剂与底物之间的π-π相互作用以及催化剂与底物之间的C-H···π相互作用在此反应中的关键作用。该方法为螺旋手性化合物的合成提供了新策略,并在药物分子和功能材料分子的后期修饰中展现出良好的应用潜力。该研究成果近期发表在国际学术期刊Angew. Chem. Int. Ed.上。上海交通大学李泽龙同学为该工作的第一作者,陈志敏教授为通讯作者。
Dynamic Kinetic Resolution Approach to Chiral Sulfur-Containing Aza-[5]helicenes via Chiral Lewis Base Catalyzed C─H Sulfenylation.
Ze-Long Li, Yu-Xuan Huo, Qi-Sen Gao, Dr. Tong-Mei Ding, Prof. Dr. Zhi-Min Chen
Angew. Chem. Int. Ed., 2025, e202515017
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn