

(图片来源:Angew. Chem. Int. Ed.)
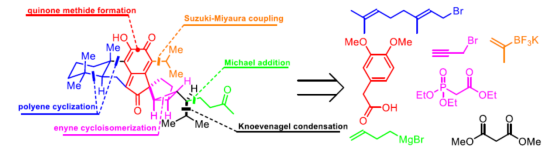
2010年,郭悦雄小组从日本柳杉(Cryptomeria japonica)的树皮中首次成功分离出一种新型的C35-萜烯,即Cryptotrione 1(Figure 1)。自1983年从日本柳杉家族中分离出第一个Cryptotrione成员以来,有九个家族成员已被分离,包括Chamaecydin(2),Isochomaecydin(3),Cryptoquinonemethides D和E (4和5)。这些天然产物中,均具有双环[3.1.0]的松香烷(Abietane)型二萜骨架。而结构最复杂的Cryptotrione具有抗口腔癌细胞的生物活性,lC50约为6.44±2.23 μM,仅比临床使用的抗癌药依托泊苷(Etoposide)稍弱(VP-16, lC50~2.0 μM)。基于此类骨架具有重要性,在此,香港中文大学彭小水教授课题组通过铂催化实现双环[3.1.0]己烷结构构建后,再与亚甲基醌化合物结合,成功对Cryptotrione(1)进行了全合成。

(图片来源:Angew. Chem. Int. Ed.)
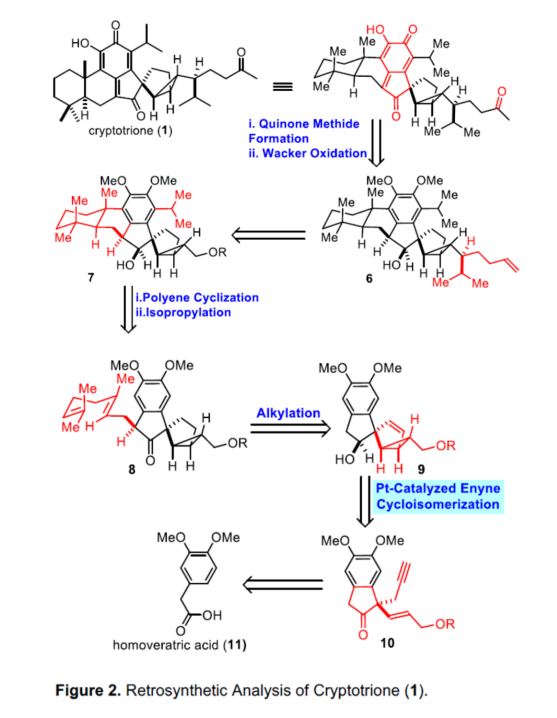
首先,双环[3.1.0]己烷单元和亚甲基醌结构单元是Cryptotrione家族共有的结构特征,作者对此展开了逆合成分析。基于金或铂催化的1,n-炔烃环化异构化构建双环[n.1.0]己烷衍生物的文献报道(Figure 2),作者认为可从1,5-烯炔化合物10通过环化异构化合成关键的双环[3.1.0]己烷中间体9。此外,考虑到异丙基在苯环上的空间效应,作者认为具有异丙基的底物的烯炔环化异构化可能导致不希望的双环[3.1.0]己烷部分的立体化学选择性。同时,可从市售的高藜芦酸(11)通过已知方法合成1,5-烯炔前体10。一旦获得具有双环[3.1.0]己烷单元的醇9,醇9的烷基化就可以生成多烯8。然后,具有α-烷基的化合物8将经历Lewis酸催化的立体选择性环化和异丙基化,形成反式多环化合物7(其中立体环化可以通过酮8中相关α-烷基的立体化学来控制)。紧接着,将侧链引入7中获得烯烃6。最后,形成的亚甲基醌化合物后再进行Wacker氧化,即可合成Cryptotrione(1)。
(图片来源:Angew. Chem. Int. Ed.)
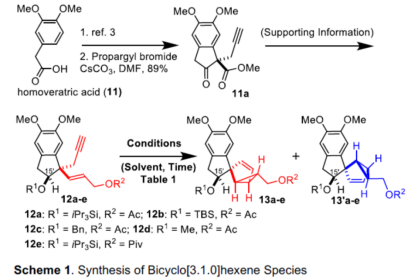
首先,作者对双环[3.1.0]己烷结构单元的合成进行了研究(Scheme 1)。以市售高藜芦酸(11)为初始底物,通过已知的碳烯插入法制备各种烯炔12a-12e,然后进行一系列经典转化。接下来,作者着眼于将烯炔12a-12e转化为所需的双环[3.1.0]己烷化合物13a-13e,而不是13´a-13´e。同时,为了了解烯炔12a-12e中保护性羟基的立体效应,作者通过非对映选择性还原制备了C15'-α-甲硅烷氧基-1,5-烯炔化合物和C15'-β-甲硅烷氧基-1,5-烯炔化合物。在Toste的Au催化条件下,α-甲硅烷氧基-1,5-烯炔会生成不希望的双环[3.1.0]己烷化合物,其环丙烷环的相对构型与Cryptotrione(1)不同。因此,作者选择了C15'-β-甲硅烷氧基-1,5-烯炔12a-12e作为生成双环[3.1.0]己烷单元的底物,从而形成所需的立体化学的关键前体13a-13e。
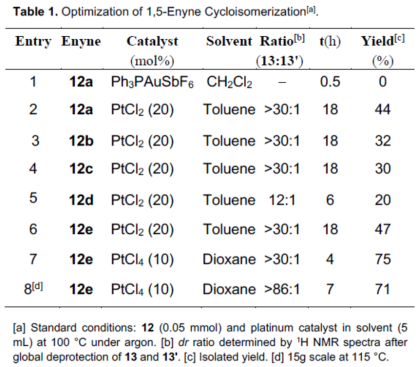
不幸的是,在10%Ph3PAuCl/AgSbF6存在下,烯炔12a完全分解(Table 1, entry 1)。令作者高兴的是,在100 ℃的甲苯中使用20 mol%的PtCl2时,可顺利进行12a的烯炔环化异构化,获得44%收率和dr> 30:1的13a(entry 2)。而具有较小保护基的12b(TBS与iPr3Si)的收率略低(entry 3)。具有β-苄氧基的烯炔12c也以30%的收率得到13c。将R2上的乙酰基保护基替换为新戊酰基,收率仅略有提高(entries 4-5),然后,使用烯炔12e进一步优化催化剂和溶剂,当使用10 mol%的PtCl4和1,4-二氧六环作为溶剂时,可将收率提高至75%(entries 7-8)。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
在获得关键的中间体13e后,作者开始对二醇21进行了合成(Scheme 2)。13e脱甲硅烷基化、氢化后以75%的收率得到醇14(相对构型相同)。Dess-Martin氧化14,再使用一当量的LDA在混合溶剂中(THF:DMPU=10:1)与溴化香叶酯进行单烷基化反应,从而获得单烷基化多烯酮15的非对映异构体混合物,收率为72%(84% brsm)。由于酮15的混合物通过柱色谱法是不可分离的,并且易于分解,因此作者试图将羰基还原为羟基来稳定酮15,由于羟基会降低α-质子的酸度,从而防止环化前体发生潜在的差向异构。各种还原剂的筛选显示,酮15可在低温下被三仲丁基硼氢化锂(L-selectride)非对映选择性还原,以33%的收率(48% brsm)获得syn-C7,15'-β,β-多烯醇17作为主要非对映异构体(dr = 13:1)以及syn-C7,15'-α,α-多烯醇16为单一异构体,收率为35%。醇16能够进行氧化,然后进行差向异构化,以88%的收率获得酮15(dr = 1:1)。为了稳定多烯醇17并防止其在酸性条件下发生阳离子-烯烃环化,作者将羟基转化为乙酸酯。
为了构建松香烷(Abietane)型骨架,作者探索了Lewis酸催化醇17的多烯环化,形成反式十氢化萘产物18。根据Stork-Eschenmoser的规则,预计化合物17的C7-β-反式多烯乙酸酯的环化将以有利的双椅式过渡态进行,形成具有C10-β-角甲基的反式萘烷产物18。通过相关条件的优化,使用Bi(OTf)3时,可将17的乙酸盐转化为18(单一非对映异构体)。
构建反式十氢化萘骨架后,作者开始将异丙基引入苯环上。具有各种促进剂(Ph3P=S,AgNTf2,AuCl3或两性离子盐)的NBS或在DMF中具有强Brønsted酸(如H2SO4)的NBS都无法成功地进行溴化反应,但使用NBS和AcOH时,能以30%的收率(50%brsm)获得溴化物19。而在六氟异丙醇(HFIP)和DMF的混合溶剂中使用两当量的NBS,溴化物19的收率可提高到53%(69% brsm)。使用该异丙基化条件,溴化物19仅产生了还原性产物18和正丙基取代的产物。然后,作者尝试在Stoltz’s条件下逐步引入异丙基。如所预期一致,溴化物19与异丙烯基三氟硼酸钾顺利进行Suzuki-Miyaura偶联,形成不可分离的阻转异构体混合物的烯烃20,收率为80%(约3:1)。用DIBAL-H还原20以减小该空间位阻,随后进行氢化反应,成功地以两步91%的收率得到了二醇21。

(图片来源:Angew. Chem. Int. Ed.)
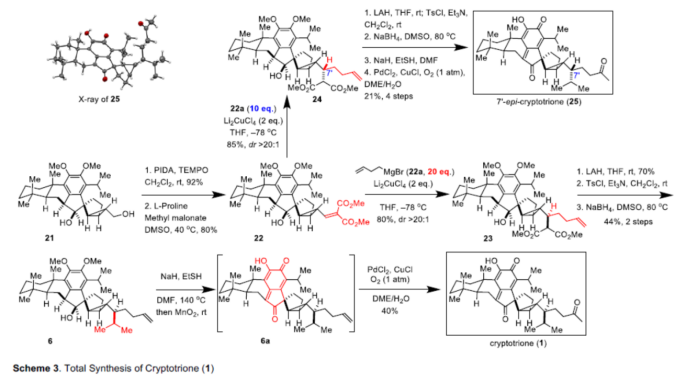
在获得上述二醇21结构之后,作者开始对侧链的引入进行了研究(Scheme 3)。使用PIDA-TEMPO对21的伯羟基进行选择性氧化,随后与丙二酸二甲酯进行Knoevenagel缩合反应,以80%的收率获得α,β-不饱和丙二酸酯22。当在-78 ℃下使用烯丙基溴化镁22a(20 eq.)时,以Li2CuCl4作为铜源,获得共轭加成产物23(收率为80%,dr>20:1)。有趣的是,在-78 ℃下,当改用不同的加料方式时,使用烯丙基溴化镁22a(10 eq.)和Li2CuCl4(2 eq.)产生的共轭加成的立体选择性完全相反,形成具有出色的dr(在C7'处> 20:1)的24(C7'-23的差向异构体)。因此,由于形成了不同的铜镁配合物,可以使用不同量的溴化高烯丙基溴和加料方式来完全控制C7'处的立体化学。
然后,烯烃23和24分别准备合成Cryptotrione(1)和 7’-epi-cryptotrione(25)。因此,Michael受体22用作非对映异构收敛中间体,用于合成Cryptotrione(1)和 7’-epi-cryptotrione(25)。丙二酸酯23经LiAlH4还原,随后选择性甲苯磺酸化,所得的甲苯磺酸酯再被氢化物取代,以3步30%的产率得到了烯烃6。然后在碱性条件下将6脱甲基,得到二羟基中间体,不幸的是,该中间体在空气中不能自动氧化成其相应的邻醌。于是,作者用MnO2氧化该二羟基苯酚中间体,生成了对亚甲基醌化合物6a,将其直接进行Wacker氧化而无需进一步纯化,最终以40%的收率合成的Cryptotrione(1)。此外,使用烯烃24经历从烯烃23到Cryptotrione(1)的类似步骤,经5步后成功地以18%的收率实现了7'-epi-cryptotrione (25)的全合成。
(图片来源:Angew. Chem. Int. Ed.)
总结:香港中文大学(香港、深圳) 黄乃正院士团队彭小水教授课题组首次以非对映选择性和非对映异构收敛的方式从市售高藜芦酸(11)出发完成了Cryptotrione (1)的全合成。该策略通过铂催化的烯炔环化异构化实现双环[3.1.0]己烷骨架的非对映选择性构建,通过Lewis酸催化多烯环化构建松香烷(Abietane)型三环二萜骨架,通过非对映共轭加成完成侧链叔碳中心的控制。
撰稿人:杉杉
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn