

大自然存在大量以碳为手性中心的光学活性化合物,这些碳中心手性化合物在生命的演化进程中发挥了至关重要的作用。有趣的是,作为同一族的硅,以其为手性中心的有机硅化合物在自然界中并不存在。这激发了科学家们创造并研究这一特殊物质的极大兴趣。科幻作家甚至大胆推测,与地球的“碳基”生命不同,地外世界可能存在相应的“硅基”生命。近年来,随着不对称化学的蓬勃发展,硅中心手性化合物的构建除了传统的化学拆分、底物手性诱导之外,也逐渐涌现出了一些更为高级的不对称催化合成方法。与此同时,这些硅中心手性有机硅化合物在合成化学、材料科学、药物化学以及生命科学等领域也显示出了非常重要的应用价值。
与碳中心手性相比,sp2杂化的硅原子双键稳定性差,使得通过加成反应来构建硅中心手性的途径不可行,构建硅中心手性化合物只能依赖于手性拆分或对前手性硅烷的去对称化。此外,碳–硅键的键长固有地比碳–碳键要长,这就不利于形成紧凑的过渡态;位于第三周期的硅原子可以形成多于四个共价键的结构,会因此容易发生硅中心手性消旋化;与硅原子相连的取代基团的结构和性质通常都比较类似,使得其对映面的区分非常困难。以上这些因素都给构建硅中心手性化合物带了极大的挑战和难度。因此,如何从简单的原料出发,通过简洁、高效、高对映选择性的方法构建硅中心手性化合物,一直是化学家们研究的一个难点,同时也是推动其在手性功能材料、电子器件、生命及医药科学等领域进一步发展应用的基础和关键。
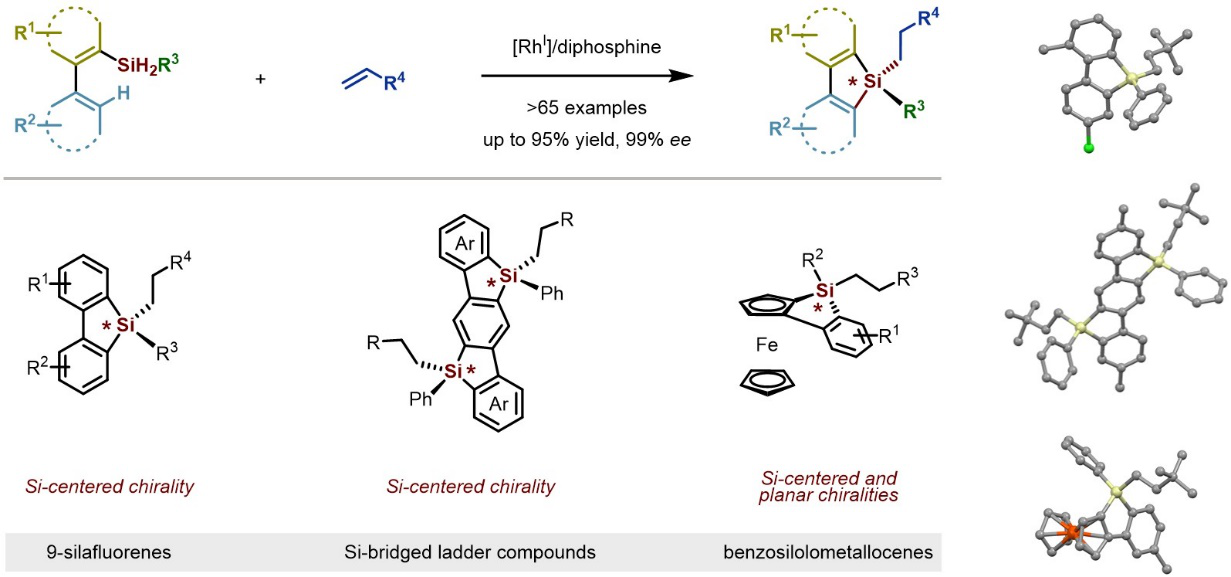
图1 串联不对称碳氢硅化/烯烃硅氢化反应构建硅中心手性
近日,何川课题组从简单的二氢硅烷和烯烃出发,首次实现了铑催化的串联不对称碳氢硅化/烯烃硅氢化反应,“一锅法”流水线般实现了四取代硅中心手性苯并噻咯类衍生物的高效高对映选择性构建(Streamlined Construction of Silicon-Stereogenic Silanes by Tandem Enantioselective C−H Silylation/Alkene Hydrosilylation, J. Am. Chem. Soc. 2020, DOI: 10.1021/jacs.0c04863)(图1)。该方法设计巧妙、普适性好,实现了反应化学选择性、区域选择性和立体选择性的完美控制,获得了一系列含有多种官能团的四取代硅中心手性苯并噻咯类化合物,为结构多样化的硅中心手性化合物的模块化合成提供了简便、高效的新方法。课题组博士后穆德龙和袁伟为论文的共同第一作者,何川为论文的唯一通讯作者,南科大为唯一通讯单位。此外,化学系副教授余沛源在理论计算方面也作出了重要贡献。
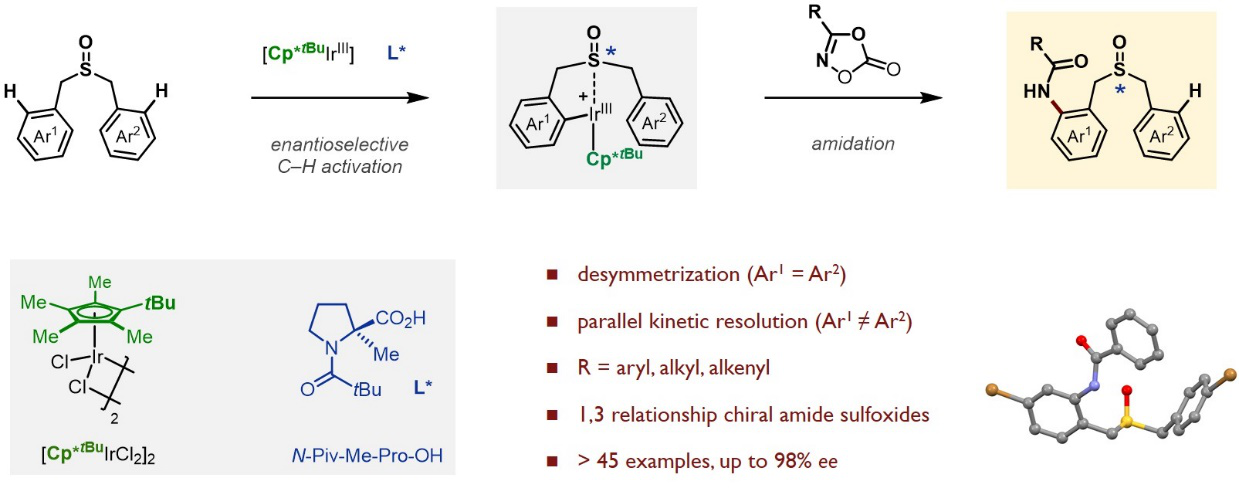
图2 亚砜导向的不对称碳氢酰胺化反应构建硫中心手性
除了硅中心手性的构建,何川课题组采用对映选择性去对称化和平行动力学拆分的策略,通过对非手性Cp配体和手性羧酸配体的理性设计,发展了Ir(III)催化的亚砜导向的不对称碳氢酰胺化反应,高效、高对映选择性地实现了亚砜硫手性中心的构建(Dual-Ligand-Enabled Ir(III)-Catalyzed Enantioselective C–H Amidation for the Synthesis of Chiral Sulfoxides, ACS Catal. 2020, 10, 7207−7215)(图2)。该方法获得的手性酰胺化亚砜产物经过简单的衍生化,可以方便快速地得到一系列双齿和三齿配体,有望在不对称催化领域获得应用。值得一提的是,硫立体中心化合物在新陈代谢中起着非常重要作用;同时,手性亚砜作为一类重要的官能团,广泛应用于不对称催化和药物化学领域。课题组博士后刘文坛为论文的第一作者,何川为论文的唯一通讯作者,南科大为唯一通讯单位。此外,余沛源在理论计算方面也做出了重要贡献。
以上研究得到了国家自然科学基金委青年项目、深圳市科创委、深圳市诺贝尔奖科学家实验室项目、相关人才项目经费以及南科大分析测试中心、科学与工程计算中心的支持。
《美国化学会志》论文链接:https://pubs.acs.org/doi/10.1021/jacs.0c04863
《ACS催化》论文链接:https://pubs.acs.org/doi/10.1021/acscatal.0c02109
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn