

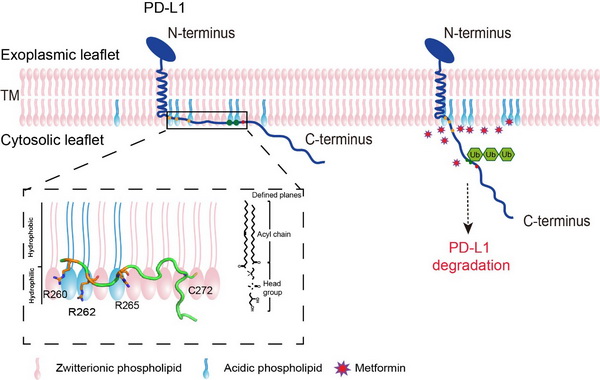
酸性磷脂调控PD-L1-CD与膜相互作用并影响PD-L1降解的示意图
8月24日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)欧阳波研究组的研究成果“PD-L1 degradation is regulated by electrostatic membrane association of its cytoplasmic domain”。该研究发现酸性磷脂对PD-L1胞质域(PD-L1-CD)的上膜起着重要调控作用,二甲双胍可以竞争性地使PD-L1-CD从膜上解离下来,并进一步影响到PD-L1的稳定性。该研究拓展了人们对二甲双胍抗肿瘤分子机制的理解。
细胞程序化死亡配体1(PD-L1)是在肿瘤细胞表面上高表达的配体分子,与T细胞表面细胞程序化死亡受体-1 (PD-1)特异性结合后,能使T细胞功能受到抑制,影响T细胞的活化、增殖,从而使T细胞失去原有的抗肿瘤杀伤作用。
以PD-1/PD-L1 通路为靶点的免疫检查点抑制剂近年来取得了巨大的成功。然而近期研究发现, PD-L1除了在肿瘤细胞的细胞膜上高表达,还大量存在于肿瘤细胞的循环内体、高尔基体和微囊泡上。肿瘤细胞还会释放富含PD-L1的外泌体,对细胞膜表面失活的PD-L1进行补充和更新,导致PD-L1的抗体药物无法有效地抑制不断更新的PD-L1从而失效。最新的研究发现PD-L1-CD存在各种翻译后修饰,并在调控PD-L1稳定性和表达水平方面起着非常重要的作用。以PD-L1-CD为靶点,可以从体内将PD-L1降解,彻底清除肿瘤细胞表面和内部的PD-L1,是更有效的阻断策略。因此,了解PD-L1的降解调控机制,将提供更多的特异性针对PD-L1的免疫疗法。
本研究中,研究人员通过使用核磁共振和生化技术首先发现PD-L1-CD在酸性磷脂存在的情况下,N端会与膜贴合。其中近膜区的三个精氨酸,R260,R262和R265,通过静电作用与细胞膜上的酸性磷脂结合,对PD-L1-CD与膜的相互作用非常关键。当PD-L1-CD包埋于细胞膜中时,会阻断翻译后修饰和下游降解通路,使得细胞表面的PD-L1更稳定,增加PD-L1的表达。突变R260,R262和R265三个精氨酸,会影响PD-L1-CD和细胞膜的相互作用,从而增强PD-L1的泛素化,加速其降解。研究人员通过核磁滴定和细胞实验进一步发现, II型糖尿病药物二甲双胍可以竞争性破坏PD-L1-CD 和酸性磷脂的静电作用,从而达到降低PD-L1表达的效果。该研究发现酸性磷脂不仅仅是细胞膜的组成成分,还参与了调控PD-L1稳定性和降解,并提出了一个新的二甲双胍调控细胞中PD-L1水平的机制,为以PD-L1为靶点的相关免疫疗法提供了新思路。
中国科学院分子细胞科学卓越创新中心温茂荣助理研究员、曹云雷硕士,张江实验室国家蛋白质科学研究(上海)设施吴斌博士为本文的共同第一作者。中国科学院分子细胞科学卓越创新中心欧阳波研究员、温茂荣助理研究员为本文的共同通讯作者。该研究得到了中国科学院和国家自然科学基金等的资金支持。该研究还得到张江实验室国家蛋白质科学研究(上海)设施核磁系统薛红娟和显微镜成像系统于洋的大力协助。
文章链接:https://www.nature.com/articles/s41467-021-25416-7
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn