


北京时间2021年9月27日,中国科学院上海药物研究所李亚平课题组以“T lymphocyte membrane-decorated epigenetic nanoinducer of interferons for cancer immunotherapy”为题在国际顶级期刊Nature Nanotechnology在线发表了工程化T淋巴细胞膜修饰干扰素(IFN)表观遗传纳米诱导剂改善肿瘤免疫治疗的最新研究成果。该团队创造性地设计构建了一种“精准递送+智能释药一体化”的仿生纳米囊泡,揭示了该纳米递药系统的作用机理,取得了肿瘤特异性IFN诱导并同时克服免疫耐受的重大突破。
免疫疗法是肿瘤治疗领域的革命性进展,肿瘤内I型IFN的水平与包括结肠癌、黑色素瘤和三阴性乳腺癌等在内的多种肿瘤预后密切相关。虽然目前临床上可以通过注射重组人IFN提高其瘤内水平,但其肿瘤靶向性差、疗效低,而且易产生明显的全身免疫毒性。化疗药物、分子靶向药物以及表观遗传药物虽然也能一定程度上诱导肿瘤内IFN表达,但由于特异性差,效果并不理想,特别是瘤内IFN的上调会不可避免地诱导多种免疫检查点分子表达,促使肿瘤发生免疫逃逸进而产生免疫耐受。因此,如何选择性提高瘤内IFN等免疫分子水平,并同时克服其诱导的免疫耐受,是肿瘤免疫治疗领域亟待解决的一个重大科学问题。
针对上述临床重大需求,上海药物所张鹏程研究员、李亚平研究员团队首先通过基因工程技术构建了高表达程序性死亡受体-1(PD1)的T细胞,并获得该工程化细胞的膜囊;随后用其包裹负载赖氨酸特异性组蛋白去甲基化酶1(LSD1)抑制剂ORY-1001的白蛋白纳米粒; 最后以还原敏感穿膜肽M70对其进行表面修饰获得表观遗传调控纳米囊泡(OPEN)(图1A)。静脉注射后,OPEN通过受配体(PD1/PDL1)的识别,主动靶向递送ORY-1001至表达PDL1的肿瘤细胞,在胞内谷光甘肽(GSH)的作用下快速释放ORY-1001,上调IFN表达, 促进抗原递呈细胞(APCs)活化和抗原呈递, 活化细胞毒性T淋巴细胞(CTLs),增加肿瘤微环境内T细胞浸润,同时阻断原有以及IFN上调的多种免疫检查点配体介导的免疫逃逸(图1B)。
研究数据显示,OPEN能特异性靶向肿瘤,高效诱导瘤内IFN分泌,上调肿瘤细胞PDL1和主要组织相容性复合体-I(MHC-I)等的表达,并进一步促进OPEN摄取,产生自增强效应,将瘤中CTLs浸润增加了29倍,显著降低ORY-1001的免疫副作用(图1C),在动物模型上有效抑制三阴性乳腺癌、黑色素瘤或结肠癌的生长(图1D)。该研究开拓了精准递送+智能释药一体化技术调控表观遗传、克服免疫耐受、改善肿瘤免疫治疗的新方向,为提高包括IFN在内的兼具抗癌活性和促进免疫逃逸的活性分子疗效以及降低其免疫副作用提供了新思路。
上海药物所博士研究生翟艺慧和上海交通大学仁济医院博士研究生王金名为该论文第一作者,上海药物所李亚平研究员和张鹏程研究员为论文共同通讯作者。上海交通大学朱鹤研究员,国家蛋白质科学中心(上海)于洋研究员和王研科工程师,中科环渤海(烟台)药物高等研究院和烟台药物所荣荣博士、孔颖工程师,上海药物所博士后郎天群及研究生蔡颖、冉伟、熊凤琴和郑超等参与相关研究工作,该工作还得到了上海交通大学邓刘福研究员和上海药物所王江研究员的帮助。研究工作同时得到了国家自然科学基金、中国科学院青年创新促进会和山东省自然科学基金的支持。
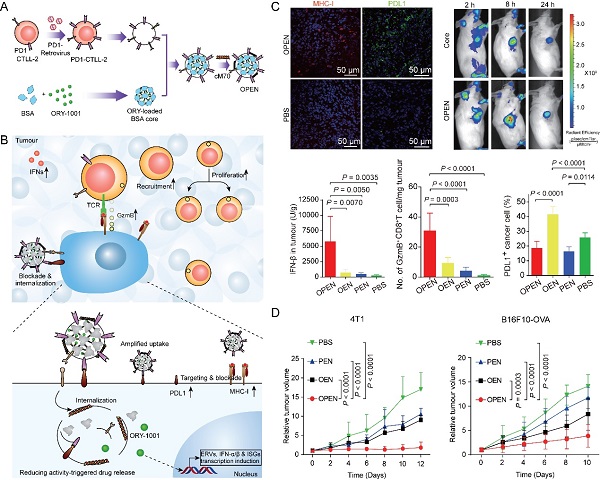
图1:(A). PD1过表达CTLL-2细胞的构建和负载ORY-1001纳米囊泡(OPEN)的制备。(B). OPEN被肿瘤细胞PDL1识别并入胞,上调IFN表达,增加肿瘤微环境内T细胞浸润并促进CTL活化,同时阻断PDL1介导的免疫逃逸。(C). OPEN特异性靶向肿瘤,显著上调瘤内IFN表达,促进抗原递呈,提高肿瘤中细胞毒性T细胞浸润并有效解除ORY-1001造成的免疫抑制。(D). OPEN显著抑制乳腺癌和黑色素瘤的生长。
原文链接:https://doi.org/10.1038/s41565-021-00972-7
专家点评1: 郝希山
中国工程院院士 肿瘤治疗学专家

表观遗传失调是诱发肿瘤发生发展的关键因素之一,但其作用机制仍不十分清楚。最近有研究表明,基因组内反转录因子的激活是表观遗传调节剂发挥抗肿瘤活性的一个重要机制,反转录因子的转录将导致dsRNA的胞内累积,进而结合并刺激模式识别受体,触发I型IFN的产生。肿瘤微环境(TME)中的IFN自分泌和旁分泌信号可进一步促进其他多种促炎因子和趋化因子的分泌,增加抗原呈递和免疫细胞浸润,提高免疫疗法抗肿瘤的效果。然而,促炎因子可同时诱导多重免疫检查点上调,造成肿瘤细胞免疫逃逸,进而限制表观遗传调节剂的抗肿瘤活性。表观遗传疗法存在的另一个大问题是药物对肿瘤的选择性差,表观遗传药物作用靶点广泛,脱靶效应易产生副作用,如骨髓抑制、中枢神经毒性等,即使与化疗、放疗、分子靶向治疗和免疫治疗结合,仍难以避免两种游离药物联合使用引起的副作用,所以亟需开发更合理的用法及靶向策略。
最近,中科院上海药物研究所李亚平团队报道了一种表观遗传与免疫疗法结合新策略:他们构建了一种基因工程化T淋巴细胞膜包载的仿生表观遗传调控纳米粒,显著提高了表观遗传药物的特异性。他们将LSD1的抑制剂(ORY-1001)包载到过表达PD1的T淋巴细胞膜囊泡中获得一种仿生纳米载药系统(OPEN),OPEN能特异性识别肿瘤细胞表面的PDL1,实现ORY-1001的靶向递送,促进单甲基化和二甲基化H3K4的累积。释放的ORY-1001上调IFN和下游干扰素刺激基因的表达(如MHC-I和PDL1)。MHC-I的上调可增加抗原递呈,促进T淋巴细胞对肿瘤细胞的识别,而上调的PDL1则被OPEN结合并中和。与游离的ORY-1001相比,OPEN可显著增加瘤内药物聚集,减少静脉注射后药物在肝脏的暴露,显著降低ORY-1001的副作用。肿瘤内的ORY-1001通过促进DC细胞熟化、细胞毒T淋巴细胞的增殖和肿瘤细胞抗原展示,重塑肿瘤免疫微环境(由“冷”到“热”)。在多种肿瘤动物模型中,OPEN也均显著抑制肿瘤的生长,延长小鼠的生存期。
该工作首次将表观遗传药物仿生纳米化并与免疫疗法相结合,实现了表观遗传药物的肿瘤靶向递送和免疫检查点阻断效应,成功解决了表观遗传疗法的特异性差和效果具有两面性二大关键难题,是表观遗传疗法与免疫疗法有效结合治疗肿瘤的一个重大进展。
点评原文链接:http://www.cancerbiomed.org/index.php/cocr/article/view/1921
专家点评2: 赵宇亮

中国科学院院士 国家纳米科学中心主任 Nano Today主编
免疫检查点阻断(ICB)和过继细胞免疫疗法是癌症治疗领域的革命性进展,在抑制肿瘤生长和预防复发方面具有极大临床价值,但目前癌症免疫治疗仍面临几个重大挑战,如响应率低,肿瘤T淋巴细胞浸润少易导致严重免疫相关不良反应等。纳米递药系统由于具有靶向递送、共递送和药物释放时空可控等特性,已引起生物医学领域的广泛关注。
中科院上海药物所李亚平团队长期致力于纳米递药系统(NDDS)在癌症免疫治疗领域的研究,他们提出了精准递送+智能释药一体化的载体设计新理念,取得了诸多开创性成果,如将纳米化抗体和光疗结合提高了ICB疗法的效果和安全性;构建共载BRD4抑制剂和光敏剂的水凝胶疫苗,有效抑制癌症的复发和转移等。
最近,他们构建了一种新的表观遗传纳米诱导剂,在癌症免疫治疗方面取得了重大突破。LSD1的缺失将导致I型IFN和干扰素刺激基因(ISG)的上调,进而激活先天性和获得性免疫。然而,IFN通路激活导致多种免疫检查点上调而产生的肿瘤免疫耐受仍是目前癌症免疫治疗面临的一个主要问题。李亚平和合作者将LSD1抑制剂(ORY-1001)包载到PD1过表达的工程化T淋巴细胞膜囊中,构建了一种新型表观遗传免疫纳米调节剂OPEN。OPEN经静脉注射后可被PDL1过表达的肿瘤细胞主动识别并内吞,在胞内GSH作用下,ORY-1001快速释放后激活IFN信号通路,上调MHC-I和PDL1,促进肿瘤细胞抗原展示和DC抗原提呈,增加细胞毒T淋巴细胞的瘤内浸润,上调的PDL1可增强OPEN的识别和内吞,进一步促进IFN分泌的同时阻断多重免疫检查点的抑制作用。实验结果显示:OPEN可使肿瘤浸润细胞毒T淋巴细胞增加29倍,并在动物模型上对三阴性乳腺癌、黑色素瘤、结肠癌等多种肿瘤的生长具有很好的抑制作用。
该研究工作首次报道NDDS运载表观遗传药物并与免疫疗法相结合,克服免疫耐受,提高了表观遗传调控的特异性和免疫疗法的效果,具有显著的原创性和独特性:首先,由于表观遗传调节剂的靶点在体内普遍存在,游离形式的表观遗传调控药物往往具有系统性副作用(如骨髓抑制、中枢神经毒性等),OPEN显著提高了表观遗传治疗的特异性,增加了瘤内药物的富集,降低了药物副作用;其次,通过基因工程方法构建的T淋巴细胞膜过表达多种免疫检查点受体,在提高OPEN靶向性时,还降低IFN信号通路激活带来的免疫检查点上调产生的副作用;另外,OPEN可自动补充肿瘤细胞上PDL1等多种免疫检查点配体,避免其消耗引起的脱敏,使OPEN实现可持续特异性累积。该研究将表观遗传药物促进多种免疫检查点表达的副作用巧妙地转化为肿瘤特异性靶点,成功解决了表观遗传药物具有的两面性难题,是采用NDDS提高癌症免疫疗法效果和安全性的一个里程碑式新进展。
点评原文链接:https://doi.org/10.1007/s11426-021-1108-0
、
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn