

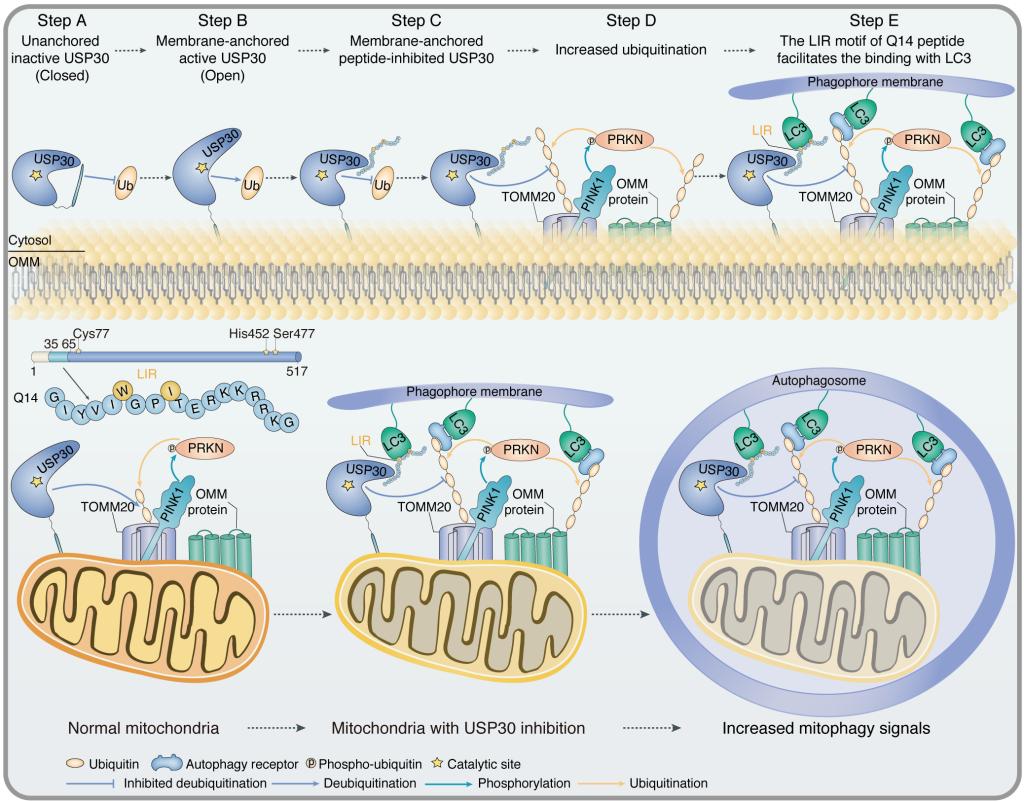
图示. 来自USP30跨膜域的多肽诱导线粒体自噬的分子机制
帕金森病是老龄人群的高发疾病,线粒体功能障碍与其密切相关。近年研究表明定位在线粒体外膜上的去泛素化酶USP30(Ubiquitin-specific protease 30,USP30)作为线粒体自噬负调节剂,拮抗线粒体自噬过程,造成功能异常的线粒体过度堆积,被认为是帕金森病的潜在治疗靶点。然而目前靶向USP30的抑制剂仅局限于较少的小分子类化合物,毒性、非特异性、尚不明确的作用机制等缺陷限制了它们的药物转化。因此,开发新颖有效的USP30抑制剂并深入研究其作用机制对帕金森病治疗具有重要意义。
近日,北京大学深圳研究生院/省部共建肿瘤化学基因组学国家重点实验室李子刚课题组与清华国际研究生院许乃寒课题组合作,在国际知名期刊《Autophagy》(中科院一区,IF=16.016),发表了题为“Identification of an autoinhibitory, mitophagy-inducing peptide derived from the transmembrane domain of USP30”的研究论文,首次发现源自USP30跨膜结构域的新颖多肽可直接靶向抑制USP30酶催化活性,并通过两种有趣且独特的机制诱导线粒体自噬。
研究人员对USP30的跨膜结构域进行了截短筛选及丙氨酸突变分析,确定了短而有效的Q14多肽抑制剂。Q14多肽可以轻松穿过细胞膜与线粒体锚定的USP30结合并抑制其去泛素化酶活性,降解线粒体蛋白,减弱线粒体融合来促进线粒体自噬。同时,研究人员通过化学交联环肽结合化学交联质谱技术鉴定了多肽抑制剂与USP30的潜在结合位点,并提出Q14多肽变构调节USP30指尖结构域抑制USP30酶活性的模型。此外,研究人员发现 Q14多肽通过其LIR(LC3 interaction region)结构域直接结合LC3,将USP30蛋白及线粒体连接到自噬膜,增强自噬小体的形成,协同促进线粒体自噬。
综上所述,本项研究提出了基于变构调节模式发现USP30抑制剂的新颖设计思路,揭示了USP30多肽抑制剂通过两种有趣的方式协同促进线粒体自噬的机制,为 USP30 或其他去泛素化酶 (DUB) 抑制剂的设计提供了新的见解和方向。
北京大学深圳研究生院秦璇博士为该论文的第一作者,北京大学深圳研究生院李子刚教授、清华国际研究生院许乃寒教授、深圳湾实验室坪山生物医药研发转化中心尹丰研究员为该论文的共同通讯作者。以上工作得到了国家科技部、国家自然科学基金、广东省自然科学基金、深圳市科技创新委员会及中国博后科学基金的支持。
论文链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2021.2022360
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn