

2022年1月6日,南方科技大学生物系、冷冻电镜中心研究教授王培毅团队联合中国科学院微生物研究所等单位在国际顶级学术期刊《细胞》(Cell)杂志在线发表了题为“Receptor binding and complex structures of human ACE2 to spike RBD from Omicron and Delta SARS-CoV-2”的研究论文,首次解析了新冠病毒两个关键突变株Omicron 和Delta RBD区(关键受体结合区)与人ACE2(hACE2)的复合物结构,阐明了其相互作用的分子机制。
王培毅和中国科学院微生物研究所高福院士、研究员齐建勋为论文共同通讯作者。中国科学院微生物研究所博士后韩鹏程、中国科学院微生物研究所博士生李霖杰、南方科技大学冷冻电镜中心博士后刘升、上海同步辐射光源研究员汪启胜和中国科学院大学与澳门大学联合培养博士生张弟为论文共同第一作者。我校生物系、冷冻电镜中心是第一作者和第一通讯单位。
新冠病毒突变株Omicron和Delta目前是世界卫生组织定义的五种“关切变异株(VOC)”中最重要的两种。Omicron已在128个国家和地区出现,因此引起了全球广泛关注,其突变株刺突S蛋白上最关键的受体结合域RBD携带高达15个氨基酸突变,涵盖了Alpha、Beta、Gamma突变株具备的所有特征。Delta变异株是迄今发现的最具传播性的新冠变异株。深入理解Omicron和Delta突变株的识别受体和入侵细胞的机制是疫苗和药物研发的关键基础。
研究团队首先通过流式细胞分析、表面等离子共振和假病毒入侵实验等定性、定量的研究方法,评估了五种VOC与hACE2的结合能力和假病毒感染能力。研究团队发现,与新冠病毒原型毒株(GISAD: EPI_ISL_402119)相比,Omicron 和Delta突变株的RBD与hACE2的结合能力没有明显变化。为进一步探明Omicron RBD 和Delta RBD 与hACE2相互作用的分子机制,研究团队解析了Omicron RBD/hACE2复合物的冷冻电镜结构(3.4 Å)和X-射线晶体结构(3.0 Å),同时还获得了Delta RBD/hACE2复合物的X-射线晶体结构(3.35 Å)(见图)。结构分析表明,Omicron RBD上的Q493R和Q498R的突变使其周围的相互作用网络发生了重排,K417N, G446S, E484A, G496S和 Y505H突变均削弱了Omicron RBD与hACE2的结合能力,N501Y的突变使其与hACE2上的Y41位形成 π-π相互作用而增强其与hACE2的亲和力。Delta RBD上的两个突变位点,L452R和T478K,从结构上看,两个位点不影响其与hACE2的结合,但是可能会影响抗体的结合,对部分现有抗体产生免疫逃逸。
本研究揭示了目前最受关注的两个新冠突变株Omicron和Delta的RBD与hACE2相互作用的分子机制,为疫苗研发和药物筛选奠定了分子基础。
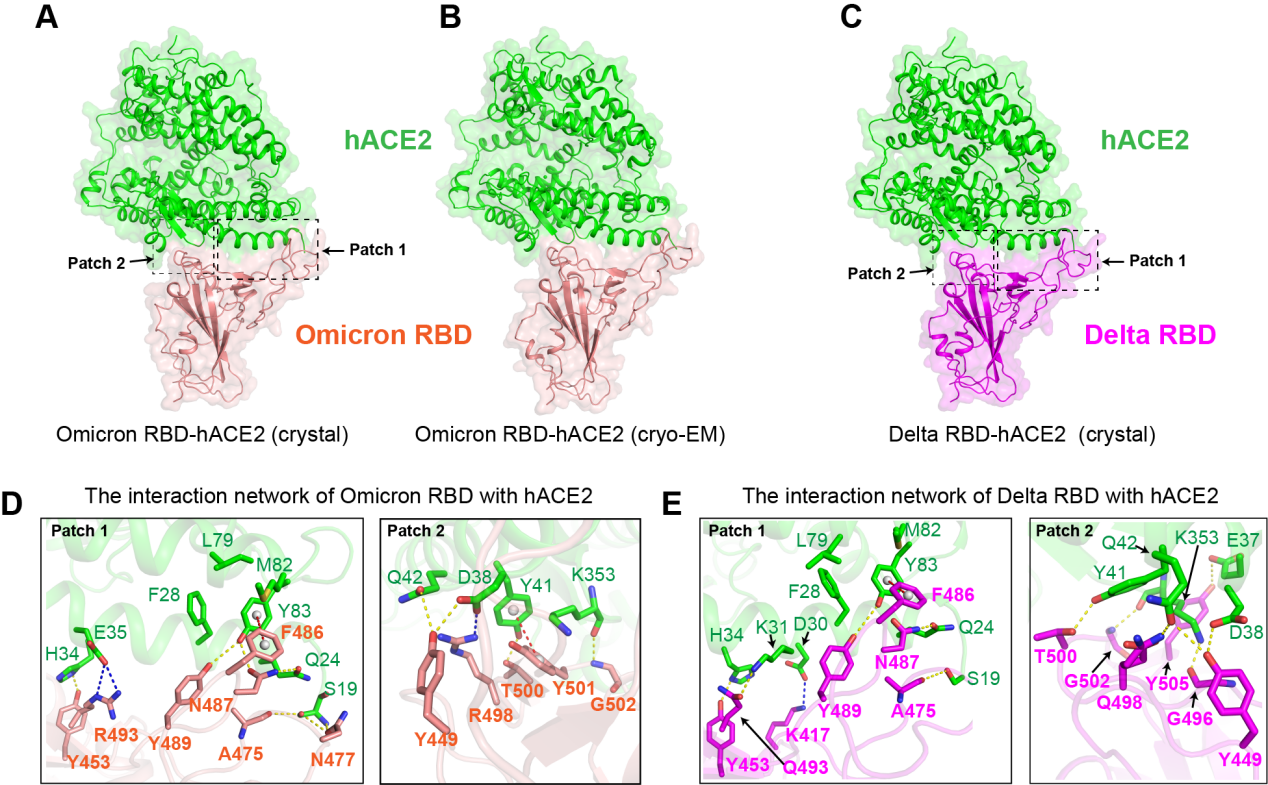
图1.Omicron RBD 和Delta RBD与hACE2复合物结构
该研究得到了科技部国家重点研发计划、深圳市科技创新委员会基金、南方科技大学校长卓越博士后等项目的资助。该研究主要数据收集和处理工作均在南方科技大学冷冻电镜中心完成,并得到南科大生物系和冷冻电镜中心多位老师的大力支持。
论文链接:https://doi.org/10.1016/j.cell.2022.01.001
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn