

细胞是构成生命的基本单元,发展适用于活细胞的生物正交反应、并由此开发活细胞原位研究的化学技术已成为化学与生命科学交叉融合的研究前沿。生物正交反应是指可以在生命体系中进行、且不会与生命过程相互干扰的一类化学反应。生物正交反应为研究者对生命进程的研究带来了革命性的技术,同时也为医学研究、临床诊断、新药研发等提供了开创性方法,已成为化学生物学领域的核心方向之一。北京大学化学与分子工程学院陈鹏/樊新元课题组长期致力于活细胞化学反应的开发与应用研究,突破了在活细胞内研究蛋白质的技术瓶颈,开拓了生物正交反应和应用的新方向。近期,该实验室进一步拓展活细胞化学反应的应用前沿与边界,在细胞凋亡的生物正交调控、细胞相互作用的原位-实时捕获以及新冠病毒表面的“共价反应”抗体等方向取得了系列进展。
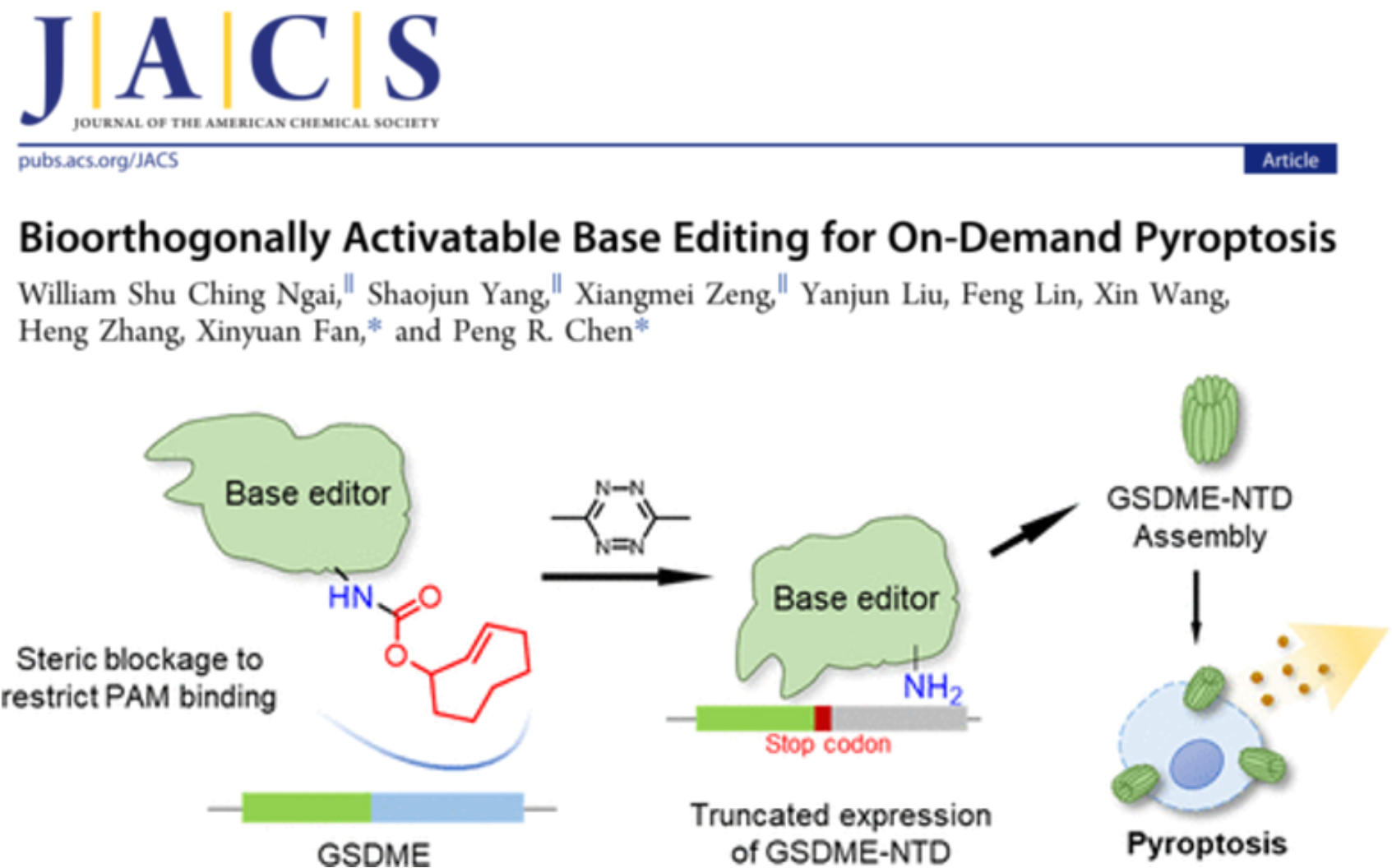
图1. 基于生物正交脱笼反应的BaseBAC技术,可原位、实时触发细胞焦亡 (J. Am. Chem. Soc. 2022, DOI: 10.1021/jacs.1c12924)
细胞焦亡是由gasdermin(GSDM)家族蛋白在经过蛋白酶剪切C端结构域后,其N端结构域释放并在细胞膜上寡聚打孔而产生的一种细胞死亡方式。如何实现可控的细胞焦亡是进一步研究这一死亡类型的分子机制,拓展其在肿瘤等疾病治疗领域应用的关键问题。然而,GSDM 的N端结构域具有很强的毒性,很难在细胞内直接表达和调控。近年来,研究人员通过在半催化失活的nCas9上融合胞嘧啶脱氨酶(APOBEC1),开发出了可以对目标碱基进行从C到T转化的胞嘧啶碱基编辑器(CBE)。陈鹏/樊新元课题组报导了利用该碱基编辑器在开放阅读框中实时引入终止密码子的技术BaseBAC(图1),可通过限制C端结构域的表达,实现目标蛋白质N端“截短体”的原位、实时表达,并激活细胞焦亡通路。这一基于生物正交剪切反应技术,依赖于其nCas9结构域识别PAM序列并进行底物序列的查验。因此,作者在他们前期开发的蛋白质脱笼技术的基础上,进一步将IEDDA生物正交剪切反应拓展到蛋白质和DNA结合的化学调控,通过调控dCas9与PAM序列结合来调控CBE引入终止密码子,进而通过生成GSDME的N端蛋白触发细胞焦亡。该体系在活细胞和活体小鼠中均展示出了优异的兼容性和调控能力。由于该技术针对Cas9与底物DNA的结合调控而开发,理论上适用于各种Cas9衍生的基因编辑工具,包括Adenosine Base Editor以及Prime Editor等。另一方面,细胞中含有多种在表达时为自抑制状态的基因,其功能亦可以通过编程BaseBAC而进行原位、特异激活。此外,IEDDA反应具有良好的生物兼容性,使其能应用于多种生物学研究场景,具有广阔的应用前景。
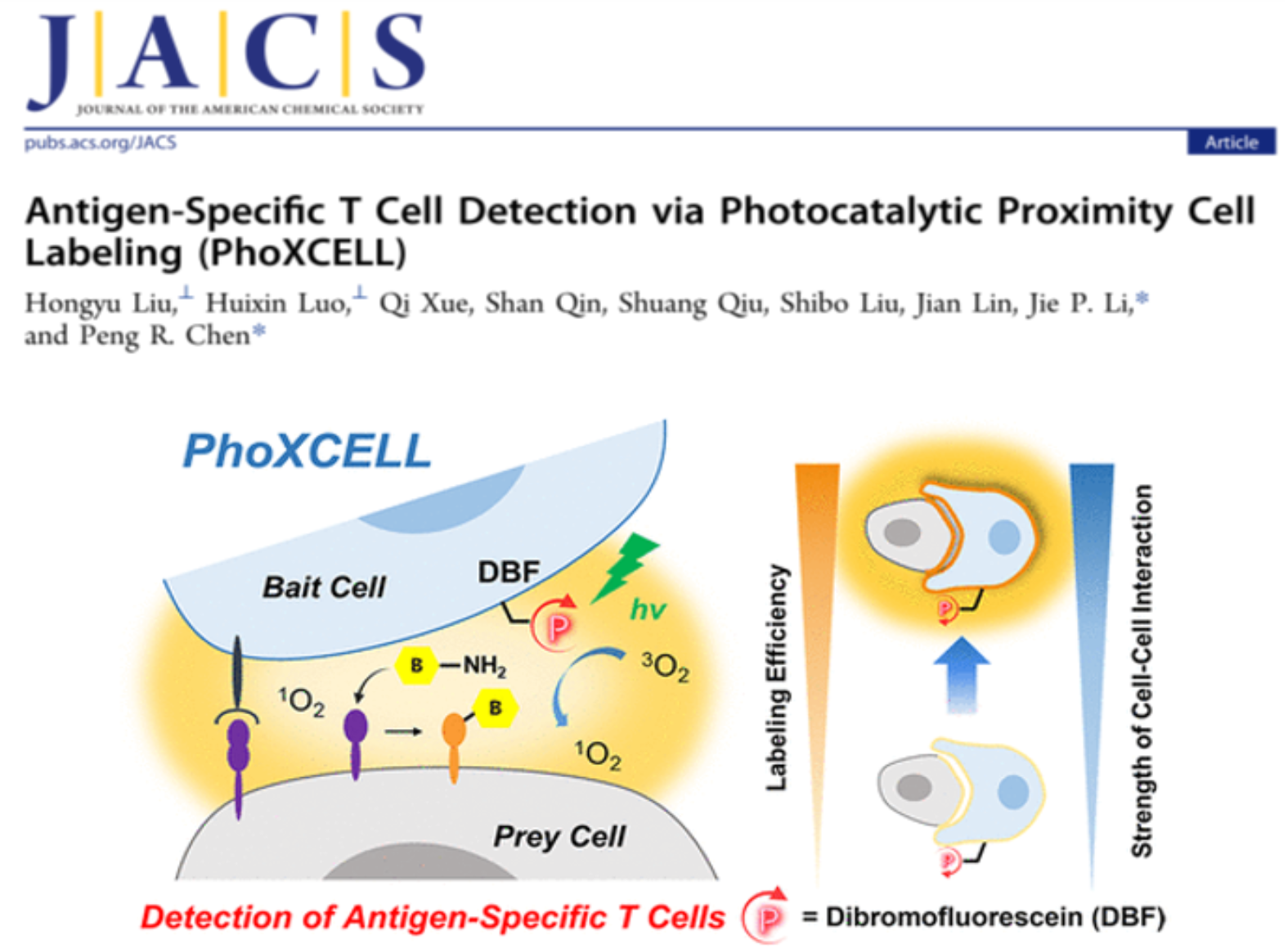
图2. 基于生物正交光催化反应的PhoXCELL技术,可实现细胞-细胞相互作用的原位捕获和定量鉴定(J. Am. Chem. Soc. 2022, DOI: 10.1021/jacs.2c00159)
细胞-细胞相互作用是生命过程中最基本的信息传递方式之一,尤其在免疫、神经等系统的生理过程中承担着重要的角色。发展研究细胞-细胞相互作用的工具可以帮助免疫学家更好地研究免疫过程、调控细胞治疗方法。然而,目前的工具都基于邻近标记酶,缺乏时空可控性,且通常需要对免疫细胞(或小鼠)进行基因改造,技术门槛较高。此外,这些工具对细胞间相互作用的定量研究尚处于起步阶段。陈鹏课题组与南京大学李劼课题组合作,发展了一种快速、高效鉴定细胞-细胞相互作用的定量工具PhoXCELL(Photocatalytic proXimity CELl Labeling, 图2)。该技术基于光催化的小分子邻近标记工具DBF(dibromofluorescein),通过光催化产生单线态氧触发标记反应,可以在T细胞与树突状细胞(DC)的相互作用中,实现对抗原特异性T细胞的精确捕获。具体来说,PhoXCELL可以时空特异地捕获抗原特异性T细胞;同时,PhoXCELL还可以定量评价细胞-细胞间的相互作用,并能在肿瘤和癌旁淋巴结中同时捕获肿瘤抗原特异性CD8+和CD4+ T细胞。作者利用PhoXCELL技术在小鼠三阴性乳腺癌模型E0771中捕获肿瘤相关抗原特异性T细胞。通过将DBF展示在吞噬并递呈有肿瘤抗原的DC上,成功的在肿瘤浸润淋巴细胞和癌旁淋巴结中同时捕获到了肿瘤抗原特异性CD8+和CD4+ T细胞。被捕获到的细胞均高表达PD-1和CD39,且ELISPOT实验进一步证明,这群细胞的确可以特异性识别肿瘤相关抗原。
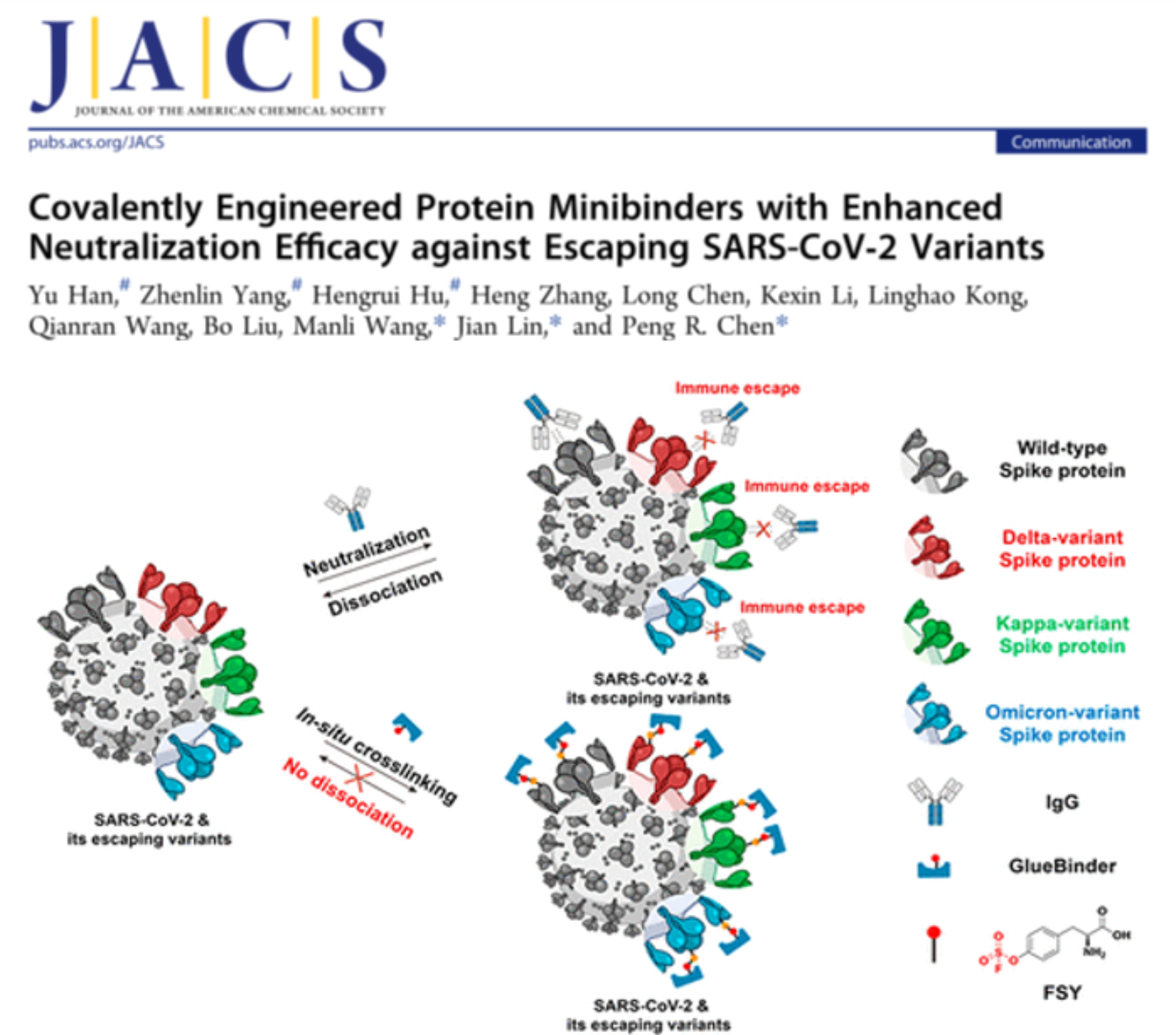
图3. 基于邻近化学交联反应的GlueBinder技术,可用于防止新冠病毒突变产生的抗体逃逸 (J. Am. Chem. Soc. 2022, DOI: 10.1021/jacs.1c11554)
自2019年底新冠病毒疫情爆发以来,靶向新冠病毒受体结合域(RBD)并阻断其与人体血管紧张素转化酶2(ACE2)相互作用的中和抗体得到了广泛关注与应用。但是新冠病毒的变异速度之快,使得逃逸突变不断累积,众多基于阻断RBD-ACE2结合的中和抗体减弱或丧失了阻断能力。因此,面对层出不穷的新冠病毒突变株,开发抵抗病毒逃逸的广谱型中和试剂迫在眉睫。陈鹏/林坚团队与中国科学院武汉病毒研究所王曼丽团队合作,通过向抗体类“中和试剂”引入可进行“邻近化学反应”的非天然氨基酸,实现了其与活病毒表面靶标蛋白的共价交联反应,并展现了这一“共价化学”策略在抵抗新冠病毒突变逃逸方面的潜力。共价蛋白中和试剂(GlueBinder)与新冠病毒刺突S蛋白通过在结合界面原位发生的邻近化学反应,将可逆的抗原-抗体结合转化为不可逆的共价连接,实现了对野生型,Delta,Kappa以及Omicron等突变亚型RBD蛋白的交联,最终恢复了蛋白中和试剂对Delta变体活病毒的中和能力(图3)。体外竞争ELISA和活病毒中和实验都证明GlueBinder对新冠病毒逃逸突变株具有更强的阻断能力,这对恢复现有中和抗体的抗病毒作用具有借鉴意义。值得注意的是,共价改造策略针对全球大流行的Delta,Omicron等突变株都能够保持高效交联效果,体现了这一策略在抵抗病毒突变的通用性,为抗击新冠病毒提供了新思路。
北京大学化学与分子工程学院博士生魏书程、杨绍军、博士后曾祥梅;博士生刘宏宇、博士后罗惠新;博士生韩雨、杨振霖和中国科学院武汉病毒研究所博士生胡恒睿分别为上述论文的共同第一作者。该系列工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心、生物有机与分子工程教育部重点实验室以及北大-清华生命科学联合中心的资助。
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.1c12924
https://pubs.acs.org/doi/10.1021/jacs.2c00159
https://pubs.acs.org/doi/10.1021/jacs.1c11554
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn