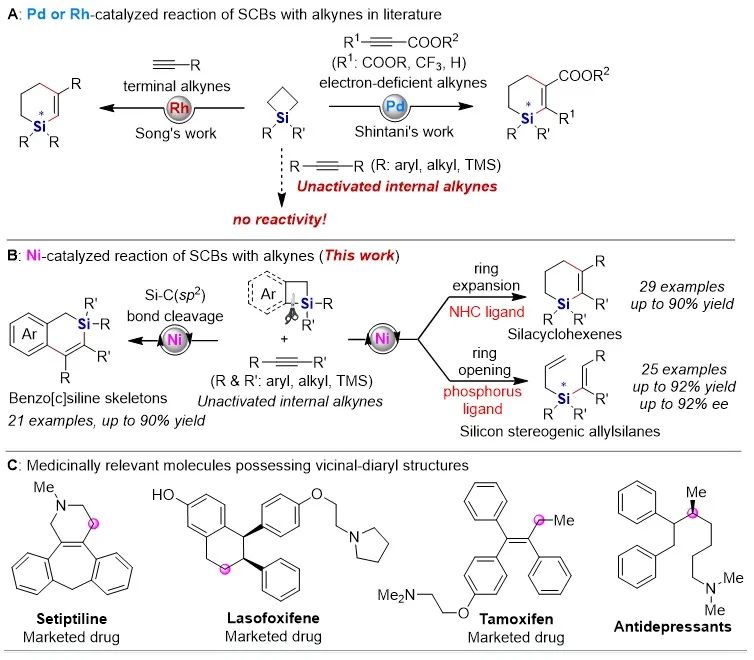
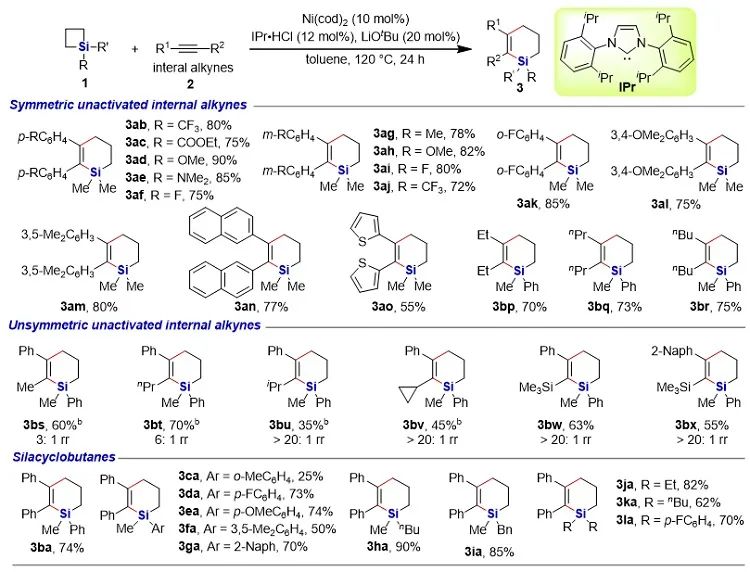
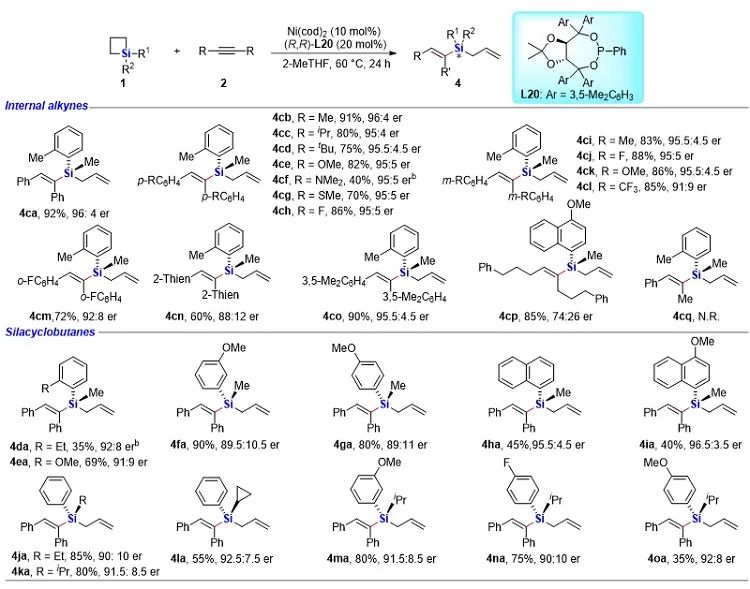
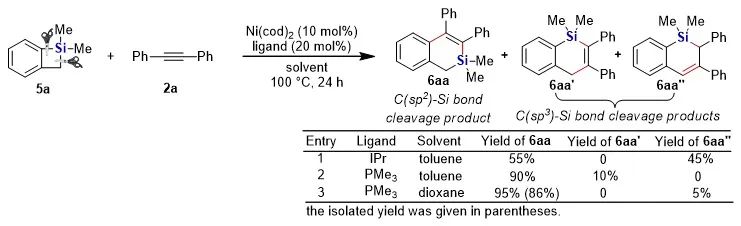
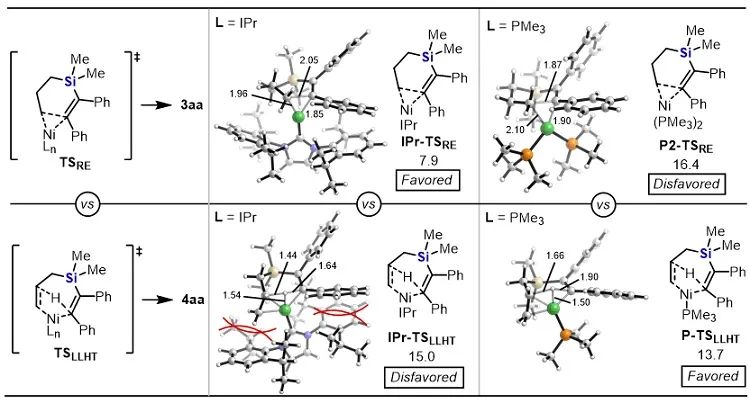
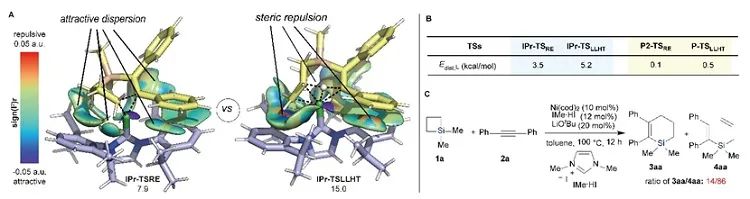
有机硅化合物在有机合成、材料科学、生物医药研究中都有着广泛的应用,开发新的硅基合成子以及发展绿色高效的合成方法对推动有机硅化学的发展具有重要意义。近年来,硅杂环丁烷 (SCB) 作为合成子引起了广泛关注,被应用于许多有机硅化合物的高效合成。其中过渡金属催化下SCB与炔烃的环加成反应是最活跃的研究方向之一,并且取得了一定的进展,但仍然存在三个方面的局限性(图1A):(1) 反应主要使用钯或者铑等贵金属催化剂;(2) 活性较低的非活化内炔与SCB的反应尚未有报道;(3) 不对称反应中对映选择性控制还有提升空间。近日,南开大学赵东兵课题组通过镍催化实现了非活化内炔与(苯并)硅杂环丁烷之间的反应,并且通过不同的配体实现了反应化学选择性、区域选择性以及对映选择性的精准调控(图1B)。图1. 硅杂环丁烷与炔烃的反应现状以及邻二芳基骨架在药物中的应用作者首先利用硅杂环丁烷与二苯乙炔作为模板底物进行了条件筛选。他们发现,在10 mol% Ni(cod)2及12 mol% IPr的作用下,利用甲苯作溶剂时,在120 ℃条件下,环加成反应能够顺利进行,并以84%的分离收率得到单一产物硅杂环己烯。该催化体系具有良好的底物普适性(图2),无论是对称的二芳基炔烃还是二烷基炔烃都能兼容,以中等至较高的收率得到硅杂环己烯衍生物。不对称的内炔如1-苯基-1-烷基炔以及1-芳基2-三甲硅基炔烃与硅杂环丁烷的环加成反应也能够顺利进行,并以中等的收率和中等至优异的区域选择性形成环加成产物。与之对应的是,作者发现,当使用三甲基膦作配体时,硅杂环丁烷与二苯乙炔反应生成开环产物烯基硅烯。随后作者通过大量的手性配体筛选,发现使用Taddol衍生的手性亚磷酸酯配体可以实现开环反应的化学选择性和立体选择性控制,最终以优异的对映选择性得到了具有硅手性中心的烯基硅烷衍生物(图3)。在最优反应条件下,作者对内炔底物的适用性进行了考察,结果表明1,2-二芳基乙炔底物能够很好的兼容,无论芳环上含有吸电子取代基还是供电子取代基,大部分反应都可以顺利进行并且以中等至良好的产率 (40-92%) 和优异的对映选择性(up to 96:4 er)生成目标产物。1,2-二烷基炔烃与硅杂环丁烷的不对称开环反应虽然也能顺利进行,但是反应对映选择性降低较为明显。催化体系对于不对称的1-苯基-1-烷基炔烃不能适用。该不对称催化体系对于硅基上带有不同位阻和电子效应的硅杂环丁烷底物也能够很好的适用。与硅杂环丁烷相比,苯并硅杂环丁烷结构中同时含有C(sp2)-Si键和C(sp3)-Si键,苯并硅杂环丁烷与炔烃的反应往往遭遇区域选择性问题。本文中,作者通过对配体和溶剂的筛选,最终在小位阻的三甲基膦配体的条件下,以高的区域选择性得到选择性断裂苯并硅杂环丁烷C(sp2)-Si键的产物6aa。催化体系同样适用于二芳基炔、二烷基炔以及不对称内炔底物(图4)。在完成底物扩展之后, 作者分别对硅杂环己烯产物和手性烯基硅烷产物进行了一系列的衍生化反应。随后,作者对不同配体控制的SCB与炔之间的发散性反应的根源通过DFT计算以及一系列控制实现进行了研究(图5),结果显示,当合用IPr作为配体时,中间体倾向于发生还原消除,而使用小位阻的磷配体时,中间体则倾向于发生LLHT过程,从而生成开环产物。最后,对其关键中间体进行了可视化分析,认为不同配体条件下硅杂环丁烷与内炔反应的化学选择性主要来源于配体的位阻影响。 综上所述,赵东兵课题组开发了以廉价金属镍为核心的催化剂,通过配体的调控实现了硅杂环丁烷与非活化内炔分子间的化学选择性的环加成反应和对映选择性的开环反应,以及内炔对苯并硅杂环丁烷 C(sp2)-Si 键高度选择性的插入反应等三类新反应,合成出多个系列硅杂环己烯衍生物和具有硅手性中心的烯基硅衍生物。另外对产物进行了一系列的衍生化反应,并且通过密度泛函理论计算对不同配体下化学选择性差异的原因提出了合理解释。该研究成果近期发表在Nature Communications 上,论文通讯作者为南开大学赵东兵研究员,第一作者为博士研究生王希超,李勃和鞠成威对本文的计算和实验做了重要贡献。该项研究得到了国家自然科学基金面上项目以及国家自然科学优秀青年基金的支持。
原文
Nickel(0)-catalyzed divergent reactions of silacyclobutanes with internal alkynes
Xi-Chao Wang, Bo Li, Cheng-Wei Ju & Dongbing Zhao
Nat. Commun., 2022, 13, 3392, DOI: 10.1038/s41467-022-31006-y
参考资料:https://chem.nankai.edu.cn/2022/0630/c24075a460600/page.htm