

吡啶广泛存在于具有生物活性的相关分子中,并且它们的优势来自杂环的内在性质和取代基的相互作用。因此,吡啶分子的区域选择性C-H卤化反应是至关重要的,因为引入的碳-卤(C-Hal)键可以发生许多后续成键反应(Fig.1A)。在药物和农业化学研究中,卤代吡啶是用于构-效关系研究和靶向合成的候选化合物多样化的关键中间体,并且其在生物活性化合物如艾托考昔中也具有内在的价值。然而,尽管早在19世纪晚期就有关于吡啶卤化反应的报道,但该反应仍然有很大的局限性,尤其是,对于具有生物活性的一些底物中的官能团不兼容。由于电性不匹配的原因,使用亲电芳香取代的吡啶卤化反应往往需要较为苛刻的条件。具体来说,由于使用的最初的卤源往往具有较强的Brønsted 或者 Lewis酸性,为了弥补吡啶环上较差的π 亲核性,需要提高温度来实现卤化反应,进而缩窄了底物范围,同时还得到多种区域选择性混合物。金属化-卤化策略是另外一种吡啶卤化的方法,但这种方法往往需要导向基团。除了这两种方法之外,在过去的一个世纪里几乎没有什么进展,所以合成界转向其它多功能的官能团来代替卤化物。值得注意的是,金属铱催化的硼化或者硅烷基化反应,而该类反应C-3位选择性往往是通过选择特定的一类吡啶分子或者配体的调控。这里,作者提出了吡啶卤化的替代方法,通过吡啶的开环、卤化、闭环策略(Fig. 1B)。这种“一锅”方案使用了经典的Zincke开环反应的改进版本,将吡啶转化为氮杂三烯中间体,或“Zincke亚胺”。这种合成策略暂时将吡啶从缺电子的杂环转化为一系列发生亲电取代反应的极化烯烃,就像富电子的芳烃一样。
当前的Zincke开环的方法不能实现Fig 1B中描述的吡啶卤化的反应过程。吡啶N-活化步骤通常需要特定条件,并且当2-位取代基存在时经常失败。为了解决这些限制,作者着眼于NTf-吡啶盐的开环。这些活性中间体很容易在低温下由吡啶和Tf2O形成,并且包括除2,6-二取代以外的大多数取代类型。Toscano等人报道了通过Tf2O实现开环,但没有将这一过程扩展到除吡啶以外的底物,并观察到开环产物的混合物。用2-苯基吡啶(1)作为模板底物,作者考查了一系列作为亲核试剂的脂肪胺(Fig. 1C)。吡咯烷、哌啶和吗啉可以得到中等产率的开环产物,二异丁胺也是如此(2-5)。然而,最后证明二苄胺6是最佳的,并以高产率(86%)得到Zincke亚胺。之后,作者期望能够直接实现Zincke 盐的关环反应,然而,实例通常使用铵盐或Brønsted酸来获得吡啶,这些试剂可能有助于实现Fig 1B中描述的一锅反应。
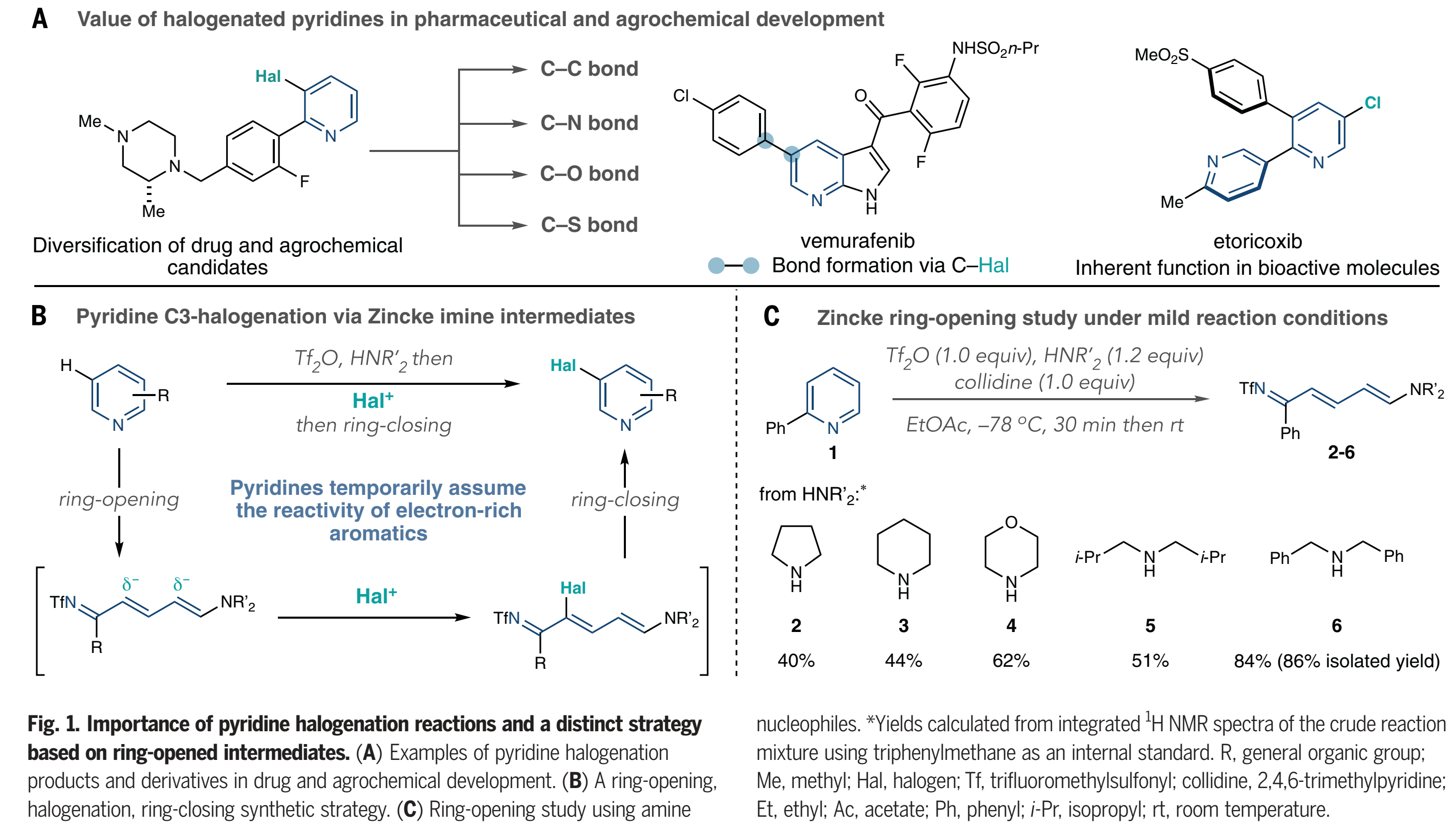
(图片来源:Science)
对于反应发展的下一阶段,作者使用卤素亲电试剂测试了Zincke亚胺6 (Fig. 2A)。一开始,作者没有预料到碳卤键的形成会是选择性的,因为在6中C3和C5的两个δ-位点之间没有明显的电性差异。Toscano等人确实观察到了未取代的NTf-Zincke亚胺和吡啶鎓亲电试剂之间的3-选择性反应;然而,他们没有研究由取代的吡啶衍生的Zincke亚胺。当作者在室温下将6与N-碘代琥珀酰亚胺(NIS)反应5分钟时,通过氢谱他们得到92%的7-I产物和 > 20:1的 3-对5-选择性(8-I)。当使用N-溴代丁二酰亚胺(NBS),作者在室温下观察到7-Br和8-Br的比例为4.4:1,而在-78 °C的二氯甲烷中7-Br的产率为92%, 选择性大于20:1。然而当作者用氯化琥珀酰亚胺(NCS)时,氯化产率较低且选择性较低(7-Cl和8-Cl ),并且它容易降解6。随后,作者尝试了关环的条件,发现在60 ℃下,在EtOAc/EtOH溶剂混合物中加入8-I和10当量的乙酸铵可以很好地形成3-碘吡啶9-I。卤化3-取代的亚胺(Fig 2B)需要不同的条件:3-苯基吡啶开环得到Zincke亚胺10,但是NIS在室温下无法与10反应,并且当加热到50 ℃时分解成未知的副产物。然而,当作者加入两当量的三氟乙酸(TFA)时,反应可以有效的进行,并高收率得到碘吡啶12-I。作者将这种原位再芳构化归因于11-I中3-和5-取代基之间的空间相互作用;TFA可以促进烯烃异构化-环化过程,随后的二苄胺的消除以及所得NTf-吡啶盐的N-S键的断裂,最终重新形成吡啶环。用NBS和TFA (12-Br)溴化可以得到相同的结果,并且使用NCS和HCl在二氯甲烷中氯化10可以有效地生成12-Cl。这些结果(Fig 2,A和B)提供了NTf-Zincke亚胺中间体的两种卤化方案,这取决于它们的取代方式。
接下来,作者将开环、卤化和关环步骤合并,并实现一锅法(Fig. 2C)。对于没有3-位取代基的吡啶,例如2-苯基吡啶,需要使用二苄胺开环并用NIS或NBS进行卤化 (Fig 2A),之后向反应混合物中加入NH4OAc和EtOH,并加热至60 ℃诱导关环,重新形成吡啶9-I和9-Br。在卤化步骤后加入1当量的三甲氧基苯可以证明有助于在环化前淬灭任何残留的N-卤代琥珀酰亚胺。当存在3-位取代基时,例如在3-苯基吡啶中,开环,然后加入N-卤代琥珀酰亚胺和酸,如Fig 2B所示,包括一锅法(12-I,12-Br和12-Cl)。这些方案不需要中间处理或纯化步骤,并且不涉及向同一反应容器中按顺序加入试剂。
然后,作者用量子化学在B3LYP-D3(BJ)/de F2-TZVP//ωB97X-D/6-31+G(d, p)理论水平上研究了N-卤代琥珀酰亚胺卤化Zincke亚胺的反应机理和区域选择性。对于卤代6(Fig 2D),NBn2部分简化为NMe2,最有利的途径由亲电加成(TS-I)和随后的去质子化(TS-II)组成。计算表明外球电子转移过程能量不利 (ΔG > 34 kcal mol-1)。亲电卤代反应中的区域选择性通常被理解为前线轨道系数、原子电荷或亲核性参数的差异。然而,Zincke亚胺6的C3和C5位置的电子环境在Fukui f系数(0.24 vs 0.25)、自然电荷(–0.39 vs –0.44)和HOMO系数(均为0.26)方面非常相似,这就为这种转化中的高水平C3选择性提供了另一种基本原理(Fig 2E)。6与NCS、NBS和NIS反应的计算能量图(Fig 2D)表明,在每种情况下,总反应的不可逆是由动力学控制的区域选择性所调控,ΔΔG‡值与实验结果一致。打破Zincke亚胺中的延伸共轭以形成带正电荷的s-络合物Int-I是吸热的: C-Cl、C-Br和C-I形成的这种高能中间体的Grel值分别增加(分别为9.0、13.7和19.7 kcal mol-1)。这些差异产生了两种不同的选择性决定机制:不可逆的C–Hal键形成步骤(TS-I)决定了氯化和溴化的区域选择性,而C–I键形成是可逆的,第二个去质子化步骤(TS-II)决定了区域选择性。C3选择性溴化高于氯化(ΔΔG‡分别为2.5和0.4 kcal mol-1),这可以根据早期和晚期过渡态的论点来理解。考虑到Zincke亚胺中C3和C5位置之间的电子相似性以及不存在明显的分子间非共价相互作用,在早期氯化TS中几乎没有优先的区域异构体。溴化通过较晚的TS进行,这导致较大的底物扭曲,并强烈倾向于在C3位置(ΔΔEdist = 4.6 kcal mol−1)。这种畸变能的差异反映了在TS-I-C3-NBS中与TS-I-C5-NBS(ΔΔG‡ = 2.6 kcal mol-1)相比,α,β-不饱和亚胺离子的生成更加稳定。相比之下,碘化作用的高区域选择性(ΔΔG‡ = 3.4 kcal mol-1)来自决定速率和选择性的脱质子化作用(TS-II)。恢复TS-II- C5-NIS的平面性导致烯胺碳取代基和碘化物之间的A1,3张力增加(Fig. 2F)。
分子间竞争实验验证了这些计算预测(Fig. 2G)。作者分别使用1当量的6和[2H]-6进行反应,直到混合物消耗1当量的NIS。在反应结束时测得的2.70的[2H]-6/6比例,表明6被优先消耗,并支持理论预测的决定选择性的去质子化过程(Fig. 2F)。在相同条件下使用NBS,在反应结束时没有显示出[2H]-6和6之间的显著差异,这与决定选择性C-Br键形成一致。
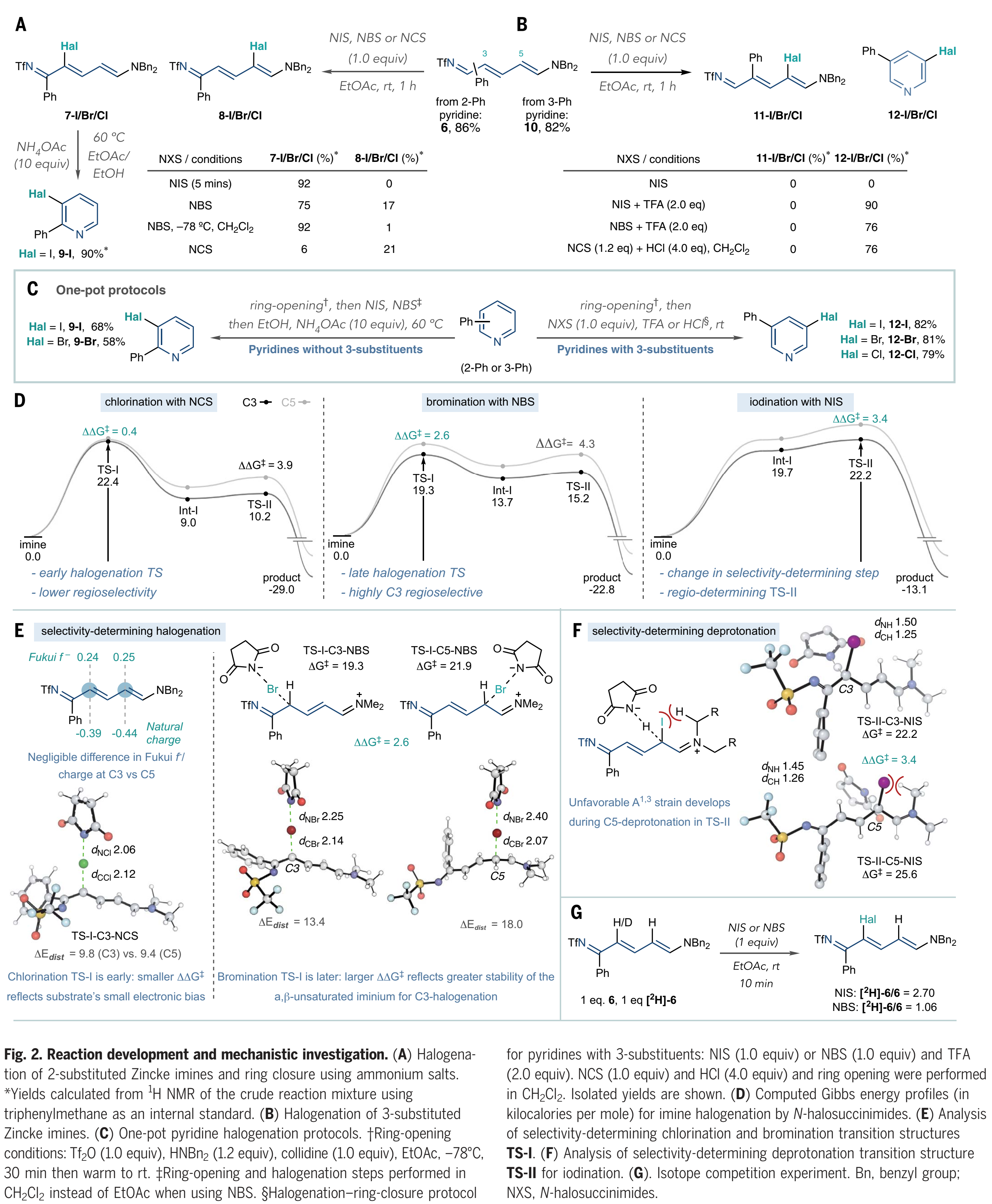
(图片来源:Science)
接下来,作者对底物范围进行考察(Fig. 3)。该方法适用于在2-位具有芳基、烷基和缩醛取代基的吡啶(13-17),并且在酸介导的条件下,一系列吡啶(18-21)也可以很好地转化。在4-位具有苄基、氰基和酮取代基的吡啶也可以有效的兼容(22-25)。然后作者实现了一系列2,3-,2,4-和2,5-二取代吡啶的卤化(26-34);卤代吡啶32-34表明Zincke亚胺中间体优先发生并保持了3-位选择性;作者从3,4-二取代体系(35-37)形成了一组二卤代和三卤代吡啶,当使用5-硝基异喹啉作为底物时,作者没有观察到开环产物,而是分离出一种去芳构化的二苄胺加成到NTf-异喹啉盐的C1上的加合物。将该中间体进行NBS处理,然后进行TFA处理,得到4-溴化产物41;作者使用5-氮杂吲哚作为底物观察到类似的中间体,得到溴化物42。接下来,作者测试了卤化Zincke亚胺中间体是否能胜过邻近的富电子芳环,以及二卤化过程是否可行。如Fig. 3所示,吡啶被选择性碘化而非苯甲醚基团(44),除了起始原料之外,在粗1H NMR中仅观察到痕量的其它化合物证明了这一点;类似地,在噻吩、呋喃和苯氧基存在下,吡啶优先被碘化(45到48);此外,稠环系统中碘化作用选择性地发生在吡啶上,如呋喃吡啶、受保护的氮杂吲哚和噻吩并吡啶(49-51)。
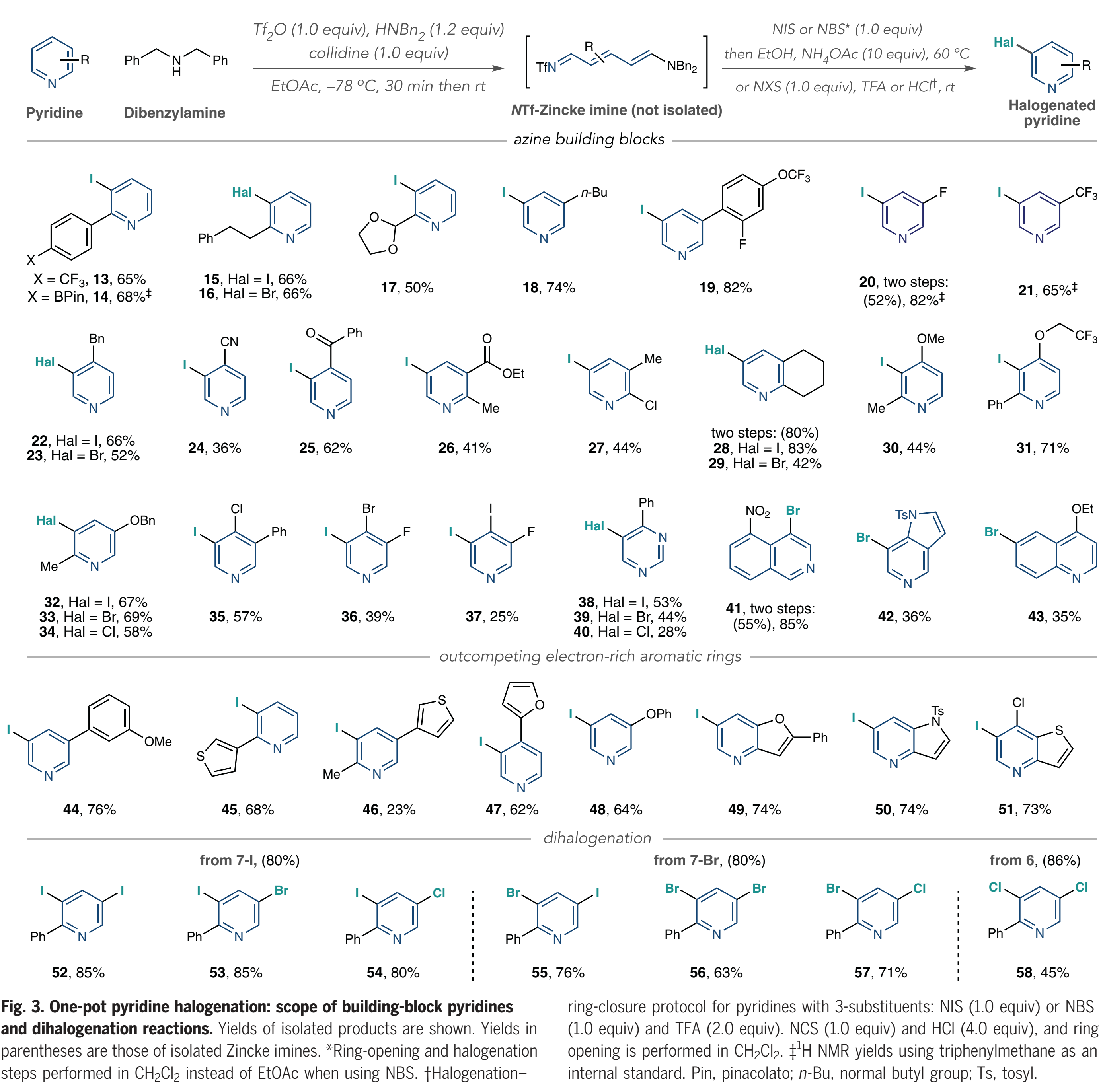
(图片来源:Science)
这项研究的最后阶段作者侧重于卤化复杂的类药物中间体、药物和农用化学品(Fig. 4). 这些结构通常含有多个(杂)芳烃、反应位点和路易斯碱性原子,因此具有一定的挑战性;作者首先对药物样中间体的五种多环结构进行卤化并获得了单一的卤化产物(59-65);此外,含有环磺内酰胺的取代喹啉在C6位上再次被溴化(66);值得注意的是卤代吡啶67到70,因为C-Hal键的形成发生在一个吡啶上而不是另一个吡啶上;作者认为,这种选择性是由于在每种情况下只形成了包含较少位阻杂环的NTf-吡啶鎓盐;吡啶71和72在一锅卤化过程中形成了阻转异构体,为进一步研究轴手性提供了可能。此外,作者对维莫德吉、比沙可啶等各种药物进行了后期碘化(73-75);在一锅法中,氯雷他定的后期修饰具有一定的挑战,但是当作者分离中间体Zincke亚胺(76-78)时,可以合成碘代、溴代和氯代类似物。尼古丁、Boc-保护的尼普拉嗪、依托考昔以及喹氧灵都可以很好地被修饰(79-83)。
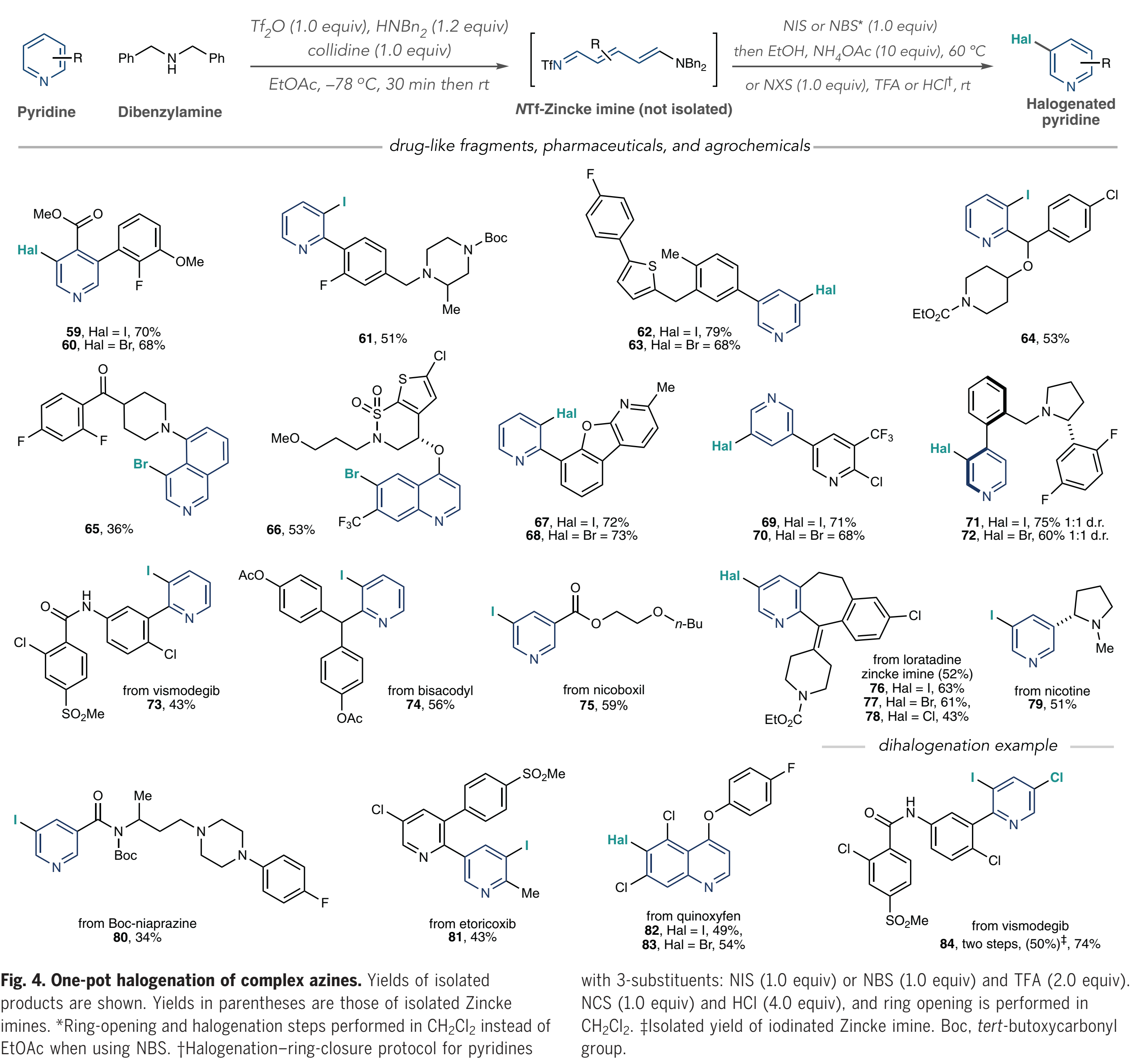
(图片来源:Science)
总结 美国科罗拉多州立大学Andrew McNally和Robert S. Paton课题组通过Zincke亚胺中间体实现了吡啶间位选择性C–H卤化。该策略经历了吡啶开环、卤化和关环的反应历程,为复杂活性分子、药物以及农用化学品的后期修饰提供了新的替代方法。因此,该方法可以广泛应用于药物和农业化学研究领域。此外,这种吡啶官能团化的方法也可能适用于其它化学键的构建。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn