

环丁烷结构广泛存在于具有显著生物活性的天然产物中,引入这种小环是制备生物活性分子的有力策略。但是在现有的报道中,很难实现对环丁烷上多个立体中心的构建,这可能是由于缺乏立体控制合成方法造成的。不对称制备四元环最常用的策略是[2+2]环加成和骨架重排(即环的扩张或收缩),但对已有的环丁烷或环丁烯进行不对称官能团化还有待发展。
图1. 含环丁烷结构的生物活性分子(图片来源:Angew. Chem. Int. Ed.)
Tortosa课题组报道了铜催化的去对称化反应实现了环丁基硼酸盐的不对称合成。这种方法可以生成1,2,3-三取代环丁烷,很容易地进行进一步的修饰。该课题组还报道了不对称Pt-催化螺环环丁烯的二硼化反应和Cu-催化螺环环丁烯的单硼化反应生成非手性三取代螺环丁烷。Buchwald课题组开发了CuH催化的1-取代环丁烯不对称氢胺化反应,得到对映体富集的反式-1,2-二取代氨基环丁烷,Rh-催化的环丁烯不对称氢酰化也有报道,这两个反应都被认为经过了一个关键的不对称氢金属化过程。
α,β-不饱和酮的1,4-加成是
作者此前报道了一系列环丁烯的不对称芳基化,这些芳基化通过一个共同的不对称碳金属化步骤进行初始碳硼化后,经过不同的反应途径(取决于环上的取代基和反应条件)可以产生各种不同的产物。对于某些底物,作者观察到β-氢消除途径紧随氢金属化,这一过程可被用于产生远程消除反应。作为本研究的一部分,作者还观察到具有螺环的环丁烯在3位发生了区域选择性还原型Heck反应,生成非手性环丁烷。
Rh-促进β-杂原子消除的能力使作者考虑如何打破螺环环丁烯的对称性。作者特别想知道含有螺环缩酮的环丁烯是否会发生高度区域和
图2. 研究背景(图片来源:Angew. Chem. Int. Ed.)
首先,作者以1a为模型底物进行了底物筛选。最终发现当反应体系组成为2a(2当量)、CsOH(1当量)、[RhCl(coe)2]2(2.5% mol)、L1(6.0% mol)和THF(0.2 M)作溶剂时反应效果最佳,产率为85%,ee为95%。
图3. 条件筛选(图片来源:Angew. Chem. Int. Ed.)
随后,作者进行了底物拓展。首先是对芳基硼酸酯适用范围的探索,间位和对位取代的硼酸酯都能以理想的产率和ee值得到对应的烯醇产物,且官能团兼容性较好,如卤素 (3ac, 3ai, 3aj-l, 3am, 3aq),烷氧(硫)基(3ab, 3af, 3as),乙酰基和酯基(3ag, 3at),氨基甲酸保护的胺基(3ar)和硅基(3ap),产率为75%-93%,ee值为91%-98%。邻位取代硼酸在过渡金属催化的1,4-加成反应中往往极具挑战性,通常具有较低的产率和对映选择性。在该反应中,2-氟苯硼酸可以得到良好的结果(3am, 产率53%,93% ee),空间位阻更大的2-甲基苯硼酸ee只有58%,但使用配体L4时对映体选择性可提高到70% ee (3ao)。作者又对乙烯硼酸进行测试,相应产物虽然产率尚可,但ee较低。另外,杂芳基硼酸并不适用于这一体系。
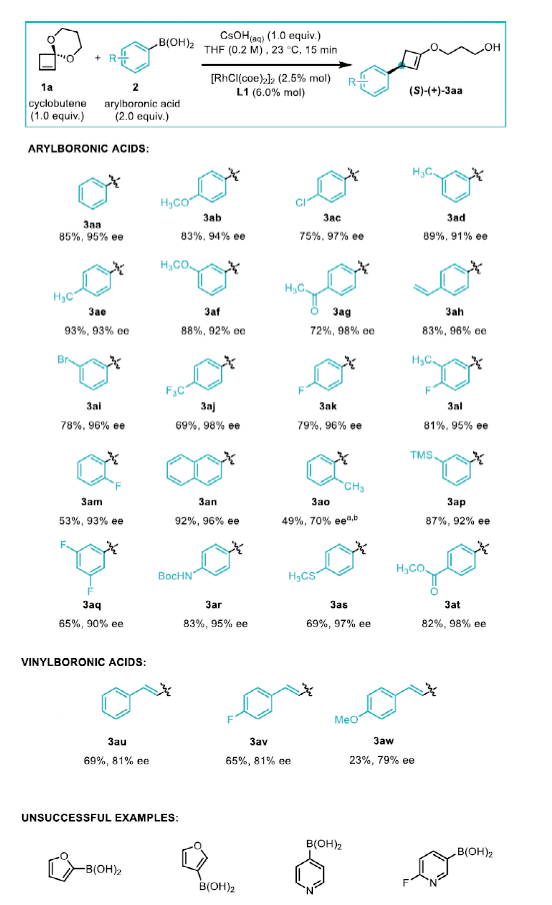
图4. 底物拓展一(图片来源:Angew. Chem. Int. Ed.)
此外,作者对另外三种具有不同取代基和不同环尺寸的螺环环丁烯进行了拓展。这些缩酮也获得了良好的结果(1b-d)。1b和1c的产物具有较高的对映选择性。另一方面,当使用五元缩酮环丁烯1d时,ee值较低。
图5. 底物拓展二(图片来源:Angew. Chem. Int. Ed.)
结合此前的研究,作者提出了以下机理: I与2发生转金属化反应,生成中间体II。然后,II和烯烃1a通过碳金属化反应生成中间体III。碳金属化步骤的区域选择性可能不受酮的任何电子效应控制,而完全受空间位阻控制。然后,III经过β-羟基消除开环,得到IV。I最终通过IV水解再生,同时生成产物3a。中间体III也可以发生副反应,得到4a。VI经1,4-Rh迁移氧化加成到芳基环的邻位。对于一些吸电子的芳基取代基,这种氧化加成的速率大大增加,产生少量的副产物4a(例如3ak, 3ar)。
图6. 反应机理(图片来源:Angew. Chem. Int. Ed.)
为体现该反应的应用价值,作者对3aa进行了进一步转化。3aa水解生成3-苯基环丁酮(5),表明1a是环丁酮与芳基硼酸1,4-加成的稳定替代品。加热环丁烯3aa会发生电环化开环反应,生成富电子的二烯6,产率为77%。产物末端的羟基可以继续用作后续的官能团化。例如,与酞酰亚胺的Mitsunobu型取代可以得到7。烷基烯醚可与NBS进行α-官能团化反应生成溴酮10。TBDMS保护的8经硼氢化氧化后得到具有3个相邻立体中心的环丁烷9。
图7. 反应应用(图片来源:Angew. Chem. Int. Ed.)
总结
Stephen P. Fletcher课题组开发了一种高效、高选择性的铑催化环丁烯缩酮的不对称芳基化反应。该反应采用不对称碳金属化和β-氧消除相结合的方法,从非手性酮合成手性烯醇醚。该反应是环丁酮不对称加成反应的替代途径。使用手性二烯配体在室温下反应迅速,产物可以进一步修饰以获得更复杂的环丁烷。
文献详情:
David Egea-Arrebola, F. Wieland Goetzke, Stephen P. Fletcher*. Rhodium-Catalyzed Asymmetric Arylation of Cyclobutenone Ketals. Angew. Chem. Int. Ed. 2023, https://doi.org/10.1002/anie.202217381
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn