

含有多个手性中心的手性化合物广泛存在于复杂天然产物和重要生物活性分子中,而这些手性分子的绝对和相对立体构型往往对它们的生理或药理活性具有极大的影响。立体选择性合成含相邻手性中心化合物是不对称催化领域的研究热点。近年来,立体发散性不对称催化合成取得了迅速发展,化学家相继发展了多种类型不对称联合催化策略,可由相同或类似的起始原料出发,通过调节催化条件即可实现多手性中心分子多个(甚至全部)立体异构体的发散性不对称合成。目前该领域主要关注于开链手性中心的高效高选择性构建,对于含有手性螺环骨架的立体发散性合成仍研究较少。手性3,3'-螺环氧化吲哚是广泛存在于天然产物和药物分子中的先导结构,目前关于此类骨架的立体发散性合成尚无报道,寻找合适的手性催化控制模型实现手性3,3'-螺环氧化吲哚化合物的立体发散性合成更具挑战性。
中国科学技术大学龚流柱课题组长期致力于有机小分子和金属不对称联合催化的研究,首次提出了“金属配合物和手性有机小分子”协同催化的策略(Tetrahedron: Asymmetry2001, 12, 1567),并先后发展了手性布朗斯特酸/金属、手性双功能有机小分子/金属、手性亲核路易斯碱/金属等联合催化体系 (Acc. Chem. Res.2014, 47, 2365;J. Am. Chem. Soc. 2022, 144, 2415),持续推动了这一领域的发展,使之成为均相不对称催化的前沿领域(Asymmetric Organo-Metal Catalysis: Concepts, Principles, and Applications; Wiley-VCH: Weinheim, Germany, 2022)。近期,该团队在氮杂环卡宾和金属联合催化领域也取得了系列进展(Nat. Commun.2022, 13, 134; Angew. Chem. Int. Ed.2022, e202201678; Angew. Chem. Int. Ed.2021, 60, 3268; Angew. Chem. Int. Ed.2019, 58, 12190; ACS Catal.2021, 11, 14388)。最近,中国科学技术大学龚流柱教授、姚雪彪教授和安徽大学宋琎教授合作应用手性氮杂环卡宾和铑配合物联合催化剂体系,成功实现了靛红衍生的α,β-不饱和醛与氧杂双环烯烃的非对映发散性去对称化反应,以优秀的收率和立体选择性得到了一系列结构多样的手性3,3’-螺环氧化吲哚衍生物(图1)。该策略涉及手性氮杂环卡宾和金属铑配合物两类手性催化剂,分别对两个反应底物同时活化并独立地实现立体控制,通过改变两个手性催化剂的构型组合,可实现含螺环季碳连续手性中心的立体发散性构建以及螺环氧化吲哚化合物的非对映发散性合成(RRR、SSS、SRR或RSS)。同时,生物活性测试研究表明手性螺环氧化吲哚化合物的相对和绝对构型对其细胞有丝分裂活性有显著影响,为探索结构-活性关系提供基础,突出了立体发散性合成策略的重要意义。
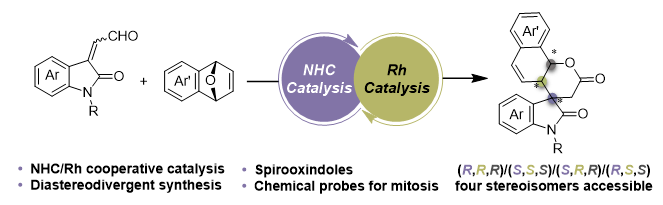
图1. NHC/Rh联合催化的手性螺环氧化吲哚非对映发散性合成
作者以靛红衍生的α,β-不饱和醛1a与氧杂双环烯烃2a为模板底物,对反应条件进行了筛选(表1)。对手性氮杂环卡宾催化剂的筛选结果表明,化合物4d为最优催化剂(表1, entry 4)。作者接着对溶剂进行筛选,发现当使用1,4-二氧六环为溶剂时,该反应能得到最高的收率和最优的立体选择性(表1, entry 10)。随后,作者对其他反应条件进行了细致筛选,确定了反应的最优条件,能够以96%的分离收率、95:5 dr的非对映选择性和>99% ee的对映选择性得到目标产物(R,R,R)-3aa(表1, entry 12)。
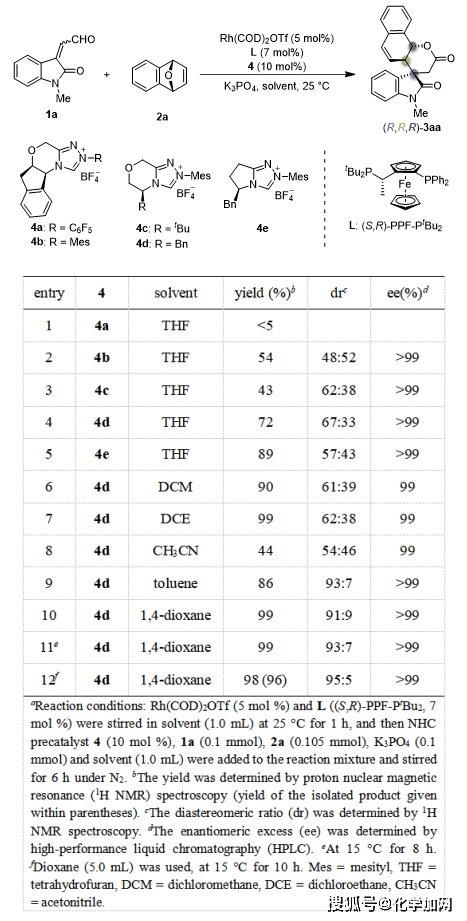
表1. 条件筛选
在最优的反应条件下,作者首先对靛红衍生的α,β-不饱和醛和氧杂双环烯烃底物的适用范围进行了考察(图2)。结果表明,反应对于不同取代的烯醛底物均具有较好的兼容性,所有目标产物均能取得99% ee或大于99% ee的对映选择性。对于不同取代的氧杂双环烯底物,该反应也能顺利发生,以良好的收率、高的非对映与对映选择性得到螺环氧化吲哚产物。
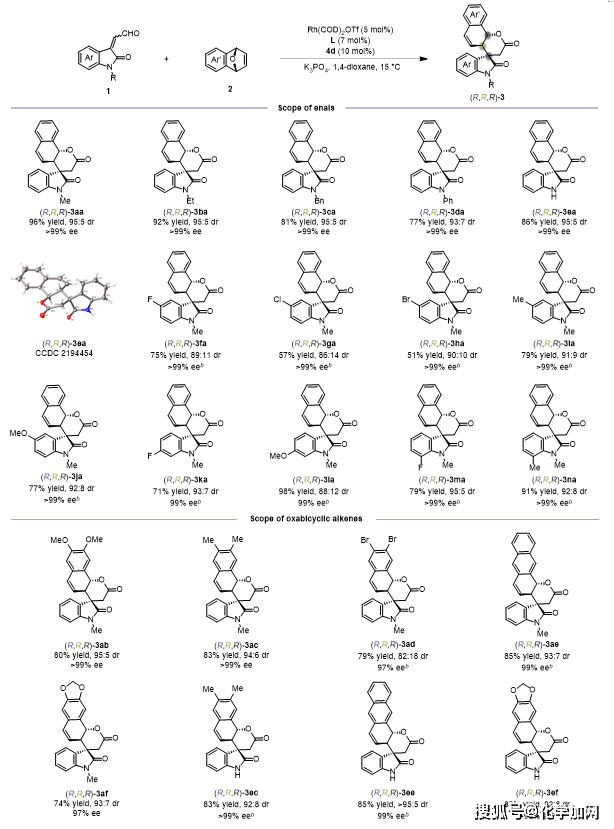
图2.底物拓展
随后,作者通过使用手性氮杂环卡宾催化剂4d和手性双膦配体ent-L的催化剂组合,成功实现了靛红衍生烯醛1与氧杂双环烯烃2的非对映选择性去对称化反应(图3)。对于各种取代基的底物均能得到较好的结果。
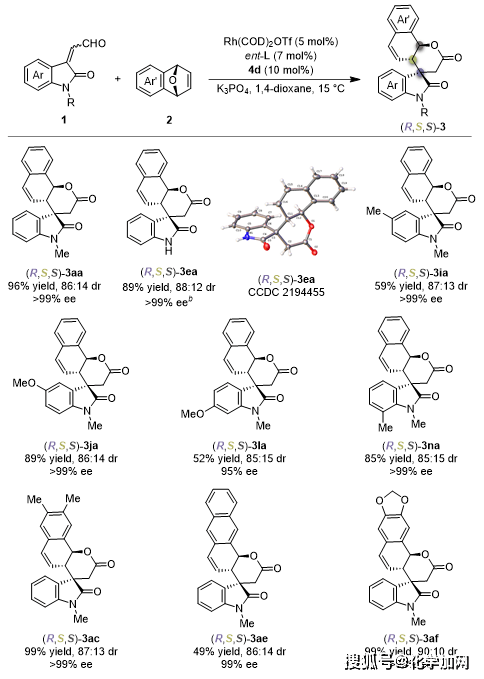
图3.非对映选择性去对称化反应
作者对反应的非对映发散性合成策略进行了验证(图4)。通过改变手性氮杂环卡宾催化剂与手性铑配合物的构型组合,可方便地制备出螺环氧化吲哚衍生物3aa、3ka和3ac的四个立体异构体,反应均能获得优异的收率和立体选择性。
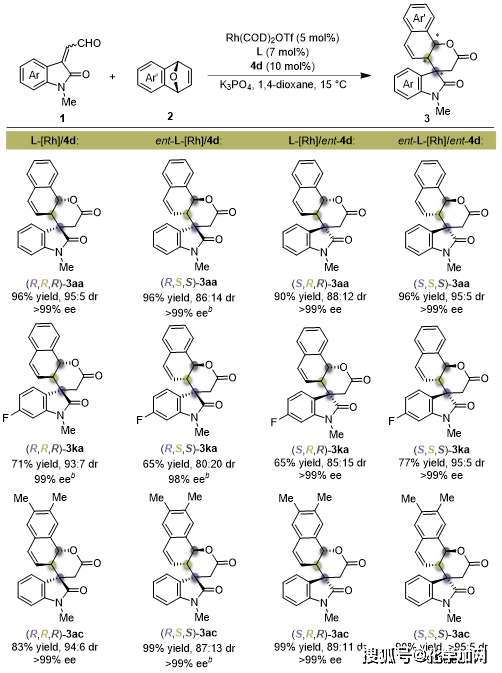
图4.非对映发散性合成
作者进行了一系列的衍生化实验进一步证实了该反应的实用性(图5)。在标准条件下可顺利开展克级规模放大反应,以良好的收率和立体选择性得到对应的目标产物,具有较好的应用潜力(图5A)。此外,化合物3aa还可以进行多种类型转化,获得一系列手性3,3’-螺环氧化吲哚衍生物(图5B)。
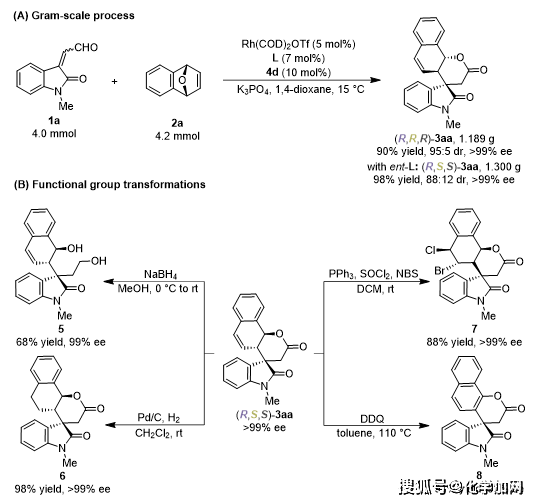
图5.衍生化实验
作者接着对该联合催化反应的机理进行了初步的研究(图6)。对照实验表明金属铑、配体或者手性氮杂环卡宾催化剂对反应至关重要且缺一不可(图6A,entries 2-4 vs 1)。金属铑催化剂和手性双膦配体L的预搅拌过程,对实现优秀的反应收率与非对映选择性至关重要(entry 5 vs 1)。结合文献分析,作者认为预搅拌过程可有效生成金属铑-双膦配合物,继而抑制手性氮杂环卡宾与金属中心的配位作用,防止发生催化活性淬灭,从而使手性氮杂环卡宾分子仅作为有机小分子催化剂参与不饱和醛底物的高效活化及反应立体化学的控制。在此基础上,作者提出了可能的催化循环机理(图6B):手性铑配合物催化剂和氧杂双环烯烃2a反应形成的中间体Ⅰ与氮杂环卡和醛1a形成的高烯醇中间体III(或II)发生不对称烯丙基化反应,形成中间体Ⅳ,再经分子内环化得到目标产物(R,R,R)-3aa。其中,手性铑配合物和手性氮杂环卡宾催化剂在烯丙基烷基化过程中协同作用,能够分别对每个手性中心的立体化学进行独立控制,成功实现连续手性中心的立体发散性构建,最终实现螺环氧化吲哚的非对映发散性合成。
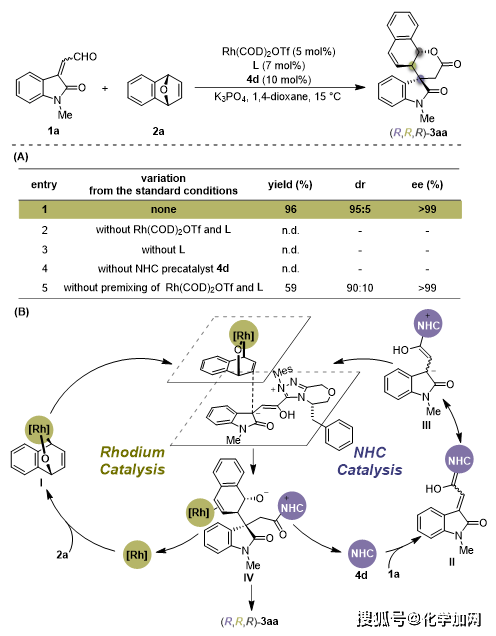
图6.机理实验
作者对代表性的产物开展了生物活性研究(图7)。结果表明,该类手性3,3’-螺环氧化吲哚化合物能够在HeLa细胞增殖的中后期抑制有丝分裂纺锤体的形成。相较于其它立体异构体,(R,S,S)-3aa、(R,S,S)-3ka和(R,S,S)-3ac对HeLa细胞表现出显著的抗增殖活性。手性螺环氧化吲哚化合物的相对和绝对构型对其生物活性有显著影响,为研究结构-活性关系以及探索细胞增殖机制提供基础。
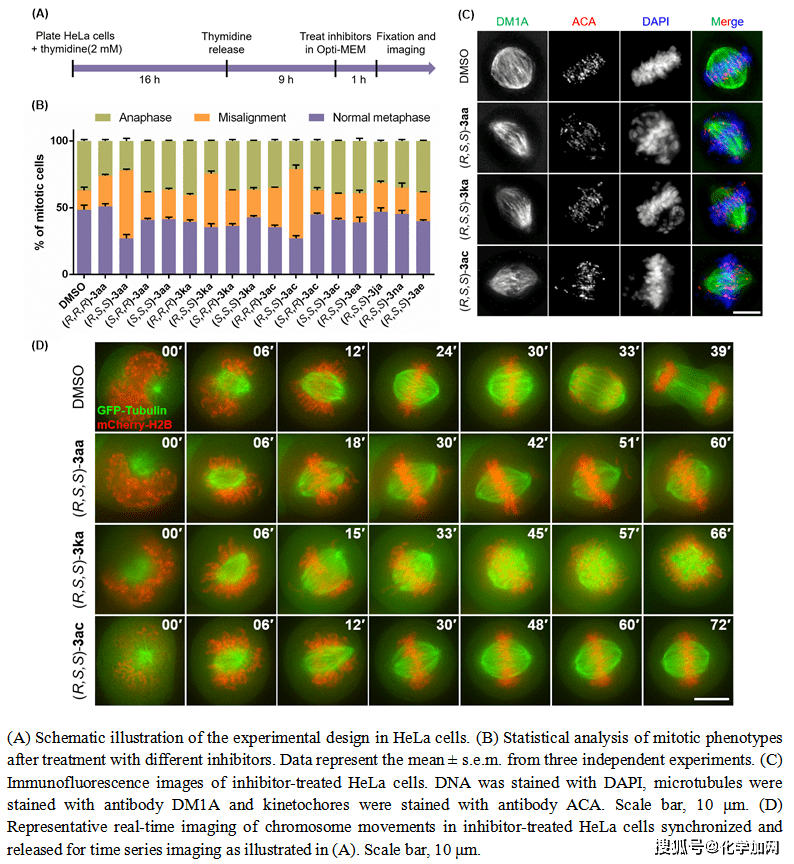
图7. 生物活性研究
总结
龚流柱、姚雪彪以及宋琎研究团队基于立体发散性合成思路,利用手性氮杂环卡宾和金属铑配合物联合催化策略,高效、高立体选择性地实现了靛红衍生烯醛和氧杂双环烯烃的去对称化反应,为手性3,3’-螺环氧化吲哚衍生物的非对映发散性合成提供了一种简便方法,并进一步揭示了该类化合物的立体化学结构对生物活性的显著影响。
文献详情:
Yu-Hua Wen, Fengrui Yang, Shuai Li, Xuebiao Yao*, Jin Song*, and Liu-Zhu Gong*. Diastereodivergent Desymmetric Annulation to Access Spirooxindoles: Chemical Probes for Mitosis. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.2c12648
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn