N-N轴向手性化合物由于其独特的骨架,在有机催化、药物传递以及手性配体领域有着广泛的应用。尤其是吲哚衍生物在药物的发现和开发中起着重要的作用(Figure 1a)。因此,N-N轴手性吲哚框架的构建成为一个重要的研究方向。近几年报道合成它的方法包括金属催化策略,如铜、钯、铱和铑等催化;有机小分子催化策略如手性磷酸、布朗斯特碱等催化。然而,这些方法主要集中在单一N-N轴手性的构建(Figure 1b)。值得注意的是,N-N轴手性吡咯/吲哚骨架六元杂环的高选择性合成,同时控制多手性元素(轴手性和中心手性)仍然具有较大的挑战性。近日,西北工业大学鲁神赐课题组与新加坡国立大学Ming Wah Wong教授(提供理论计算)合作报道了一种用氮杂环卡宾催化阻转选择性(3 + 3)环加成反应策略,利用异硫脲与烯醛反应从而构建具有连续中心手性和N-N轴手性的吡咯/吲哚骨架六元杂环化合物;利用硫脲与炔醛合成N-N轴手性吡咯/吲哚骨架六元杂环化合物(图1c) 。

Figure 1.Importance and atroposelective synthesis of N–N Linked bis-heterocyclic skeletons(图片来源: Nat. Commun.)
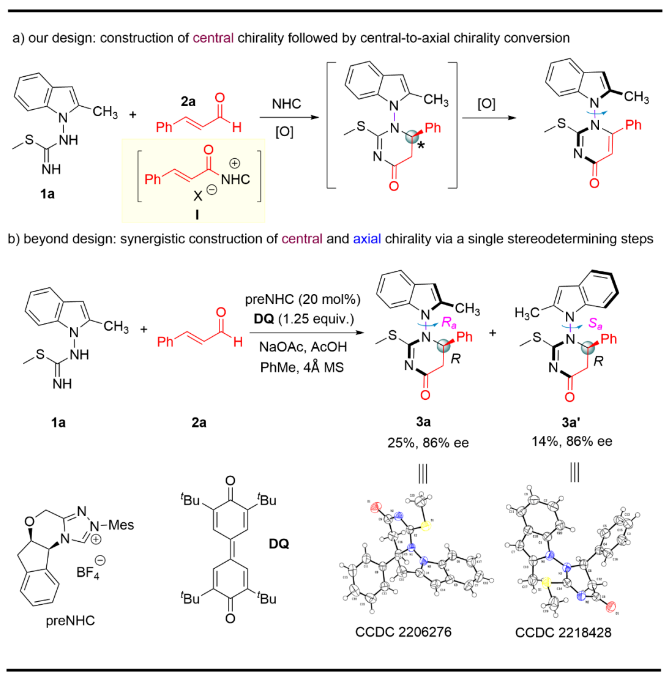
通过氧化中心手性转化为轴手性是合成轴手性化合物的有效策略之一,基于这一策略,作者设计在氮杂环卡宾(NHC)催化下, 以异硫脲1a和肉桂醛2a作为底物生成中心手性化合物,进一步氧化生成N-N轴手性化合物(Figure 2a)。实验结果表明,异硫脲1a和肉桂醛2a在卡宾催化下生成两个化合物3a和3a´,它们可以通过柱层析分离,分别得到25%和14%的产率,对映选择性均为86%。通过单晶X射线衍射分析,它们为一对非对映异构体,并且确定了它们的绝对构型。此结果表明通过该方法可以一步高效构造含有相邻碳手性中心的N-N轴手性吲哚轴手性化合物(Figure 2b)。 Figure 2. Discovery of N–N axially chiral indole with vicinal central chirality synthesis(图片来源: Nat. Commun.)
通过条件筛选,获得最优反应条件后,以异硫脲1a和烯醛2作为底物探究了该反应的适用范围(Figure 3)。反应结果表明,烯醛的苯环被杂芳环取代不受电子效应和定位效应的影响,均能以良好的产率和优秀的对映选择性得到目标产物(3a-3j)。烯醛的苯环被杂原芳环取代不影响反应结果,生成相应的产物3k。此外,该策略也适用于β-乙烯基烯醛,得到相应的产物(3l),产率中等,对映体选择性良好。烷基烯醛也可在最优条件下以73-80%的ee值得到所需的两种非对映异构体(3m)和(3m’)。 
Figure 3. Scope of N–N axially chiral indoles and pyrroles with vicinal central chirality(图片来源: Nat. Commun.)
随后,作者对异硫脲底物1进行了扩展。5位不同取代的吲哚底物、2,3-二甲基或环己基也能得到相应的产物(3n-3r),产率良好,ee值优异。为了进一步扩大底物的适应范围,作者还对吡咯异硫脲进行了测试。对位吸电子基和给电子基肉桂醛包括呋喃丙烯醛对该反应耐受性良好,反应产率高,对映选择性优异(3s-3v)。最后,在室温条件下,使用碘作为氧化剂在DMSO溶液中氧化两个非对映异构体3a和3a',分别得到了单一轴手性产物4以及其对映异构体ent-4(Figure 4),同时,在吲哚的3位上引入碘原子。单晶X射线衍射分析明确了4的绝对构型。
Figure 4. Oxidation of 3a and 3a' into enantiomeric compounds 4 and ent-4(图片来源: Nat. Commun.)
除此之外,作者使用硫脲类底物5与炔醛类化合物6实现了单一N-N轴手性产物的合成。作者在最优条件下进行了反应的底物扩展(Figure 5)。底物5的N -苯基上常用的强吸电子基团(CF3)有很好的耐受性 (7b-7c),产率中等,对映选择性为90-94%。不幸的是,N -苯基上带有中性或给电子基团的底物导致了副产物的产生。在确定的最佳条件下,作者研究了底物5吡咯苯基对位上给电子基团和吸电子基团的变化,它们具有良好的耐受性,以中等产率和优异的对映选择性(85-93% ee)得到相应的产物7d-7j。作者对吡咯苯环上不同的邻位和间位取代基进行了测试,得到了相应的产物7k- 7o,产率中等,对映选择性优异(90-99% ee)。单晶X射线衍射分析明确了7l的绝对构型。随后,对炔醛6苯环上电子效应进行了考察,电子效应对反应结果有明显影响,给电子取代基有利于该反应的发生。反应产物7p-7ab产率中等,对映选择性良好(95-98% ee)。为了进一步扩大底物的范围,还对吲哚硫脲进行了测试。二位取代(甲基或苯基)吲哚硫脲耐受性良好,分别得到产率中等,对映选择性高的7ac和7ad。含有P(O)Ph2基团的底物以65%的产率和86%的ee值成功地合成产物7ae。 
Figure 5. Scope of N–N axially chiral pyrroles and indoles bearing a 2,3-dihydropyrimidin-4-one moiety(图片来源: Nat. Commun.)
该N-N轴手性化合物可以通过简单的操作转化为带有高活性官能团的产物:3a与苯基格氏试剂以四氢呋喃为溶剂在零下15度下反应6个小时,发生了水的消除反应以91%的产率和90%的对映选择性得到目标产物10(Figure 6-1)。此外,产物4在金属钯的催化下与三甲基硅基乙炔反应得到硅基保护的炔类轴手性化合物,该化合物无需任何的纯化,随后使用KF脱去硅烷保护基得到了具有乙炔基的轴手性产物11,该反应的两步反应总产率为95%且反应过程中产物的对映选择性保持不变(Figure 6-2)。具有二苯基磷氧基团的化合物7ae通过三氯硅氢的还原反应可得到轴手性膦配体13(Figure 6-3)。该反应在减压下除去溶剂后,残渣无需进一步纯化即可使用,反应产率为84% yield,对映选择性为85%。该N-N轴手性的单磷配体13作为手性配体在金属钯的催化下进行了烯丙基化反应,结果得到了具有81%产率和40%对映选择性的烯丙基化产物16 (Figure 6-4)。实验结果表明,所得到的N-N轴手性的单磷配体在金属催化领域具有广阔的应用前景。 
Figure 6. Transformations and application of chiral phosphine ligand.(图片来源: Nat. Commun.)Figure 7. (left) Nonlinear effect with respect to product ee and catalyst ee; (right)chemical shift of the acidic proton of the NHC pre-catalyst F under various conditions.(图片来源: Nat. Commun.)
为了研究卡宾催化剂F的ee值与产物3a的ee值之间的变化过程,反应体系中使用了不同ee值的催化剂。如图Figure 7 left所示,当卡宾催化剂F的ee值由0%逐渐增加到70%时,产物3a的ee值并没有明显的提升;当卡宾催化剂F的ee值由70%增加到100%时,产物3a的ee值有了骤升的现象。手性卡宾催化剂F的ee值与产物3a的ee值并不是线性关系。该结果证明该反应呈现负向非线性效应。为了进一步了解该反应机理,证实催化剂F和异硫脲1a之间的相互作用,作者进行了1H NMR分析(Figure 7 right)。在催化剂F和碱NaOAc的混合物中加入异硫脲1a后,F的酸性质子的化学位移下降了0.15 ppm (Figure 7 a vs 7b)。这一结果表明催化剂F与异硫脲1a之间存在相互作用。结合NLE实验,第二个NHC分子可能与异硫脲1a之间存在氢键作用。基于以上的实验结果作者对该反应机理进行猜测,从F-2生成F-3开始,他们提出第二个卡宾催化剂可以作为布朗斯特碱,通过氢键来激活1a (Figure 8)。 
Figure 8. Proposed catalytic cycle. C-H hydrogens are hidden for clarity.(图片来源: Nat. Commun.)
并且通过计算对反应机理进行了近一步佐证,计算结果显示(Figure 9),C-C键断裂时的过渡态F-TS6-RRa的能量最高,为59.4 kJ/mol。N-C键形成(过渡态F-TS1-RRa)、质子转移(过渡态F-TS2-RRa)环闭合过渡态F-TS3-RRa的能量较低,分别为40.6、53.9和6.5 kJ/mol。排除计算误差,这将意味着该反应符合Curtin-Hammett定律,反应的立体选择性将由C-C键断裂时的过渡态控制。作者注意到F-TS6-RRa的直接产物是一个质子化的3,需要将这个质子重新转移到催化剂F上来完成催化循环。接下来,作者研究了是否可以通过添加碱或酸来降低这一步的高势垒,并通过这个思路找到了一条能量较低的新反应路径。新路径的第一步是醋酸催化F-5 (2.1 kJ/mol)异构化为能量较低的F-8 (-30.9 kJ/mol)。计算结果表明这一步是相当容易的。在共轭碱乙酸钠存在的情况下,C-C键裂解的过渡态变为F-TS5-RRa,能量也降至41.7 kJ/mol。根据计算结果和Curtin-Hammett原理,作者得出了反应的立体化学是由反应路径中的F-TS2过渡态的不同非对映体所控制。由于过渡态中存在许多低频率的分子振动(frequencies < 30 cm-1),并且第二个卡宾分子仅通过弱氢键结合,使得计算很难非常准确得预测反应的立体选择性。事实上,计算得到的立体选择性与实验并不完全一致。目前仍然缺乏对负NLE机制的明确解释。 Figure 9. Calculated reaction profile at M06-2X/6-311+G(2d,p)-SMD(toluene)//M06-2X/6-31G(d)-SMD(toluene) level of NHC-catalyzed atroposelective construction of N–N axially chiral indoles.(图片来源: Nat. Commun.)