

正文
图片来源:Science
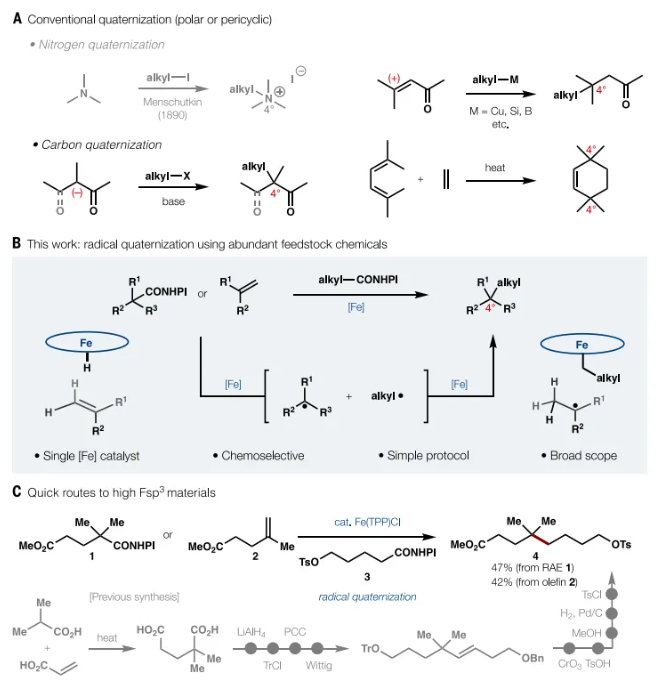
氮季铵化是一种极性成键反应,起源于19世纪,是有机合成中C-N键形成的最早例子之一(图1A)。一种简单且可预测的方法来形成类似于经典N季铵化的四取代C,这将是一种有吸引力的转化。之前的研究已经证明了如何利用自由基方法将烯烃与其他烯烃或烷基/芳基卤化物交叉偶联。在许多情况下,季C合成可以通过此类方法实现。两种不同氧化还原活性酯之间的交叉偶联也已被报道,但通常不适用于季C合成。在这里,作者展示了单一催化剂如何利用普遍存在的化学原料:烯烃和羧酸来介导C的区域选择性季碳化(图1B)。在简单还原剂存在下,廉价的铁基催化剂可以通过类似的机制途径以化学选择性方式有效地实现这种强大的转化,具有广泛的底物范围。特别值得注意的是,单一催化剂既可以激活不同的官能团[氧化还原活性酯(RAE)和烯烃],又可以介导它们之间的键形成。图1C展示了这种反应的威力,其中看似微不足道的结构(4)的10步合成可以通过偶联含有一级对甲苯磺酸酯的RAE被截断为一步。3与RAE 1或烯烃2的反应具有高化学选择性,产率分别为47%和 42%。下载化学加APP到你手机,收获更多商业合作机会。
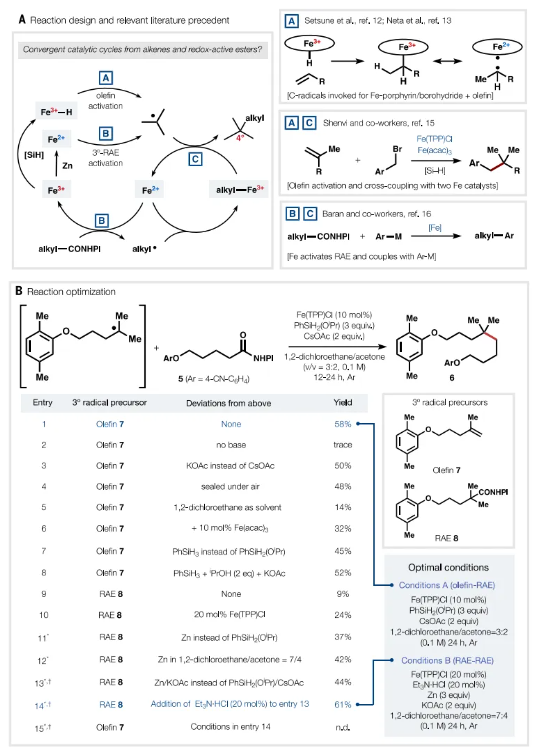
图2. 反应设计及优化
图1B中概述的机制框架受到图2A中的关键文献先例的启发。Hirobe等人的开创性研究表明,可以使用铁卟啉实现Drago-Mukaiyama型烯烃水合。事实上,Setsune等人的开创性研究确定了1-烯烃暴露于氯化铁[Fe(TPP)Cl]和NaBH4 时形成的仲烷基铁卟啉。Fe-H的形成和金属氢化物氢原子转移(MHAT)解释了支链选择性加氢金属化。Shenvi 等人最近使用这种铁配合物与硅烷一起催化溴化苄和烯烃之间的C-C键形成,通过双分子均解取代(SH2)反应形成季碳中心。Baran小组展示了RAE和各种芳基有机金属试剂的Fe催化脱羧Negishi偶联。鉴于这些结果,RAE可能通过催化循环季铵化自由基,其中Fe(II)卟啉形成并捕获由烯烃或其他RAE生成的开壳C中间体,这似乎是合理的。这两个相关的催化循环将依赖于整体还原条件(Zn或硅烷)来产生Fe(II)池,这些Fe(II)可能会裂解N-羟基邻苯二甲酰亚胺酯以产生伯自由基和/或叔自由基。由于叔烷基铁络合物在高于0 °C时不稳定,因此优选捕获伯自由基,从而使其能够在假定的 SH2反应中被叔自由基拦截。同样的叔自由基可以由烯烃和氢化铁形成,氢化铁可以通过MHAT或析氢反应(HER)再生 Fe(II)。与许多MHAT反应相反,该催化循环不需要外源氧化剂的周转;RAE配偶体会将Fe(II)重新氧化为(III)。
图1B总结了该计划的实现,使用RAE 5与烯烃7或RAE 8生成相同的产物6。每个反应都需要简单且相似的条件:Fe(TPP)Cl络合物、碱、还原剂和1,2-二氯乙烷(DCE)/丙酮溶剂混合物。事实证明,碱的选择至关重要,其中CsOAc 是最佳碱。对反应混合物进行简单脱气(Ar或N2鼓泡)后观察到产率增加。排除丙酮会导致产率降低,可能是由于催化剂不溶解。将Fe负载量增加至20%对转化率具有可测量的积极影响。当还原剂从硅烷改为金属锌时,出现了最大的改进。将溶剂组成稍微改变为DCE/丙酮7:4,并用KOAc代替CsOAc,导致产率进一步增加。加入弱酸(Et3N•HCl)可能会激活Zn(0),并导致6的分离产率为61%。RAE-RAE偶联的最终优化条件不能应用于密切相关的烯烃-RAE偶联,反之亦然。然而,两种条件均使用市售试剂和相同Fe(TPP)Cl催化剂的简单组合。
Fe催化的脱羧偶联(条件A或B)都不需要O2来转换催化循环(Fe2+到Fe3+)。在目前的工作中,单铁(II)卟啉在没有氧气的情况下通过与RAE或其生成的自由基反应转化为铁(III):1H NMR研究表明Fe(TPP)会在形成n-戊基-Fe(TPP)之前络合正戊基-CO (NHPI)。Fe(TPP)可以通过析氢或烯烃MHAT由其相应的氢化物形成。因此,Fe(TPP)Cl 在内球(配位)烯烃官能化催化中模拟了贵金属的多功能性,但似乎是在外球(非配位)一系列基本步骤中这样做的。在RAE-RAE偶联的情况下,众所周知,使用Zn金属可将NHPI酯还原分解为C中心自由基。条件A和B中的不同最佳碱是根据经验确定的,并且可能发挥不同的作用。
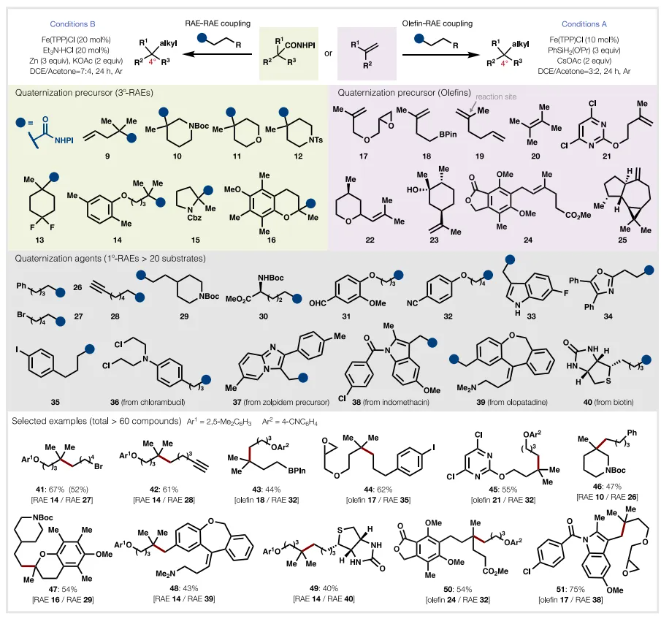
有了一套简化的烯烃和羧酸酯自由基季碳化条件,作者对底物进行了扩展,范围如图3所示,这些高度化学选择性的条件与一系列官能团相容,包括氨基甲酸酯、酰胺、烷基 卤化物、环氧化物、芳基卤化物、酯、醇、腈、叔胺、酮、脲和富电子或缺电子杂环。烷基溴、末端炔烃以及烷基硼酸酯在季铵化过程中保持完整,尽管它们在过渡金属催化偶联和自由基化学中具有众所周知的反应活性。 同样,芳基碘化物和缺电子芳基氯化物尽管常用于自由基交叉偶联,但也没有受到影响。就烯烃而言,在RAE-RAE偶联过程中可以实现优先的反应性,而在使用RAE-烯烃偶联时,可以避免反应性较低的烯烃。衍生自α-杂原子或α-芳基羧酸的稳定基团也可以偶联。在此类底物的RAE-RAE偶联的情况下,FeOEP导致产率大幅增加。复杂的药学相关结构可以有效偶联,产生含季碳类似物 36-40。在饱和杂环内直接安装季碳中心是通过传统极性键分析构建的一个特别具有挑战性的结构单元;这种季碳化可与易于获得的杂环片段(10、11、12、15和16)进行偶联。上述反应非常简单且实用,可使用廉价试剂进行,包括快速设置时间,并证明适合克级制备(41 和 34)。条件 A/B 中不存在氧气,可以轻松缩放至克量,且产率不变(不需要 Schlenk 或手套箱条件,只需一个简单的 Ar 气球),并指向内部氧化周转,即整体氧化还原中性过程(图2A)。
图片来源:Science
这些新反应显著简化含季碳分子的能力已通过 10 个不同的案例研究得到例证,其中6个示例如图 4所示。例如,简单的炔53先前是通过八步制备的,其中只有一步形成了C-C键。相比之下,市售烯烃54与衍生自简单市售含炔酸(55)的RAE在自由基季铵化条件下偶联,仅用两步即可产生53(48%分离产率)。酮醛 56 是类固醇类似物合成的有用构建模块,之前通过经典羰基化学、C-C同系化和各种不需要的试剂获得。或者,在用 RAE 58 对烯烃 57 进行自由基季碳化,然后进行酸后处理后,直接获得相同的结构,分离产率为45%。底物 60 包含两个季碳中心,之前是通过从戊二酸酐59开始的低理想度的费力11步序列获得的,二烯 61 可以首先通过使用烯烃-烯烃Fe催化的MHAT与丙烯酸甲酯交叉偶联(产率 72%)进行顺序自由基交叉偶联,然后用RAE 63对62进行自由基季碳化,得到相同的产物60,分离收率为 58%,从而无需九个不方便的步骤以及有毒和/或自燃试剂。Enyne 65用作环异构化研究中的底物,之前通过15步序列获得,该序列依赖于炔烃加氢金属化、Wittig、羰基化学和乙炔加成作为关键的C-C键形成步骤。这个冗长的序列需要使用保护基团和广泛的氧化还原操作(三个LiAlH4 还原)。通过彻底的逆合成,实现了一种更直观的“乐高”式方法。因此,用碘乙烯67对市售酸66进行Ag-Ni促进的脱羧烯基化,然后用含炔的RAE 68进行自由基季碳化,仅用五步就得到了65,无需任何氧化还原操作。自由基季碳化也可用于构建天然产物中出现的骨架。如哌啶70在C-3位上具有季C,可作为Madangamine 生物碱中的关键骨架。在之前的七步合成中,季碳中心的构建再次依赖于从2-哌啶酮开始的羰基化学。而从市售酸71开始,进行简单的烷基化,然后用含有RAE 70的游离醇进行自由基季碳化,从而实现三步合成。最后,α-生育酚类似物74 可用于调节小胶质细胞活化,需要依赖于经典极性键分析的10步路线。市售的Trolox (75)可用于通过RAE 72的自由基季碳化(产率 58%)有效地掺入所需的烷醇侧链,仅用三步即可提供类似物74。
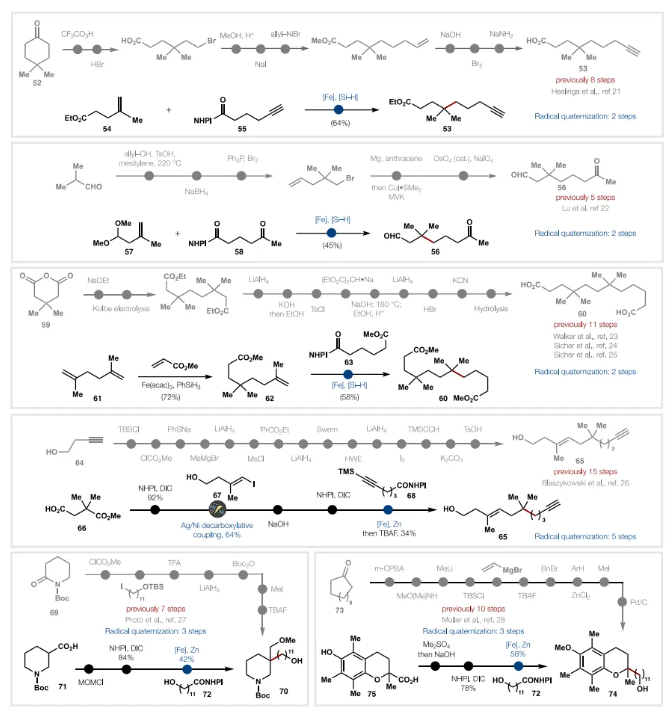
图3. 合成应用
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn