

正文
喹诺酮是一种特殊骨架,广泛存在于天然产物和生物活性分子中,是抗菌、抗癌和抗炎药中必不可少的模块(图1)1-9。喹诺酮类抗生素早在1962年被发现。经过药物学家六十年的努力,发现其具有良好药代动力学特性的新型喹诺酮类抗生素。许多著名的喹诺酮类药物已被广泛用作处方药或非处方药,如图1所示,例如环丙沙星、诺氟沙星、培氟沙星、噁喹酸、依伐卡托、格雷沙星和奥泽沙星。因此,如何通过简单、有效的合成策略构建这些药物分子是有机化学发展的重要方向。截至目前,化学家们利用 Conrad-Limpach反应,Knorr喹啉酮合成法,Doebner-von Miller反应等获得喹诺酮药物母体结构。但目标产物可修饰性限制这些反应在喹诺酮药物合成中应用10-11。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
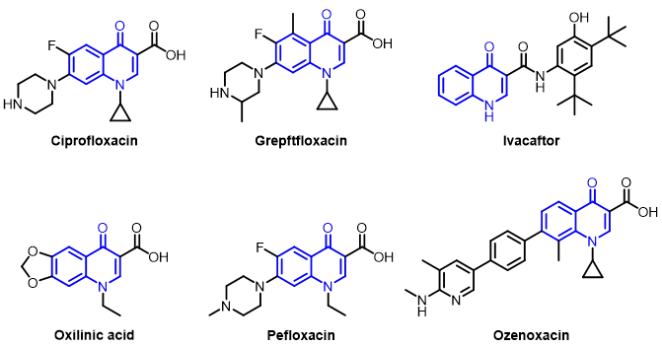
图1 代表性喹诺酮药物
迄今为止,Gould-Jacobs反应是喹诺酮药物最经典的合成方法,但是合成技术通常总产率较低且反应步骤多。具体而言,苯胺亚甲基丙二酸酯由苯胺衍生物与乙氧基亚甲基丙二酸二乙酯缩合而制得,但该反应条件非常苛刻(图2a,等式(1))12-16。并且在高温下长时间反应会出现目标产物分解和一些副反应产生17-20。为克服Gould-Jacobs反应的内在缺陷,以官能化的苯甲酰乙酸酯为起始原料,通过五步合成方法构建喹诺酮(图2a,等式(2))21,22。然而,该过程仍然存在反应温度高(>250°C)、官能团兼容性差、试剂昂贵、添加剂过量和总收率低等问题。综上所述,当前合成技术仍然存在反应温度高(>250°C)、官能团兼容性差、试剂昂贵、添加剂过量和总收率低等问题。
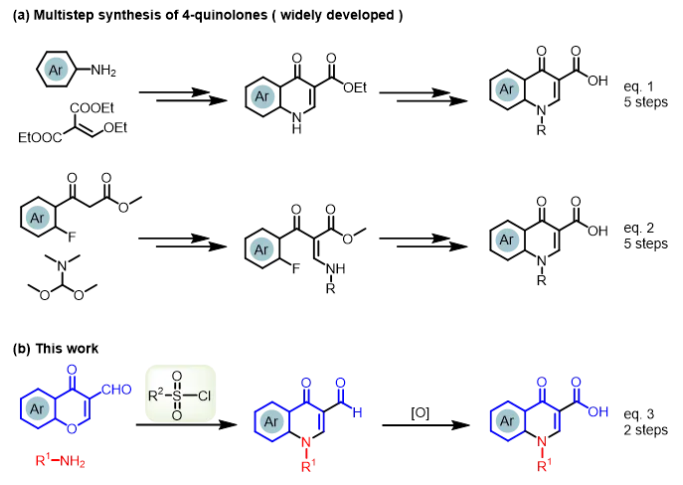
图2 喹诺酮药物合成方法
当前合成技术与“双碳”战略发展目标契合度高,亟需开发绿色高效的合成技术,助力喹诺酮药物生产新变革。因此,喹诺酮药物高效合成技术应该具备如下特点:反应条件温和,原子利用率高,官能团兼容优异,反应步骤精简等。基于我们对色酮类合成方法学的开发,本技术团队对喹诺酮进行性逆合成分析23-27 ,研究小组提出以色酮环化技术构建喹诺酮你药物的科学假说,即色酮环可以弱亲核试剂进攻色酮环的C2位置,随即发生开环反应。通过捕获活性中间体以驱动产物的合成,由此开发一种实用有效的策略28–30。基于此科学构想与合理的理论分析,我们首次提出新型对甲苯磺酰氯介导的多米诺串联反应,开创喹诺酮类药物绿色高效合成技术(图2b,等式(3))。本合成技术主要表现为如下三个优势:(1)只需仅仅两步即可获得喹诺酮药物的前药,避免长时间的多步合成、高沸点溶剂的使用、高温或化学计量的强酸;(2)采用简单易得的原料,避免昂贵或危化品的使用;(3)本技术具有广泛的适用性,采用本技术可以高效的合成当前四代喹诺酮药物,并且为新型抗菌药物开发,提供重要的实验基础和理论依据。
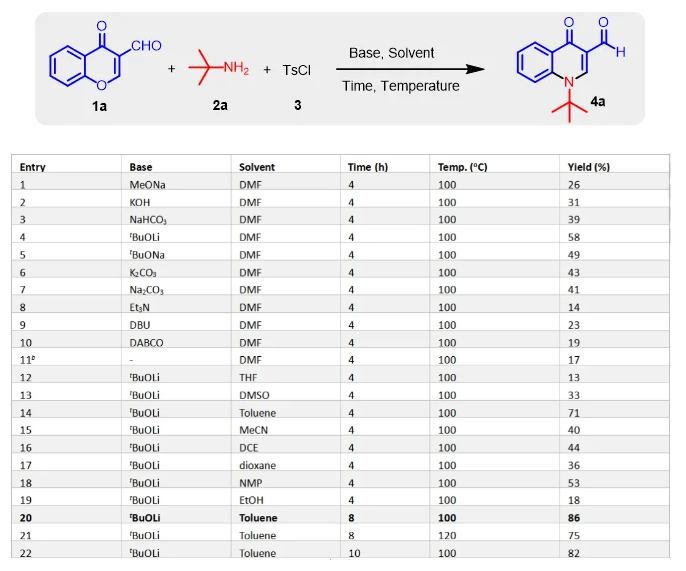
图3 合成喹诺酮药物前体的条件优化
首先,通过“一锅法”多米诺串联反应,选择色酮-3-甲醛1a,叔丁胺2a和对甲苯磺酰氯3a作为起始原料(图3)。基于前期实验基础,布朗斯特酸能够在温和的条件下构建1,4-加成产物31。然而,通过细致研究这些反应条件,并没有检测到目标产物4a的生成。因此,我们将进一步考虑碱性条件在本技术中的应用。在无机碱的筛选中,叔丁醇锂以58%的分离产率合成4a(第4行)。通过考察叔丁醇锂,碳酸钾或碳酸钠替代叔丁醇锂等碱性条件,只有中等产率的目标产物被检测到。以N,N-二甲基甲酰胺(DMF)为溶剂,评估其他有机碱对反应的促进作用(第8-10行),但目标化合物转化率相当低。通过简单筛选常见有机溶剂后(第11-18行),我们发现以甲苯为溶剂进行反应,以明显更高的71%产率获得4a(第14行)。将反应时间从4小时延长至8小时,以最高的86%产率获得4a(第20行)。进一步延长反应时间或提高反应温度,则导致产率略有降低(第21和22行)。通过如上多种反应条件的考察,喹诺酮药物中间体的最优条件为:“在100°C下,以甲苯为溶剂,起始原料在2.0当量的碱的作用下持续8小时”。
正如我们预期的那样,对甲苯磺酰氯通过捕获反应原位形成的羟基,从而促进目标中间体的形成,使得反应平稳、快速的转化为目标产物。为进一步研究捕获剂对甲基苯磺酰氯的适用性,探索一系列磺酰氯的反应效果(图4)。含有甲基、氧甲基或叔丁基取代的苯磺酰氯作为捕获剂时,导致目标产物的产率略有下降。同样,乙烷磺酰氯也没有更高的收率。然而,含有吸电子基团的苯磺酰氯,如三氟甲基、二氧化氮和氯,产率略高。综上所述,我们决定使用成本效益高的对甲苯磺酰氯进行进一步研究。
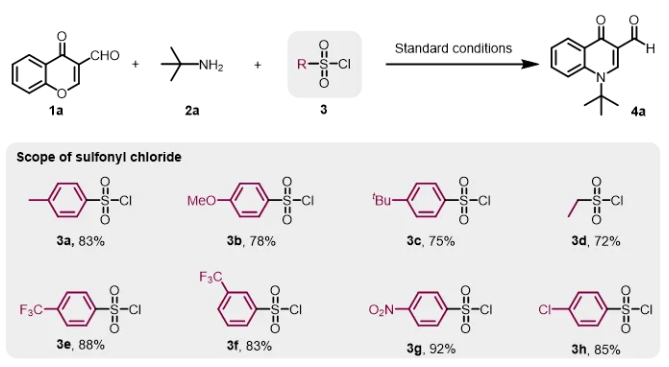
图4 磺酰氯的适用性
在获得最佳反应条件后,本技术团队将进一步考察多米诺串联反应的官能团兼容,为多种多样喹诺酮药物合成提供重要的理论依据,图5所示。大体积的叔丁胺高效促进反应进行,以86%的收率获得喹诺酮4a。总体而言,选择4-甲基苄胺作为胺源,化合物4d的收率为77%。通过对胺源的研究,本合成技术不仅能够适用于普通的脂肪胺,而且芳香胺类能够被高效兼容。然后,结构多样化的色酮-3-甲醛的官能团兼容性也被进一步考察,以扩大喹诺酮类药物前体的范围(4h-4s),如图5所示。令人惊喜的是,该反应与无论色酮-3-甲醛的芳环上含有供电子基团还是吸电子基团,目标产物都能被高效的合成,产率可达73%至90%。值得一提的是,4h只需要通过一步氧化反应,可直接转化为喹诺酮药物—噁喹酸(图5)。基于此,分别以6-甲基和6-溴色酮-3-甲醛为起始原料之一,最终化合物4n和4r收率分别为85%和82%。更为重要的是,通过本技术合成的喹诺酮药物前体,大部分只需要即可获得喹诺酮抗菌药,产率为73%至85%(4aa-4ah)。通过 4ai的结构可以看出,不饱和酮类基团同样能够被兼容,目标产物的产率为 73%。基于类似的策略,本技术同样可以应用于抗癌药物厄洛替尼的修饰,最终目标产物4aj产率为76%。
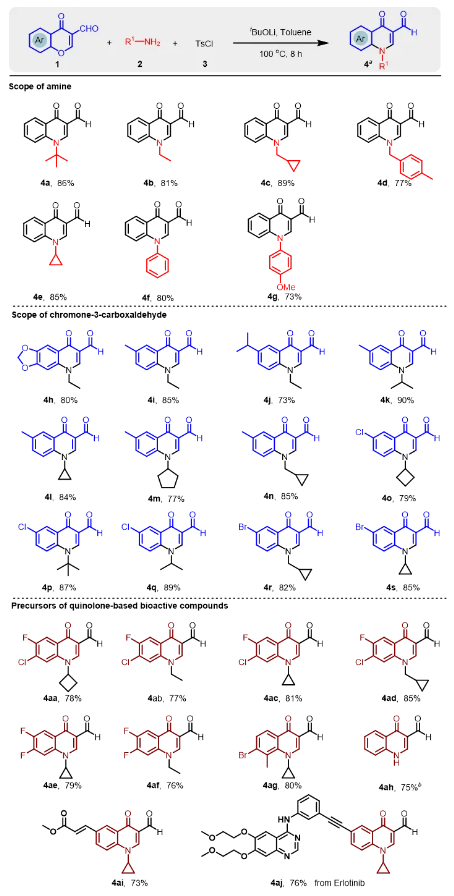
图5 喹诺酮药物前体合成
喹诺酮是合成抗菌剂中的重要部分,由于其出色的安全性,有利的制药协同动力学特性和广泛的抗菌性,被人们青睐。基于以上优点,我们应用甲苯磺酰氯介导的多米诺串联反应的策略来构建喹诺酮类药物。如图6所示,将6,7-二氟色酮-3-甲醛、环丙胺和TsCl为原料合成化合物4u,然后如方案3所示方法将其氧化,以91%的收率得到对应的酸5。哌嗪或2-甲基哌嗪与其发生亲核取代反应分别得到化合物6(环丙沙星,91%)和化合物7(格雷夫氟沙星类似物,87%)(图6a)。类似地,化合物4v的氧化产物8经过亲核取代反应,得到9(诺氟沙星,92%)和10(培氟沙星,90%)(图6b)。值得一提的是,通过我们的对甲苯磺酰氯介导的多米诺串联反应,仅经过三步就完成了这两种药物的合成,大大提高了反应效率。奥索利酸和奥泽沙星是典型的抗生素,化合物4e和4w的氧化反应分别得到奥索利酸(11,88%)和奥培沙星的前体(12,91%)(图6c和d)。如文献所示,奥泽沙星通过12的Stille偶联反应直接合成,收率很高。然后通过改变起始材料醛和胺来设计一种高效且步骤短的依瓦卡托合成方法。由甲苯磺酰氯介导的多米诺串联反应和氧化反应生成的化合物13与5-氨基-2,4-二叔丁基苯酚缩合反应得到依伐卡托(14,93%,图6e)。随后,对奥索利酸和依伐卡托进行克级合成,总收率较高;有关详细信息,请参阅 ESI 。每个合成可以由研究生在三个工作日内完成,操作简易且生产周期短。
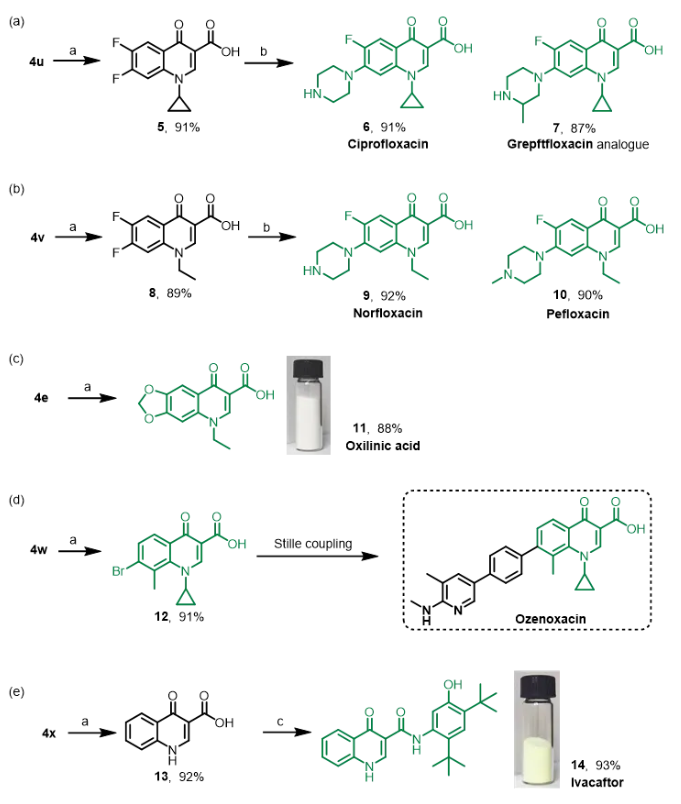
图6 喹诺酮药物分子合成
为了深入了解这种多米诺串联反应机理,我们进行了一系列控制实验,如图7所示。在室温下,与色酮-3-甲醛1a、叔丁胺2a和对甲苯磺酰氯3a反应得到β-烯胺二羰基化合物(15,92%),将反应温度升至100°C时,化合物15顺利转化为化合物4a,收率95%。因此35,由3-甲酰基色酮1a与叔丁胺2a在乙醇中的缩合反应形成的希夫碱是转化过程中的关键中间体。正如我们预期的那样,化合物4a在优化条件下从希夫碱转化而来,产率为88%(图7b)。在我们不加TsCl或K2CO3的条件下,则没有检测到化合物4a的生成(图7c和d)。因此,喹诺酮骨架的合成发生在两个关键步骤中:形成β-烯胺二羰基和希夫碱中间体。
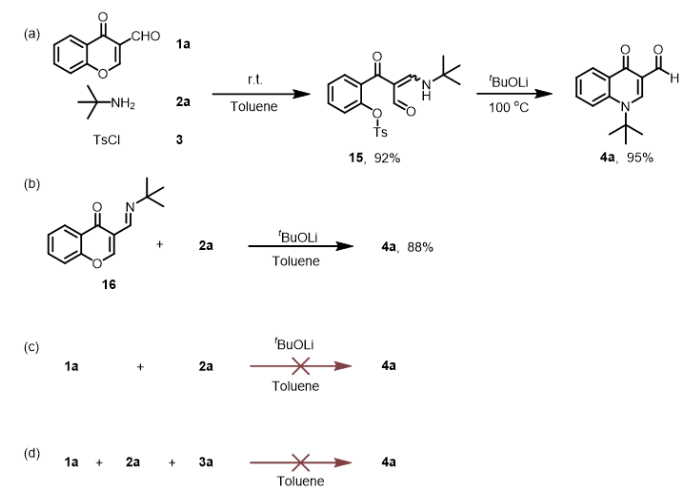
图7 机理验证与控制实验
我们依据文献资料27,31和控制实验,假设反应机理如图8所示。4-喹诺酮类药物的合成,首先色酮-3-甲醛1与胺2缩合生成席夫碱I并脱去一分子水;对甲苯磺酰氯和水作用会产生少量酸(TsOH和HCl),希夫碱I发生质子化得到席夫碱II,水对质子化的希夫碱II的亲核加成反应得到烯胺III;与苯环相连的氧原子是磺化反应过程中形成中间体磺酸盐的关键,然后烯醇IV经过异构化会得到β-烯胺二羰基化合物V。磺酸基作为一个良好的离去基团,将促进分子内亲核取代反应从而形成新的 C–N 键,从而得到最终产品 4.。
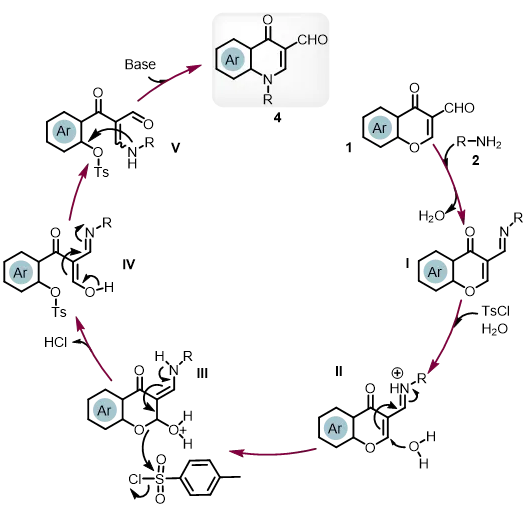
图8 反应机理推测
总之,我们发现了一种以简单易得的色酮-3-甲醛和胺为原料,对甲苯磺酰氯介导的反应构建喹诺酮类药物。重要的是,该方法已成功应用到合成喹诺酮类抗生素药物中,如环丙沙星、诺氟沙星、培氟沙星,噁喹酸,依伐卡托以及格雷夫沙星和奥泽沙星的前体。通过本技术的应用,将喹诺酮药物的合成步骤由原来的8步合成,直接缩短为3步,反应产率提高近3倍,显著缩短反应周期,降低生产成本。本实验室将进一步探索这种绿色多米诺串联反应,应用于合成第四代抗生素药物并开发新型抗菌药物。
参考文献
1S. Pasquini, M. De Rosa, A. Ligresti, C. Mugnaini, A. Brizzi, N. P. Caradonna, M. G. Cascio, D. Bolognini, R. G. Pertwee, V. D. Marzo and F. Corelli, Eur. J. Med. Chem., 2012, 58, 30-43.
2A. Gaurav, M. R. Yadav, R. Giridhar, V. Gautam and R. Singh, Med. Chem. Res., 2011, 20, 192-199.
3V. Cecchetti, C. Parolin, S. Moro, T. Pecere, E. Filipponi, A. Calistri, O. Tabarrini, B. Gatto, M. Palumbo, A. Fravolini and G. Palu, J. Med. Chem., 2000, 43, 3799-3802.
4M. Llinas-Brunet, M. D. Bailey, E. Ghiro, V. Ghorys, T. Halmos, M. Poirier, J. Rancourt and N. Goudreau, J. Med. Chem., 2004, 47, 6584-6594.
5R. M. Cross, A. Monastyrskyi, T. S. Mutka, J. N. Burrows, D. E. Kyle and R. Manetsch, J. Med. Chem., 2010, 53, 7076-7094.
6M. Hadjeri, E.-L. Peiller, C. Beney, N. Deka, M. A. Lawson, C. Dumontet and A. Boumendjel, J. Med. Chem., 2004, 47, 4964-4970.
7Y. Xia, Z.-Y. Yang, P. Xia, T. Hackl, E. Hamel, A. Mauger, J.-H. Wu and K.-H. Lee, J. Med. Chem., 2001, 44, 3932-3936.
8M. Sato, T. Motomura, H. Aramaki, T. Matsuda, M. Yamashita, Y. Ito, H. Kawakami, Y. Matsuzaki, W. Watanabe, K. Yamataka, S. Ikeda, E. Kodama, M. Matsuoka and H. Shinkai, J. Med. Chem., 2006, 49, 1506-1508.
9R. Musiol, Expert. Opin. Drug. Discov., 2017, 12, 583-597.
10Y. Kimura, S. Atarashi,K. Kawakami, K. Sato, I. Hayakawa, J. Med. Chem., 1994, 37, 3344-3352.
11L. A. Mitscher, P. N. Sharma, T. Daniel, W. Chu, J. Med. Chem., 1987, 30, 2283-2286.
12R. Gould and W. Jacobs, J. Am. Chem. Soc., 1939, 61, 2890-2895.
13A. Mermer, N. Demirbas, Y. Sirin, H. Uslu, Z. Özdemir, A. Demirbaş, Bioorg. Chem., 2018, 78, 236-248.
14E. Stern, G. G. Muccioli, R. Millet, J. Goossens, A. Farce, P. Chavatte, J. H. Poupaert, D. M. Lambert, P. Depreux, J. P. Hénichart, J. Med. Chem. 2006, 49, 70-79.
15P. E. Harrington, M. D. Croghan, C. Fotsch, M. Frohn, B. A. Lanman, L. D. Pennington, A. J. Pickrell, A. B. Reed, K. K. C. Sham, Andrew Tasker, H. A. Arnett, M. Fiorino, M. R. Lee, M. McElvain, H. G. Morrison, H. Xu, Y. Xu, X. Zhang, M. Wong, V. J. Cee, ACS Med. Chem. Lett., 2012, 3, 74-78.
16A. C. Flick, H. X. Ding, C. A. Leverett, R. E. Kyne, Jr., K. K. -C. Liu, S. J. Fink, C. J. O’Donnell J. Med. Chem. 2017, 60, 6480-6515.
17D. Lecoq, B. A. Chalmers, R. N. Veedu, D. Kvaskoff, P. V. Bernhardt, C. Wentrup, Aust. J. Chem., 2009, 62, 1631-1638.
18G. R. Lappin, J. Am. Chem. Soc. 1948, 70, 3348-3350.
19R. B. Smith, H. Faki, R. Leslie, Synth. Commun., 2011, 41, 1492-1499.
20Z. Mészáros, I. Hermecz, Tetrahedron Lett., 1975, 12, 1019-1020.
21R. A. Bunce, E. J. Lee, M. T. Grant, J. Heterocyclic Chem., 2011, 48, 620-625.
22R. Song, Y. Wang, M. Wang, R. Gao, T. Yang, S. Yang, C. Yang, Y. Jin, S. Zou, J. Cai, R. Fan, Q. He, Bioorg. Chem., 2020, 103, 104176.
23F. A. Carrey, R. J. Sundberg, Advanced Organic Chemistry: Part A: Structure and Mechanisms (Springer Science, ed. 5, 2007), chap. 3
24N. Poomathi, P. T. Perumala, S. Ramakrishna, Green Chem., 2017, 19, 2524-2529.
25T. Lepitre, R. L. Biannic, M. Othman, A. M. Lawson, A. Daïch, Org. Lett., 2017, 19, 1978-1981.
26J. Y. Liao, W. J. Yap, J. E. Wu, M. W. Wong, Y. Zhao, Chem. Commun., 2017, 53, 9067-9070.
27J. Lei, J. Xu, D.-Y. Tang, J.-W. Shao, H. Li, Z.-Z. Chen, Z.-G. Xu, Org. Chem. Front., 2020, 7, 2657-2663.
28S. Liu, W. Yao, Y. Liu, Q. Wei, J. Chen, X. Wu, F. Xia, W. Hu, Sci. Adv., 2017, 3, e1602467.
29X. Guo, W. Hu, Acc. Chem. Res., 2013, 46, 2427-2440.
30J. He, A. G. K. Reddy, L. Niu, D. Xing, W. Hu, Org. Lett., 2019, 21, 4571-4574.
31J. Lei, Y. Li, J. Xu, D.-Y. Tang, J.-W. Shao, H. Li, Z.-Z. Chen, Z.-G. Xu, Green Chem., 2020, 22, 3716-3720.
32S. Sabatini, F. Gosetto, G. Manfroni, O. Tabarrini, G. W. Kaatz, D. Patel, V. Cecchetti, J. Med. Chem., 2011, 54, 5722-5736.
33S. Srinivasan, R. M. B. Shafreen, P. Nithyanand, P. Manisankar, S. K. Pandian, Eur. J. Med. Chem., 2010, 45, 6101-6105.
34Y. Wang, G. L. V. Damu, J.-S. Lv, R.-X. Geng, D.-C. Yang, C.-H. Zhou, Bioorg. Med. Chem. Lett., 2012, 22, 5363-5366.
35K. M. Khan, N. Ambreen, S. Hussain, S. Perveen, M. I. Choudhary, Bioorg. Med. Chem., 2009, 17, 2983-2988.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn