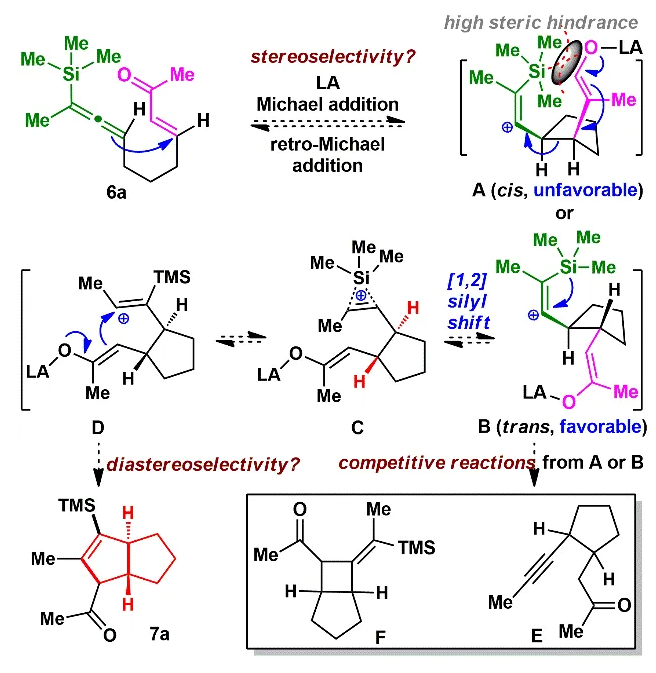
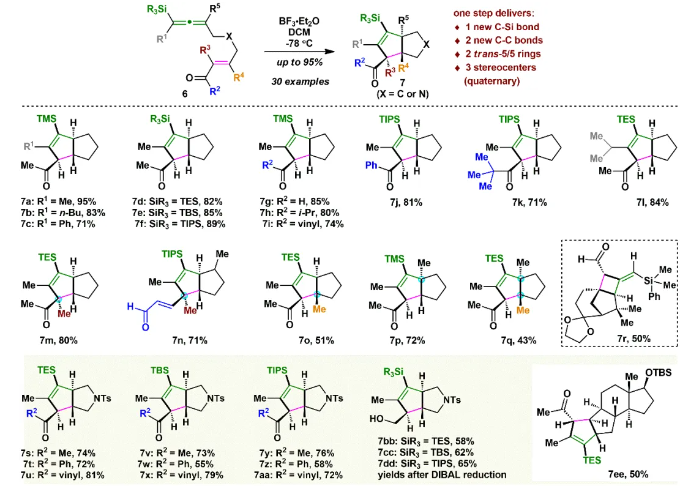
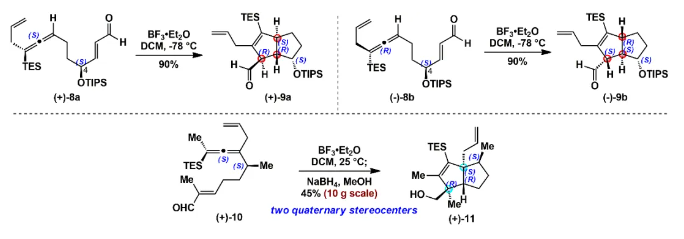
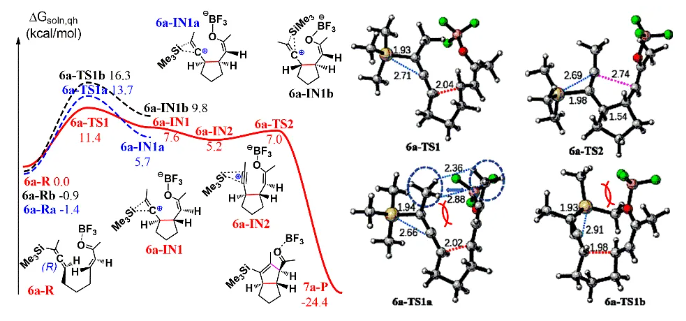
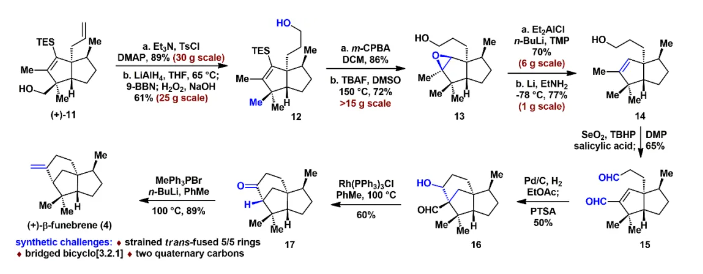
由于和生物靶标的特异性识别和结合,具有良好生物活性的高张力天然产物一直以来是研究的热点和重点。其中代表性的高张力结构之一就是反式5/5并环,与其他高张力结构(弯曲苯环、共轭烯炔和桥头双键)的广泛研究不同,反式5/5并环的合成研究较少。此外,计算和实验数据表明顺式和反式5/5并环之间存在约13 kcal/mol(计算)和6.4 kcal/mol(实验)的能垒差,所以反式5/5并环的构建具有非常大挑战性,迄今为止,只有4个具有全碳反式5/5并环的天然分子得到了全合成,且绝大部分依赖于反式5/6并环通过缩环策略来完成反式5/5并环的构建。而由线型分子一步立体选择性地高效构建反式5/5并环体系,还未有相关报道。化学加——科学家创业合伙人,欢迎下载化学加APP关注。基于以上研究现状,作者设想是否可以设计一个这样的反应:一个链状分子能否在某一条件下发生分子内特定反应,实现反式5/5并环的构建呢?然后作者首先查找了可以构建五元环的反应,排除了一些经典的反应,作者发现Danheiser环化反应可以顺利合成五元环,虽然有分子间合成顺式5/5并环的研究案例,但分子内反应还暂未有相关研究报道,于是作者选定以该反应(分子内[3+2]环化反应)为出发点,来验证作者的想法。受Danheiser教授杰出工作的启发,设想硅基联烯与缺电子烯烃的分子内[3+2]环化反应,是有可能一步反应直接生成反式5/5并环的。假设以含有三甲基硅基联烯和缺电子烯烃的化合物6a为底物(图1),在路易斯酸作用下,联烯会对缺电子烯烃进行分子内Michael加成,构建第一个五元环,由于三甲基硅基联烯和缺电子烯烃的位阻效应,Michael反应更趋向于生成凡是构型的中间体B,随后,中间体发生分子内[1,2]-硅基迁移得到中间体D,最后分子内亲核进攻乙烯基碳正离子得到目标产物化合物7a。然而该反应中的化学选择性(潜在性生成副产物E和F)、非对映选择性和联烯手性迁移问题使得该反应的实现依旧具有很大的挑战性。为了验证该反应的可行性(图2),作者先合成了化合物6a,在三氟化硼乙醚条件下,选择性地得到了单一化合物,经过X射线单晶衍射证实了产物7a的构型确实是反式5/5并环。为了进一步证实该反应的底物普适性,作者合成了17个含有不同硅取代基和多取代的缺电子烯烃,在标准反应该条件下,都以中等至优秀的收率得到了对应反式5/5并环产物。值得一提的是,二取代联烯只能得到5/4并环,不能生成5/5并环,可能由于氢原子不能有效稳定碳正离子;含有5/5/6/5复杂四环骨架的化合物也可顺利合成。此外,含有氮原子的12个底物也能以中等收率得到氮杂反式5/5并环。为了解决联烯手性是否可以发生转移(图3),作者合成了一对非对映体(+)-8a、(-)-8b和化合物(+)-10,在标准反应条件下,均得到对应的产物,单晶结果证实了化合物(-)-9b的绝对构型,该实验结果说明了分子内[3+2]环化反应是可以发生手性转移的。且DFT计算也进一步解释了该反应的区域选择性、非对映选择性(图4),并预测该反应的立体选择性(手性传递)。至此,该分子内[3+2]环化反应一步实现了一个碳硅键、两个碳碳键、两个反式5/5并环和三个手性中心的构建,且化学选择性、区域选择性和立体选择性高,底物普适性良好。在得到化合物11之后,作者将该化合物应用于天然产物β-funebrene的不对称全合成。化合物11经过一级醇上Ts和LiAlH4还原脱掉,后接着硼氢化氧化单取代双键得到化合物12;化合物12在m-CPBA和TBAF条件下脱掉TES,随后在Et2AlCl作用下开环氧以及Li/EtNH2条件下切断二级羟基生成化合物14;化合物14通过烯丙位氧化和DMP氧化得到二醛15,Pd/C氢化双键后,PTSA即可诱使二醛发生aldol反应得到化合物16,最后经过Wilkson催化剂脱羰反应和Wittig反应,即可顺利拿到天然产物β-funebrene。除此之外,作者对该天然产物的核磁共振碳谱进行了纠正(图5)。李闯创课题组发展了一个分子内[3+2]环化高效直接构建高张力反式5/5并环的新方法,该方法具有很好的化学选择性和立体选择性,利用该反应,成功实现了天然产物β-funebrene的首次不对称全合成。该反应丰富了反式5/5并环的构建方法,也为含有反式5/5并环的天然产物全合成提供一个新的合成策略。论文DOI:https://doi.org/10.1016/j.chempr.2023.08.009李闯创教授课题组在天然产物全合成、合成方法学等领域,已取得了一系列颇具特色的学术成果,并在教书育人方面积累了丰富的经验:(1)先后发展了若干独特的合成方法学,例如,首次建立了独特的[5+2]环加成反应,并使该反应成为高效构建多种桥环的新方法,以该反应为新策略,高效合成了一批具有桥环体系的重要天然产物,包括甾体、萜类、生物碱等,进而推动了新型环加成研究方向的发展。(2)发展了新策略,以世界上最短的合成路线,实现了有机合成历史上最难分子之一紫杉醇(重要抗癌药)的高效全合成。(3)在过去的五年中,完成了60余个具有合成挑战性的复杂天然产物全合成(50余个为首次合成),包括了15类不同家族,为后续的药物化学、药理学等研究提供了丰富的物质基础。(4)研究成果多次得到国家基金委(2)、国家科技部、Nature、Nat. Chem.等学术机构或媒体杂志的亮点报道。(5)已培养10余名毕业优秀博士生(先后到哈佛大学、芝加哥大学等大学进行博士后研究),多名学生已在国内知名大学任教授。(6)李闯创教授曾获得或入选:国家杰出青年基金、第三批中组部万人计划领军人才、科技部中青年科技创新领军人才、国家基金委优秀青年基金、广东省自然科学奖一等奖、深圳市自然科学奖一等奖、中国化学会“维善”天然产物合成化学奖、药明康德生命化学研究奖等。课题组网站链接:https://li.chem.sustech.edu.cn/李闯创教授课题组常年招聘博士后、博士研究生、保送推免研究生等,欢迎来信与李闯创教授联系(E-mail: ccli@sustech.edu.cn)。文献详情:
Intramolecular [3 + 2] annulation of allenylsilane-enes: Direct synthesis of highly strained trans-fused 5/5 ring systemsNa Lv,Jing-Chun Han,Peng Zhang,Xin Li,Lung Wa Chung,Chuang-Chuang Lihttps://doi.org/10.1016/j.chempr.2023.08.009